Фибробласт, полученный из искусственной соединительной ткани человека для скрининга
Summary
Здесь представлен протокол для генерации инженерных соединительных тканей для параллельной культуры из 48 тканей в многолуночной пластине с двойными полюсами, подходящей для механистических исследований, моделирования заболеваний и скрининговых приложений. Протокол совместим с фибробластами из разных органов и видов и иллюстрируется здесь с первичными сердечными фибробластами человека.
Abstract
Фибробласты являются фенотипически высокодинамичными клетками, которые быстро трансформенцируются в миофибробласты в ответ на биохимические и биомеханические раздражители. Современное понимание фиброзных процессов, включая сердечный фиброз, остается плохим, что препятствует разработке новых антифиброзных методов лечения. Контролируемые и надежные модельные системы человека имеют решающее значение для лучшего понимания патологии фиброза. Это высоковоспроизводимый и масштабируемый протокол для генерации инженерных соединительных тканей (ЭСТ) в 48-луночной литейной пластине для облегчения исследований фибробластов и патофизиологии фиброзной ткани в 3-мерной (3D) среде. ЭСТ генерируются вокруг полюсов с перестраиваемой жесткостью, что позволяет проводить исследования при определенной биомеханической нагрузке. При определенных условиях нагрузки могут быть изучены фенотипические адаптации, контролируемые клеточно-матричными взаимодействиями. Параллельное тестирование возможно в формате 48 скважин с возможностью анализа времени и времени нескольких параметров, таких как уплотнение и сжатие тканей против нагрузки. Из этих параметров можно изучать биомеханические свойства, такие как жесткость и эластичность тканей.
Introduction
Основным препятствием в изучении фиброзных заболеваний является отсутствие репрезентативных 3D-моделей тканей человека, которые дают представление о поведении фибробластов и их патологических производных. Для изучения фиброзных процессов стандартные системы 2D-культур являются неоптимальными, поскольку изолированные фибробласты быстро трансформенцируются в α гладкомышечные актины (СМА), экспрессирующие миофибробласты при культивировании на несоответствующих 2D-субстратах1,2,3. Таким образом, фибробласты в стандартной 2D культуре не отражают регулярный «здоровый» тканевый фенотип3,4,5,6. Культуры на гибких субстратах были введены для моделирования нефиброзной (10 кПа) и фиброзной (35 кПа) тканевой среды7, но им не хватает третьего измерения, что очень важно в отношении патофизиологии. Тканевая инженерия дает возможность преодолеть это ограничение, позволяя культивировать фибробласты в определенном и экспериментально перестраиваемом внеклеточном матриксе (ECM) -контексте, например, путем изменения клеточности, состава ECM и концентрации ECM, все из которых могут определять биомеханику ткани.
Различные 3D-модели были сгенерированы с использованием фибробластов. Плавающие диски и микросферы были одними из первых и демонстрируют, что коллаген ремоделируется и уплотняется в зависимости от времени. Фибробласты оказывают тракционные силы на коллагеновые фибриллы, процесс, который может быть облегчен добавлением профиброзных агентов, таких как трансформирующий фактор роста бета-1 (TGF-β1)8,9,10,11,12,13,14,15,16. Однако свободно плавающие культуры не допускают контролируемой внешней нагрузки и, следовательно, представляют собой непрерывно уменьшающиеся или уплотняющиеся модели. Листовидные инженерные ткани открыли возможность изучения гомеостатической регуляции биомеханических свойств тканей, а именно посредством одно-, би-, многоосевого или циклического тестирования деформаций17,18,19,20. Эти модели были использованы, например, для демонстрации влияния клеточного числа на жесткость тканей, которая, как было установлено, положительно коррелирует с целостностью цитоскелета и сократимостью цитоскелета актомиозина.18,19. Однако важно отметить, что превращения силы в деформацию осложняются неравномерной деформацией тканей вокруг точек зажима силовых преобразователей и опорных точек. Это внутреннее ограничение может быть обойдено собачьими костями или кольцеобразными тканями, предлагая некоторое укрепление тканей в опорных точках.21,22,23. Кольцеобразные ткани могут быть получены путем распределения клеточно-коллагенового гидрогеля в кольцеобразные формы. Когда гидрогель сжимается, вокруг несжимаемого внутреннего стержня формы образуется ткань, которая обеспечивает сопротивление дальнейшему сокращению ткани.24,25,26,27. После начального и, как правило, максимального уплотнения ткани также могут быть перенесены в регулируемые спейсеры для дальнейшего сдерживания круговой ЭСТ на определенной длине ткани.3,24,25,26,27,28,29,30. Биофизические свойства могут быть оценены в стандартных горизонтальных или вертикальных устройствах напряжения напряжения с соответствующими тензодатчиками при однонаправленной или динамической деформации3. Поскольку ткани имеют в значительной степени однородную круговую структуру и могут удерживаться на стержнях / крючках (точках крепления и / или преобразователях силы), хотя они все еще могут заключать области сжатия вокруг нагрузочных стержней, этот формат позволяет более равномерно варьировать деформацию по сравнению с зажимом.3. Кроме того, закрепленные ткани вызывают биполярную форму клеток, и клетки приспосабливаются к тканевым силам путем удлинения вдоль силовых линий, способствующих анизотропному вытяжению.31,32,33,34,35,36. Ранее мы применяли кольцеобразную ЭСТ от сердечных фибробластов крыс и человека (МВ) вокруг одного жесткого полюса в экспериментах с функциональным напряжением-деформацией и проводили исследования усиления и потери функции с использованием вирусно трансдуцированных фибробластов.24,25,26 и фармакологические исследования37. Кроме того, мы могли бы определить половые различия при муковисцидозе, опосредованном муковисцидозом, в модели ЭСТ.27.
Следующий протокол для генерации ЭСТ человека, примером которого является первичный человеческий муковисцидоз, полученный в виде криоконсервированного CF от коммерческих поставщиков (см. Таблицу материалов), сочетает в себе преимущества кольцеобразных тканей с простым и быстрым способом получения макроскопических тканей для 48-луночной платформы, предназначенной для параллельного тестирования с высоким содержанием.
Важно отметить, что модель ЭСТ не ограничена конкретным типом фибробластов, с документированным использованием в исследовании других фибробластов, например, фибробластов кожи38,39. Более того, фибробласты из биопсии пациента работают одинаково хорошо, и выбор фибробластов в конечном итоге зависит от научного вопроса, который необходимо решить.
Платформа, используемая для генерации ЭСТ, описанная в этом протоколе, представляет собой коммерчески доступную 48-луночную 3D-пластину для культивирования клеток/тканей (рисунок 1A). Описаны способы подготовки, культивирования и контроля образования и функционирования ЭСТ при заданной геометрии и механической нагрузке с помощью 48-луночной пластины. Сформированные ЭСТ удерживаются встроенными гибкими полюсами, и механическая нагрузка может быть точно настроена в соответствии с конечной целью с помощью полюсов с различной твердостью (значение Shore A 36-89), влияя на их жесткость изгиба. Рекомендуются столбы с берегом значения А 46. Протокол, кроме того, совместим с ранее описанной пользовательской круглой формой, где ЭСТ удерживается вокруг одного жесткого стержня37. Размеры этой формы приведены на рисунке 1B.
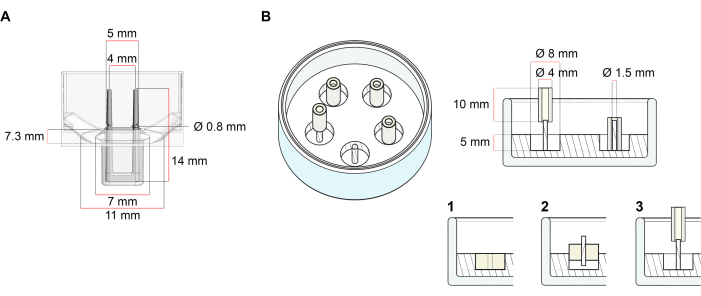
Рисунок 1: Схематическое изображение литейных форм. (A) Технический чертеж и размеры литейной формы с двумя гибкими полюсами. Форма содержит внутреннюю окружность, ограниченную короткой стенкой, которая удерживает двойные подпорные столбы в основном корпусе формы. Гибкие полюса имеют свободное горизонтальное расстояние друг от друга и соединены у основания. Пресс-форма допускает объем литья 180 мкл. Лунка каждой формы допускает объемную емкость не менее 600 мкл питательной среды. Различные композиции материалов могут быть использованы для получения столбов с определенной жесткостью (например, TM5MED-TM9MED). (B) Технический чертеж и размеры кольцеобразной формы с одним жестким стержнем. Это альтернативная форма с различной геометрией и механической средой, которая может использоваться с протоколом литья ECT37. Кольцеобразный метод сборки пресс-форм был адаптирован из опубликованных более крупных форматов28,41. Вкратце, способ включает в себя (1) импринтирование политетрафторэтиленовых (PTFE) формовочных распорок (диаметром 8 мм) в полидиметилсилоксане (PDMS, силикон), налитых в стеклянную посуду (диаметр 60 мм), и (2) фиксацию держателя полюса PDMS (диаметр 1,5 мм) концентрически внутри образовавшейся полой полости, которая служит для (3) удержания съемного полюса (силиконовая трубка диаметром 4 мм). Образовавшееся полое пространство позволяет увеличить объем литья 180 мкл. Каждая стеклянная тарелка может вмещать несколько отпечатанных форм (на примере с 5 формами) и имеет емкость до 5 мл питательной среды. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Protocol
Representative Results
Discussion
Представленный протокол описывает генерацию ЭСТ от первичного муковисцидоза человека, что позволяет изучить механическое воздействие этих клеток на их внеклеточную матричную среду и наоборот.
Фибробласты должны быть расширены, чтобы получить достаточное количество к…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Эта работа была поддержана Немецким кардиологическим обществом (DGK Research Fellowship for GLS) и Немецким исследовательским фондом (DFG в рамках проекта IRTG 1816 для GLS и AD; DFG 417880571 и DFG TI 956/1-1 для MT; SFB 1002 TP C04 для MT и WHZ; SFB 1002 TP S01 для WHZ; и EXC 2067/1-390729940J для WHZ). WHZ поддерживается Федеральным министерством науки и образования Германии (BMBF через проект IndiHEART) и Fondation Leducq (20CVD04). MT, WHZ и SL поддерживаются Немецким центром сердечно-сосудистых исследований (DZHK).
Materials
| Cell culture reagents: | |||
| Accutase Solution | Merk Millipore | SCR005 | |
| Dissociation reagent – TrypLE Express | Gibco | 12604013 | |
| Dulbecco's Modified Eagle Medium (DMEM) powder, high glucose | Gibco | 12100061 | |
| Dulbecco’s phosphate buffered saline (DPBS), pH 7.2, -Ca2+, -Mg2+ | Gibco | 14190144 | |
| FGM-2 Fibroblast Growth Medium-2 BulletKit | Lonza | CC-3132 | |
| FBM Fibroblast Growth Basal Medium | Lonza | CC-3131 | |
| FGM-2 Fibroblast Growth Medium-2 SingleQuots, Supplements and Growth Factors | Lonza | CC-4126 | |
| Fibroblast Growth Medium 3 KIT | PromoCell | C-23130 | |
| Fibroblast Basal Medium 3 | PromoCell | C-23230 | |
| Growth Medium 3 SupplementPack | PromoCell | C-39350 | |
| Penicillin (10000 U/mL)/ Streptomycin (10000 μL/mL) | Gibco | 15140122 | |
| Sodium hydroxide solution (NaOH) 1.0 N | Sigma-Aldrich | S2770-100ML | |
| Cell sources: | |||
| Normal human cardiac fibroblasts from the ventricle (NHCF-V) | Lonza | CC-2904 | |
| Human Cardiac Fibroblasts (HCF-c) | PromoCell | C-12375 | |
| Human Cardiac Fibroblasts (HCF-p) | PromoCell | C-12377 | |
| Primary human foreskin fibroblasts-1 (HFF-1) | ATCC | SCRC- 1041 | |
| Collagen sourses: | |||
| Collagen Type I (bovine) in 0.01 M HCl | LLC Collagen Solutions | FS22024 | 6-7 mg/mL |
| Collagen Type I (rat tail) in 0.02 M HCl | Corning | 354236 | ~4 mg/mL |
| Drugs: | |||
| Latrunculin-A (Lat-A) | Enzo Life Sciences | BML-T119-0100 | |
| Plastic ware: | |||
| Cell culture plastic ware | Sarstedt and Starlab | ||
| Mesh cell strainer (Nylon, pore size 40 μm) | Falcon | 352340 | |
| myrPlate-uniform | myriamed GmbH | TM5 med | |
| Serological pipettes wide opening, sterile (10 mL) | Corning | 07-200-619 | |
| Specific instruments: | |||
| Bi-telecentric CORE lens for 1/2″ detectors | OptoEngineering | TCCR12096 | |
| Area scan camera Basler ace acA4024 | Basler | 107404 |
References
- Driesen, R. B., et al. Reversible and irreversible differentiation of cardiac fibroblasts. Cardiovascular Research. 101 (3), 411-422 (2014).
- Shi, X., et al. Elasticity of cardiac cells on the polymer substrates with different stiffness: an atomic force microscopy study. Physical Chemistry Chemical Physics. 13 (16), 7540-7545 (2011).
- Elson, E. L., Genin, G. M. Tissue constructs: platforms for basic research and drug discovery. Interface Focus. 6 (1), 20150095 (2016).
- Cho, N., Razipour, S. E., McCain, M. L. TGF-beta1 dominates extracellular matrix rigidity for inducing differentiation of human cardiac fibroblasts to myofibroblasts. Experimental Biology and Medicine. 243 (7), 601-612 (2018).
- Cucoranu, I., et al. NAD(P)H oxidase 4 mediates transforming growth factor-beta1-induced differentiation of cardiac fibroblasts into myofibroblasts. Circulation Research. 97 (9), 900-907 (2005).
- Peng, H., Carretero, O. A., Peterson, E. L., Rhaleb, N. E. Ac-SDKP inhibits transforming growth factor-beta1-induced differentiation of human cardiac fibroblasts into myofibroblasts. American Journal of Physiology-Heart and Circulatory Physiology. 298 (5), 1357-1364 (2010).
- Ribeiro, A. J., et al. Contractility of single cardiomyocytes differentiated from pluripotent stem cells depends on physiological shape and substrate stiffness. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12705-12710 (2015).
- Tranquillo, R. T., Durrani, M. A., Moon, A. G. Tissue engineering science: consequences of cell traction force. Cytotechnology. 10 (3), 225-250 (1992).
- Barocas, V. H., Moon, A. G., Tranquillo, R. T. The fibroblast-populated collagen microsphere assay of cell traction force–Part 2: Measurement of the cell traction parameter. Journal of Biomechanical Engineering. 117 (2), 161-170 (1995).
- Lijnen, P., Petrov, V., Rumilla, K., Fagard, R. Stimulation of collagen gel contraction by angiotensin II and III in cardiac fibroblasts. Journal of the Renin-Angiotensin-Aldosterone System. 3 (3), 160-166 (2002).
- Baxter, S. C., Morales, M. O., Goldsmith, E. C. Adaptive changes in cardiac fibroblast morphology and collagen organization as a result of mechanical environment. Cell Biochemistry and Biophysics. 51 (1), 33-44 (2008).
- Zhou, Y., et al. Inhibition of mechanosensitive signaling in myofibroblasts ameliorates experimental pulmonary fibrosis. Journal of Clinical Investigation. 123 (3), 1096-1108 (2013).
- Lijnen, P., Petrov, V., Fagard, R. In vitro assay of collagen gel contraction by cardiac fibroblasts in serum-free conditions. Methods and Findings in Experimental and Clinical Pharmacology. 23 (7), 377-382 (2001).
- Burgess, M. L., et al. Integrin-mediated collagen gel contraction by cardiac fibroblasts. Effects of angiotensin II. Circulation Research. 74 (2), 291-298 (1994).
- Nunohiro, T., Ashizawa, N., Graf, K., Hsueh, W. A., Yano, K. Angiotensin II promotes integrin-mediated collagen gel contraction by adult rat cardiac fibroblasts. Japanese Heart Journal. 40 (4), 461-469 (1999).
- Ngu, J. M., et al. Human cardiac fibroblast extracellular matrix remodeling: Dual effects of tissue inhibitor of metalloproteinase-2. Cardiovascular Pathology. 23 (6), 335-343 (2014).
- Knezevic, V., Sim, A. J., Borg, T. K., Holmes, J. W. Isotonic biaxial loading of fibroblast-populated collagen gels: a versatile, low-cost system for the study of mechanobiology. Biomechanics and Modeling in Mechanobiology. 1 (1), 59-67 (2002).
- Delvoye, P., Wiliquet, P., Leveque, J. L., Nusgens, B. V., Lapiere, C. M. Measurement of mechanical forces generated by skin fibroblasts embedded in a three-dimensional collagen gel. Journal of Investigative Dermatology. 97 (5), 898-902 (1991).
- Kolodney, M. S., Elson, E. L. Correlation of myosin light chain phosphorylation with isometric contraction of fibroblasts. Journal of Biological Chemistry. 268 (32), 23850-23855 (1993).
- Bell, B. J., Nauman, E., Voytik-Harbin, S. L. Multiscale strain analysis of tissue equivalents using a custom-designed biaxial testing device. Biophysical Journal. 102 (6), 1303-1312 (2012).
- Wakatsuki, T., Kolodney, M. S., Zahalak, G. I., Elson, E. L. Cell mechanics studied by a reconstituted model tissue. Biophysical Journal. 79 (5), 2353-2368 (2000).
- Thomopoulos, S., et al. Fibrocartilage tissue engineering: The role of the stress environment on cell morphology and matrix expression. Tissue Engineering Part A. 17 (7-8), 1039-1053 (2011).
- Roeder, B. A., Kokini, K., Sturgis, J. E., Robinson, J. P., Voytik-Harbin, S. L. Tensile mechanical properties of three-dimensional type I collagen extracellular matrices with varied microstructure. Journal of Biomechanical Engineering. 124 (2), 214-222 (2002).
- Ongherth, A., et al. p63RhoGEF regulates auto- and paracrine signaling in cardiac fibroblasts. Journal of Molecular and Cellular Cardiology. 88, 39-54 (2015).
- Vettel, C., et al. PDE2-mediated cAMP hydrolysis accelerates cardiac fibroblast to myofibroblast conversion and is antagonized by exogenous activation of cGMP signaling pathways. American Journal of Physiology-Heart and Circulatory Physiology. 306 (8), 1246-1252 (2014).
- Jatho, A., et al. RhoA Ambivalently Controls Prominent Myofibroblast Characteritics by Involving Distinct Signaling Routes. PLoS One. 10 (10), 0137519 (2015).
- Dworatzek, E., et al. Sex-specific regulation of collagen I and III expression by 17beta-Estradiol in cardiac fibroblasts: role of estrogen receptors. Cardiovascular Research. 115 (2), 315-327 (2019).
- Tiburcy, M., Meyer, T., Soong, P. L., Zimmermann, W. H. Collagen-based engineered heart muscle. Methods in Molecular Biology. 1181, 167-176 (2014).
- Schlick, S. F., et al. Agonistic and antagonistic roles of fibroblasts and cardiomyocytes on viscoelastic stiffening of engineered human myocardium. Progress in Biophysics and Molecular Biology. 144, 51-60 (2019).
- Wille, J. J., Elson, E. L., Okamoto, R. J. Cellular and matrix mechanics of bioartificial tissues during continuous cyclic stretch. Annals of Biomedical Engineering. 34 (11), 1678-1690 (2006).
- Berry, C. C., Shelton, J. C., Bader, D. L., Lee, D. A. Influence of external uniaxial cyclic strain on oriented fibroblast-seeded collagen gels. Tissue Engineering. 9 (4), 613-624 (2003).
- Stopak, D., Harris, A. K. Connective tissue morphogenesis by fibroblast traction. I. Tissue culture observations. Developmental Biology. 90 (2), 383-398 (1982).
- Bellows, C. G., Melcher, A. H., Aubin, J. E. Association between tension and orientation of periodontal ligament fibroblasts and exogenous collagen fibres in collagen gels in vitro. Journal of Cell Science. 58 (1), 125-138 (1982).
- Tranquillo, R. T. Self-organization of tissue-equivalents: the nature and role of contact guidance. Biochemical Society Symposia. 65, 27-42 (1999).
- Barocas, V. H., Tranquillo, R. T. An anisotropic biphasic theory of tissue-equivalent mechanics: the interplay among cell traction, fibrillar network deformation, fibril alignment, and cell contact guidance. Journal of Biomechanical Engineering. 119 (2), 137-145 (1997).
- Yip, A. K., et al. Anisotropic traction stresses and focal adhesion polarization mediates topography-induced cell elongation. Biomaterials. 181, 103-112 (2018).
- Santos, G. L., Hartmann, S., Zimmermann, W. H., Ridley, A., Lutz, S. Inhibition of Rho-associated kinases suppresses cardiac myofibroblast function in engineered connective and heart muscle tissues. Journal of Molecular and Cellular Cardiology. 134, 13-28 (2019).
- Kittana, N., et al. Modulating the biomechanical properties of engineered connective tissues by chitosan-coated multiwall carbon nanotubes. International Journal of Nanomedicine. 16, 989-1000 (2021).
- Kittana, N., et al. Enhancement of wound healing by single-wall/multi-wall carbon nanotubes complexed with chitosan. International Journal of Nanomedicine. 13, 7195-7206 (2018).
- Antoine, E. E., Vlachos, P. P., Rylander, M. N. Review of collagen I hydrogels for bioengineered tissue microenvironments: characterization of mechanics, structure, and transport. Tissue Engineering Part B: Reviews. 20 (6), 683-696 (2014).
- Holder, A. J., et al. Control of collagen gel mechanical properties through manipulation of gelation conditions near the sol-gel transition. Soft Matter. 14 (4), 574-580 (2018).
- Zimmermann, W. H., et al. Tissue engineering of a differentiated cardiac muscle construct. Circulation Research. 90 (2), 223-230 (2002).

