Studies van Chaperone-Cochaperone Interacties met behulp van Homogene Bead-Based Assay
Summary
Dit protocol presenteert een techniek voor het onderzoeken van eiwit-eiwitinteracties met behulp van glutathion-gekoppelde donorkralen met GST-gefuseerde TPR-motief co-chaperones en acceptor kralen in combinatie met een Hsp90-afgeleid peptide. We hebben deze techniek gebruikt om kleine moleculen te screenen om Hsp90-FKBP51- of Hsp90-FKBP52-interacties te verstoren en hebben krachtige en selectieve Hsp90-FKBP51-interactieremmers geïdentificeerd.
Abstract
Het richten op de heat shock eiwit 90 (Hsp90)-cochaperon interacties biedt de mogelijkheid om specifiek Hsp90-afhankelijke intracellulaire processen te reguleren. Het geconserveerde MEEVD pentapeptide aan de C-terminus van Hsp90 is verantwoordelijk voor de interactie met het tetratricopeptide repeat (TPR) motief van co-chaperones. FK506-bindend eiwit (FKBP) 51 en FKBP52 zijn twee vergelijkbare TPR-motief co-chaperones die betrokken zijn bij steroïde hormoonafhankelijke ziekten met verschillende functies. Daarom biedt het identificeren van moleculen die specifiek interacties tussen Hsp90 en FKBP51 of FKBP52 blokkeren, een veelbelovend therapeutisch potentieel voor verschillende menselijke ziekten. Hier beschrijven we het protocol voor een versterkte luminescerende nabijheid homogene assay om interacties tussen Hsp90 en zijn partner co-chaperones FKBP51 en FKBP52 te onderzoeken. Ten eerste hebben we de TPR-motiefbevattende eiwitten FKBP51 en FKBP52 gezuiverd in glutathion S-transferase (GST)-gelabelde vorm. Met behulp van de glutathion-gekoppelde donorkralen met GST-gefuseerde TPR-motiefeiwitten en de acceptorkralen in combinatie met een 10-mer C-terminal peptide van Hsp90, hebben we eiwit-eiwitinteracties in een homogene omgeving onderzocht. We hebben deze test gebruikt om kleine moleculen te screenen om Hsp90-FKBP51- of Hsp90-FKBP52-interacties te verstoren en hebben krachtige en selectieve Hsp90-FKBP51-interactieremmers geïdentificeerd.
Introduction
Moleculaire chaperones dragen bij aan eiwithomeostase, inclusief eiwitvouwing, transport en afbraak. Ze reguleren verschillende cellulaire processen en zijn gekoppeld aan tal van ziekten zoals kanker en neurodegeneratieve ziekten1. Heat shock protein 90 (Hsp90) is een van de belangrijkste chaperones waarvan de functie afhankelijk is van conformatiesveranderingen aangedreven door ATP-hydrolyse en binding met cliënteiwitten gemedieerd door zijn co-chaperones2. Ondanks een duidelijk potentieel van Hsp90 als het therapeutische doelwit, vormt het verfijnen van de functie ervan een grote uitdaging. Er zijn verschillende Hsp90-remmers gericht op het N-terminale ATP-bindingsgebied, die zijn geëvalueerd in klinische onderzoeken, maar geen van hen is goedgekeurd voor het op de markt brengen3. Vanwege het ontbreken van een goed gedefinieerde ligandbindende pocket4,heeft het richten op het C-terminale gebied van Hsp90 beperkt succes gehad4. Onlangs is verstoring van Hsp90-cochaperoninteracties door kleine moleculen onderzocht als een alternatieve strategie5. Het richten op de Hsp90-cochaperoninteracties zou geen algemene celstressrespons uitlokken en biedt de mogelijkheid om specifiek verschillende intracellulaire processen te reguleren. Het geconserveerde MEEVD pentapeptide aan de C-terminus van Hsp90 is verantwoordelijk voor de interactie met het tetratricopeptide repeat (TPR) motief van co-chaperones6. Van de 736 TPR-motiefbevattende eiwitten die zijn geannoteerd in de menselijke eiwitdatabase, interageren ~ 20 verschillende eiwitten met Hsp90 via dit peptide7. Moleculen die concurreren om MEEVD-peptidebinding zouden de interacties tussen Hsp90 en co-chaperones die een TPR-domein bevatten, verstoren. De peptidebindingsplaats heeft een vergelijkbare tertiaire structuur, maar de algehele homologie tussen verschillende TPR-motiefdomeinen is relatief laag7, wat een mogelijkheid biedt om moleculen te identificeren die specifiek in staat zijn om interacties tussen Hsp90 en bepaalde TPR-motief co-chaperones te blokkeren. Onder deze TPR-motief co-chaperones, FK506-bindend eiwit (FKBP) 51 en FKBP52 zijn regulatoren van steroïde hormoonreceptor (SHR) signalering en betrokken bij verschillende steroïde hormoon-afhankelijke ziekten, waaronder kanker, stress-gerelateerde ziekten, metabole ziekten, en de ziekte van Alzheimer8. Hoewel FKBP51 en FKBP52 > 80% sequentie-gelijkenis delen, verschillen hun functies: FKBP52 is een positieve regulator van SHR-activiteit, terwijl FKBP51 in de meeste gevallen een negatieve regulator is8. Daarom biedt het identificeren van moleculen, die specifiek interacties tussen Hsp90 en FKBP51 of FKBP52 blokkeren, een veelbelovend therapeutisch potentieel voor gerelateerde ziekten.
Eenmplified Luminescent Proximity Homogenous Assay (AlphaScreen) werd voor het eerst ontwikkeld in 1994 door Ullman EF et al.9. Nu wordt het veel gebruikt om verschillende soorten biologische interacties te detecteren, zoals peptide10,eiwit11,DNA12,RNA13en suiker14. Bij deze techniek zijn er twee soorten kralen (diameter 200 nm), de ene is de donorkraal en de andere is de acceptorkraal. De biomoleculen worden op deze kralen geïmmobiliseerd; hun biologische interacties brengen donor- en acceptorkralen in de buurt. Bij 680 nm licht een foto-ensitizer in de donorkraal op en zet zuurstof om in singletzuurstof. Omdat de singletzuurstof een korte levensduur heeft, kan deze slechts tot 200 nm diffunderen. Als de acceptorkraal in de buurt is, reageert het thioxeenderivaat met de singletzuurstof die chemiluminescentie genereert bij 370 nm. Deze energie activeert verder fluoroforen in dezelfde acceptorkraal om licht uit te stralen bij 520-620 nm15. Als de biologische interacties worden verstoord, kunnen de acceptorkraal en donorkraal de nabijheid niet bereiken, wat resulteert in het singlet zuurstofverval en een laag geproduceerd signaal.
Hier beschrijven we een protocol met behulp van deze techniek voor het screenen van kleine moleculen die interacties tussen Hsp90 en TPR co-chaperones remmen, met name FKBP51 en FKBP52. De 10 aminozuur lange peptiden die overeenkomen met Hsp90 extreme C-terminus zijn bevestigd aan acceptor kralen. Gezuiverde GST-gelabelde TPR co-chaperones interageren met glutathion-gekoppelde donorkralen. Wanneer de interactie tussen Hsp90-afgeleide peptiden en TPR-motief co-chaperones de kralen samenbrengt, wordt een versterkt signaal geproduceerd (Figuur 1A). Als de gescreende kleine moleculen de interacties tussen Hsp90 en TPR-motief co-chaperones kunnen remmen, zal dit versterkte signaal worden verminderd(figuur 1B). Hun IC50 kan worden berekend door kwantitatieve meting. Dit protocol kan worden uitgebreid naar alle chaperonne – TPR-motief co-chaperonne interacties van belang en is van groot belang bij de ontwikkeling van nieuwe moleculen, met name het blokkeren van de interactie tussen Hsp90 en FKBP51 of FKBP52.
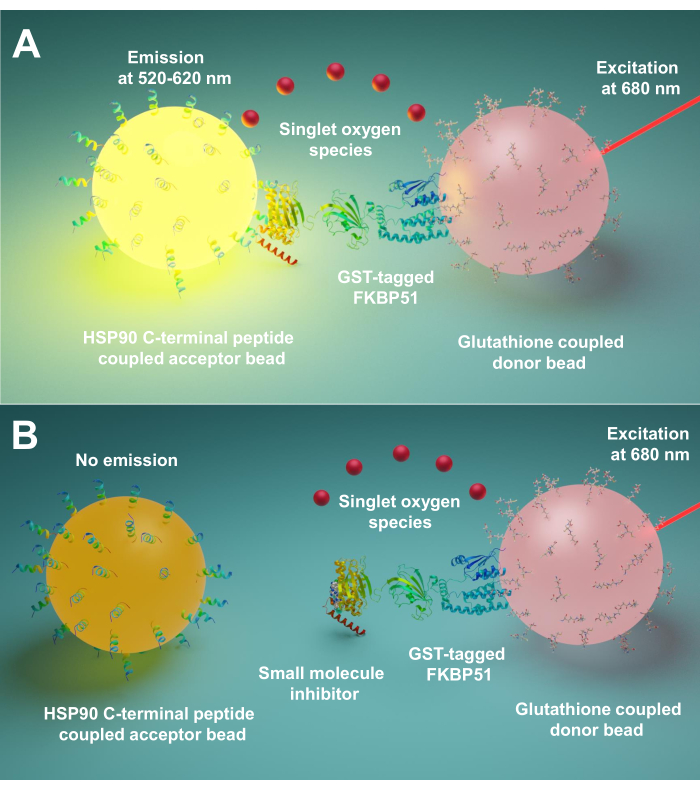
Figuur 1: Het basisprincipe van deze test. (A) Purified GST-FKBP51 interageert met glutathion-gebonden donorkralen. De 10 aminozuur lange peptiden die overeenkomen met de extreme C-terminus van Hsp90 zijn bevestigd aan acceptor kralen. De interactie tussen van Hsp90 afgeleide peptiden en het TPR-domein van FKBP51 brengt de donor- en acceptorparels in de nabijheid. Bij 680 nm licht een foto-ensitizer in de donorkraal op en zet zuurstof om in singletzuurstof. Het thioxeenderivaat op de acceptorkraal reageert met de singletzuurstof en genereert chemiluminescentie bij 370 nm. Deze energie activeert verder fluoroforen in dezelfde acceptorkraal om licht uit te stralen bij 520-620 nm. BWanneer kleine moleculen de interacties tussen Hsp90 en FKBP51 remmen, kunnen de donor- en acceptorparels de nabijheid niet bereiken. Dan vervalt de singletzuurstof met een korte levensduur en wordt er geen detecteerbaar signaal geproduceerd. Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
Hier beschrijven we een protocol met behulp van de test voor het screenen van kleine moleculen die interacties tussen Hsp90 en TPR-motief co-chaperones remmen, met name FKBP51 en FKBP52. De hoge Z’-score (>0,8) toont de robuustheid en betrouwbaarheid voor een formaat met hoge doorvoer. Resultaten kunnen binnen een uur worden verkregen en kleine hoeveelheden kralen, eiwitten en verbindingen zijn vereist. Bovendien kan dit protocol gemakkelijk worden uitgebreid naar alle Hsp90 / Hsp70 – TPR-motief co-chaperonne-interacties…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Deze studie werd ondersteund door subsidies van de Swedish Research Council (2018-02843), Brain Foundation (Fo 2019-0140), Foundation for Geriatric Diseases aan het Karolinska Institutet, Gunvor and Josef Anérs Foundation, Magnus Bergvalls Foundation, Gun and Bertil Stohnes Foundation, Tore Nilssons Foundation for medical research, Margaretha af Ugglas foundation en de Foundation for Old Servants.
Materials
| 384-well plates | Perkin Elmer | 6008350 | Assay volume 25 ml |
| Amicon 10.000 MWCO centrifugation unit | Millipore | UFC901008 | Concentrate protein |
| Ampicillin | Sigma | A0166 | Antibiotics |
| Bacteria shaker Unimax 1010 | Heidolph | Culture bacteria | |
| cDNA clones for human FKBP51 | Source BioScience | clone id: 5723416 | pCMV-SPORT6 vector |
| cDNA clones for human FKBP52 | Source BioScience | clone id: 7474554 | pCMV-SPORT6 vector |
| Chemically Competent E. coli | Invitrogen | C602003 | One Shot BL21 Star (DE3) |
| Data analysis software | GraphPad Prism | 9.0.0 | Analysis data and make figures |
| Data analysis software | Excel | Analysis data | |
| DMSO | Supelco | 1.02952.1000 | Dilute compounds |
| DPBS | Gibco | 14190-144 | Prepare solution |
| EDTA | Calbiochem | 344504 | Prevent proteolysis during sonication |
| Glutathione | Sigma | G-4251 | Elute GST-tagged proteins |
| Glutathione donor beads | Perkin Elmer | 6765300 | Donor bead |
| GST-trap column | Cytiva (GE Healthcare) | 17528201 | Purify GST-tagged proteins |
| Isopropyl-β-D-thiogalactoside | Thermo Fisher Scientific | R0392 | Induce protein expression |
| LB Broth (Miller) | Sigma | L3522 | Microbial growth medium |
| PCR instrument | BIO-RAD | S1000 Thermal Cycler | Amplification/PCR |
| PD-10 column | Cytiva (GE Healthcare) | 17085101 | Solution exchange |
| pGEX-6P-1 vector | Cytiva (GE Healthcare) | 28954648 | Plasmid |
| pGEX-6P-2 vector | Cytiva (GE Healthcare) | 28954650 | Plasmid |
| Plate reader | Perkin Elmer | EnSpire 2300 Multilabel Reader | Read alpha plate |
| Plate reader software | Perkin Elmer | EnSpire Manager | Plate reader software |
| Plate reader software protocol | Perkin Elmer | Alpha 384-well Low volume | Use this protocol to read plate |
| PMSF | Sigma | P7626 | Prevent proteolysis during sonication |
| protease inhibitor cocktail | Sigma | S8830 | Prevent proteolysis during sonication |
| Sodium azide | Sigma | S2002 | As a preservative |
| Sodium cyanoborohydride (NaBH3CN) | Sigma | 156159 | Activates matrix for coupling |
| Ten amino acid peptide NH2-EDASRMEEVD-COOH corresponding to amino acids 714-724 of human Hsp90 beta isoform | Peptide 2.0 inc | Synthesize Hsp90 C-terminal peptide | |
| Test-Tube Rotator | LABINCO | Make end-over-end agitation | |
| Tris-HCl | Sigma | 10708976001 | Block unreacted sites of acceptor beads |
| Tween-20 | Sigma | P1379 | Prevent beads aggregation |
| Ultra centrifuge Avanti J-20 XP | Beckman Coulter | Centrifuge to get bacteria cell pellets | |
| Ultrasonic cell disruptor | Microson | Sonicate cells to release protein | |
| Unconjugated acceptor beads | Perkin Elmer | 6762003 | Acceptor beads |
| XCell SureLock Mini-Cell and XCell II Blot Module | Invitrogen | EI0002 | SDS-PAGE |
Riferimenti
- Muchowski, P. J., Wacker, J. L. Modulation of neurodegeneration by molecular chaperones. Nature Reviews Neuroscience. 6 (1), 11-22 (2005).
- Eckl, J. M., Richter, K. Functions of the Hsp90 chaperone system: lifting client proteins to new heights. International Journal of Biochemistry and Molecular Biology. 4 (4), 157-165 (2013).
- Yuno, A. Clinical evaluation and biomarker profiling of Hsp90 inhibitors. Methods in Molecular Biology. 1709, 426-441 (2018).
- Dutta Gupta, S., Bommaka, M. K., Banerjee, A. Inhibiting protein-protein interactions of Hsp90 as a novel approach for targeting cancer. European Journal of Medicinal Chemistry. 178, 48-63 (2019).
- Pavlov, P. F., Hutter-Paier, B., Havas, D., Windisch, M., Winblad, B. Development of GMP-1 a molecular chaperone network modulator protecting mitochondrial function and its assessment in fly and mice models of Alzheimer’s disease. Journal of Cellular and Molecular Medicine. 22 (7), 3464-3474 (2018).
- Young, J. C., Obermann, W. M., Hartl, F. U. Specific binding of tetratricopeptide repeat proteins to the C-terminal 12-kDa domain of hsp90. Journal of Biological Chemistry. 273 (29), 18007-18010 (1998).
- Scheufler, C., et al. Structure of TPR domain-peptide complexes: critical elements in the assembly of the Hsp70-Hsp90 multichaperone machine. Cell. 101 (2), 199-210 (2000).
- Storer, C. L., Dickey, C. A., Galigniana, M. D., Rein, T., Cox, M. B. FKBP51 and FKBP52 in signaling and disease. Trends in Endocrinology & Metabolism. 22 (12), 481-490 (2011).
- Ullman, E. F., et al. Luminescent oxygen channeling immunoassay: measurement of particle binding kinetics by chemiluminescence. Proceedings of the National Academy of Sciences of the United States of America. 91 (12), 5426-5430 (1994).
- Wigle, T. J., et al. Screening for inhibitors of low-affinity epigenetic peptide-protein interactions: an AlphaScreen-based assay for antagonists of methyl-lysine binding proteins. Journal of Biomolecular Screening. 15 (1), 62-71 (2010).
- Guenat, S., et al. Homogeneous and nonradioactive high-throughput screening platform for the characterization of kinase inhibitors in cell lysates. Journal of Biomolecular Screening. 11 (8), 1015-1026 (2006).
- Sabatucci, A., et al. A new methodological approach for in vitro determination of the role of DNA methylation on transcription factor binding using AlphaScreen(R) analysis: Focus on CREB1 binding at hBDNF promoter IV. Journal of Neuroscience Methods. 341, 108720 (2020).
- Mills, N. L., Shelat, A. A., Guy, R. K. Assay Optimization and Screening of RNA-Protein Interactions by AlphaScreen. Journal of Biomolecular Screening. 12 (7), 946-955 (2007).
- Huang, X., et al. A competitive alphascreen assay for detection of hyaluronan. Glycobiology. 28 (3), 137-147 (2018).
- Principles of alphascreen amplified luinescent proximmity homogenous assay. PerkinElmer Life Sciences Available from: https://www.perkinelmer.com/lab-solutions/resources/docs/APP_AlphaScreen_Principles.pdf (2021)
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).

