نظام ثقافة الجهاز الأمعاء المعوية لتحليل التفاعلات المضيف الميكروبيوتا
Summary
تقدم هذه المقالة طريقة فريدة لتحليل تفاعلات الميكروبيوم المضيف باستخدام نظام جديد لثقافة أعضاء الأمعاء لتجارب الجسم الحي السابق.
Abstract
يسهل هيكل نسيج الأمعاء التفاعلات الوثيقة والمتبادلة بين المضيف والميكروبات المعوية. وهذه المحادثات المتبادلة حاسمة للحفاظ على التوازن المحلي والنظامي؛ التغييرات في تكوين الأمعاء الميكروبيوتا (dysbiosis) المنتسبين مع مجموعة واسعة من الأمراض البشرية. تشمل طرق تشريح التفاعلات بين المضيف والميكروبيوتا مقايضة متأصلة بين الحفاظ على بنية الأنسجة الفسيولوجية (عند استخدام نماذج حيوانية في الجسم الحي) ومستوى التحكم في عوامل التجربة (كما هو الحال في أنظمة زراعة الخلايا المختبرية البسيطة). لمعالجة هذه المفاضلة، طور يسشار وآخرون مؤخرا نظاما لزراعة الأعضاء المعوية. يحافظ النظام على بناء أنسجة القولون والسذاجة والآليات الخلوية ويسمح أيضا برقابة تجريبية مشددة ، مما يسهل التجارب التي لا يمكن إجراؤها بسهولة في الجسم الحي. وهو الأمثل لتشريح الاستجابات قصيرة الأجل لمختلف مكونات الأمعاء (مثل العناصر الظهارية والمناعية والخلايا العصبية) للاضطرابات الإنارة (بما في ذلك الميكروبات اللاهوائية أو الهوائية ، وعينات الميكروبات الكاملة من الفئران أو البشر ، والأدوية والأيض). هنا ، نقدم وصفا مفصلا لبروتوكول محسن لثقافة الأعضاء لشظايا الأمعاء المتعددة باستخدام جهاز ثقافة القناة الهضمية حسب الطلب. يمكن تصور استجابات المضيف للاضطرابات الإنارة عن طريق تلطيخ الفلورة المناعية لأقسام الأنسجة أو شظايا الأنسجة الكاملة التركيب ، أو التهجين في الموقع الفلوري (FISH) ، أو التصوير الفاصل زمنيا. يدعم هذا النظام مجموعة واسعة من القراءات، بما في ذلك تسلسل الجيل التالي، وقياس التدفق الخلوي، ومختلف المقايسات الخلوية والبيوكيميائية. بشكل عام ، يدعم نظام زراعة الأعضاء ثلاثي الأبعاد هذا ثقافة الأنسجة المعوية الكبيرة السليمة ولديه تطبيقات واسعة للتحليل عالي الدقة وتصور تفاعلات الكائنات الحية المجهرية المضيفة في بيئة الأمعاء المحلية.
Introduction
الأمعاء هي عضو معقد للغاية يحتوي على مجموعة واسعة من أنواع الخلايا (الخلايا الظهارية وخلايا الجهاز المناعي والخلايا العصبية وأكثر من ذلك) منظمة في بنية معينة تسمح للخلايا بالتفاعل والتواصل مع بعضها البعض ومع المحتوى الإنعائي (الكائنات الحية الدقيقة والطعام وما إلى ذلك) 1.حاليا، والأدوات البحثية المتاحة لتحليل التفاعلات المضيف الميكروبيوتا يشمل في ثقافات الخلايا المختبرية وفي نماذج الحيوانات في الجسم الحي 2. في نماذج الحيوانات في الجسم الحي توفير بناء الأنسجة الفسيولوجية3 ولكن مع ضعف السيطرة التجريبية والقدرة المحدودة على التلاعب ظروف التجربة. في نظم زراعة المختبر، من ناحية أخرى، استخدام الخلايا الأولية أو خطوط الخلية التي يمكن أن تستكمل مع الميكروبات4،وتقديم رقابة مشددة على المعلمات التجربة ولكن تفتقر إلى تعقيد الخلوية والهندسة المعمارية الأنسجة. تسمح المقايسات المختبرية الحديثة بالاستخدام المتقدم لعينات الأنسجة البشرية الصحية والمرضية ، مثل الأجهزة العضوية الظهارية المشتقة من الماوس أو المصادر البشرية5،6، والعينات التي تحاكي البيئة الدقيقة المخاطية7. مثال آخر هو “القناة الهضمية على رقاقة” المقايسة، والتي تشمل خط الخلية الظهارية القولونية البشرية (Caco2)، مصفوفة خارج الخلية والقنوات microfluidic لمحاكاة الحالة الفسيولوجية للأمعاء ثابت8. ومع ذلك ، كما متقدمة ومبتكرة كما في عينات المختبر قد تكون ، فإنها لا تحافظ على بنية الأنسجة الطبيعية أو تكوين الخلوية السذاجة.
لمعالجة ذلك، Yissachar وآخرون وضعت مؤخرا نظام ثقافة الجهاز السابق فيفو 9 (الشكل 1) الذي يحافظ على شظايا الأمعاء سليمة ex vivo،والاستفادة من مزايا كل من فيفو وفي نماذج المختبر. ويستند هذا النظام السابق فيفو زراعة الجهاز الأمعاء على جهاز ثقافة حسب الطلب الذي يدعم ثقافة متعددة من ستة أنسجة القولون، مما يسمح بفحص المدخلات التجريبية في ظل ظروف مماثلة مع السيطرة على مدخلات النظام والمخرجات. وقد أظهرت الأعمال الأخيرة أن هذا النظام هو قيمة لتحليل الاستجابات المعوية لبكتيريا الأمعاء الفردية9, عينات الميكروبات البشرية كلها10 ونواتج الأيض الميكروبية11. ويتيح هذا النظام، لأول مرة، دراسة هذه التفاعلات المبكرة بين المضيف والميكروبيوتا مع مستوى عال من السيطرة على المكونات المضيفة والميكروبية والبيئية. وعلاوة على ذلك، فإنه يسمح بمراقبة النظام والتلاعب به طوال التجربة، في الوقت الحقيقي.
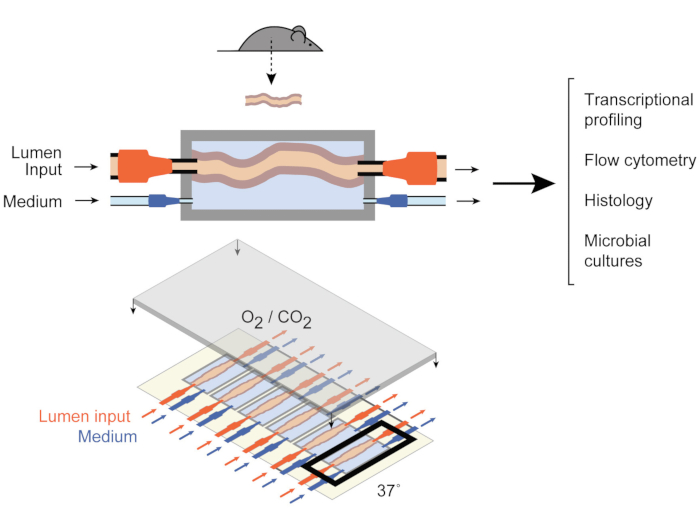
الشكل 1: تخطيطات جهاز ثقافة الأمعاء. يتم إرفاق جزء الأنسجة المعوية بالكامل بمنافذ الإخراج والمدخلات في الغرفة (العلوية) ، مع مضخات تنظم التدفق المتوسط داخل التجويف وفي الغرفة المتوسطة الخارجية. الجهاز بأكمله (أسفل) يحتوي على 6 غرف من هذا القبيل. وقد تم تعديل هذا الرقم من يسشار وآخرين 2017. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
تصف هذه المقالة بروتوكولا محسنا لثقافات أعضاء الأمعاء الحية السابقة التي طورها Yissachar وآخرون مؤخرا (نشرت9 وبيانات غير منشورة). يدعم نظام زراعة أعضاء الأمعاء ثقافة متعددة الخلايا لشظايا الأمعاء السليمة مع الحفاظ على التدفق الإنارة. ويوفر السيطرة الكاملة على البيئة داخل وخ…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
نشكر الأعضاء السابقين والحاليين في مختبر Yissachar على مساهماتهم القيمة في تحسين بروتوكول نظام زراعة أعضاء الأمعاء. نشكر يائيل لور على تحريره النقدي للمخطوطة. وقد دعم هذا العمل مؤسسة العلوم الإسرائيلية (المنحة رقم 3114831)، ومؤسسة العلوم الإسرائيلية – البرنامج المشترك للمعهد العريض (المنحة رقم 8165162)، وصندوق غاسنر للبحوث الطبية، إسرائيل.
Materials
| Device | |||
| 18 Gauge Blunt Needle | Mcmaster | 75165a754 | |
| 22 Gauge Blunt Needle | Mcmaster | 75165a758 | |
| All Purpose Adhesive Selant 100% Silicone | DAP | 688 | |
| Cubic Vacuum Desiccator VDC-21+ 2 Shelves | AAAD4021 | ||
| Glass Slide 1 mm Thick | Corning | 2947-75X50 | |
| Mini Incubator im-10 | AAH24315K | ||
| MPC 301E Vacuum PUMP | VI-412711 | ||
| Plastic Quick Turn Tube Coupling Plugs | Mcmaster | 51525k121 | |
| plastic Quick Turn Tube Coupling Sockets | Mcmaster | 52525k211 | |
| Sylgard 184 Silicone Elastomer | Dow | Polydimethylsiloxane, PDMS | |
| Tubing | Mcmaster | 6516t11 | |
| Zortrax M200 | Zortrax | Zortrax Z-SUITE, Autodesk Fusion 360 | |
| Zortrax M200 Materials: z-ultrat | Zortrax | ||
| Medium | |||
| B27 Supplement (50x), Serum Free | Thermo Fisher Scientific | 17504044 | |
| HEPES Buffer (1M) | Thermo Fisher Scientific | 15630056 | |
| Iscove's Mod Dulbecco's Medium With Phenol Red (1x) | Thermo Fisher Scientific | 12440061 | |
| Knock-Out Serum | Thermo Fisher Scientific | 10828028 | |
| N2 Supplement (100x) | Thermo Fisher Scientific | A1370701 | |
| Non Essential Amino Acid (100x) | Thermo Fisher Scientific | 11140035 | |
| Surgical Tools | |||
| Large Scissors | Aseltech | 11-00-10 | |
| Sharp Forceps | F.S.T | 11297-10 | |
| Silk Braided Surgical Thread | SMI | 8010G | |
| Straight Scissors | F.S.T | 14091-09 | |
| Thin Forceps | F.S.T | 11051-10 | |
| Organ System | |||
| 0.1 µm Filter | Life Gene | ||
| 0.22 µm Filter | Life Gene | ||
| 5 mL Luer Lock Syringe | B-D | 309649 | |
| Greenough Stereo Microscope | ZEISS | Stemi 305 | |
| Recirculating Precision Air Heater "CUBE" | CUBE-2-LIS | ||
| Syringe Pump | new era pump systems inc | nep-ne-1600-em |
Riferimenti
- Mowat, A. M., Agace, W. W. Regional specialization within the intestinal immune system. Nature Reviews Immunology. 14 (10), 667-685 (2014).
- Pearce, S. C., et al. Intestinal in vitro and ex vivo Models to Study Host-Microbiome Interactions and Acute Stressors. Frontiers in Physiology. 9 (1584), (2018).
- Hooper, L. V., et al. Molecular analysis of commensal host-microbial relationships in the intestine. Science. 291 (5505), 881-884 (2001).
- Haller, D., et al. Non-pathogenic bacteria elicit a differential cytokine response by intestinal epithelial cell/leucocyte co-cultures. Gut. 47 (1), 79-87 (2000).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett’s epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Tsilingiri, K., et al. Probiotic and postbiotic activity in health and disease: comparison on a novel polarised ex-vivo organ culture model. Gut. 61 (7), 1007-1015 (2012).
- Gazzaniga, F. S., et al. Harnessing Colon Chip Technology to Identify Commensal Bacteria That Promote Host Tolerance to Infection. Frontiers in Cellular and Infection Microbiology. 11, 638014 (2021).
- Yissachar, N., et al. An Intestinal Organ Culture System Uncovers a Role for the Nervous System in Microbe-Immune Crosstalk. Cell. 168 (6), 1135-1148 (2017).
- Duscha, A., et al. Propionic Acid Shapes the Multiple Sclerosis Disease Course by an Immunomodulatory Mechanism. Cell. 180 (6), 1067-1080 (2020).
- Grosheva, I., et al. High-Throughput Screen Identifies Host and Microbiota Regulators of Intestinal Barrier Function. Gastroenterology. 159 (5), 1807-1823 (2020).
- Blaize, J. F., Corbo, C. P. Serial Dilutions and Plating: Microbial Enumeration. Journal of Visualized Experiments. , (2021).
- Ivanov, I. I., et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell. 139 (3), 485-498 (2009).
- Schnupf, P., et al. Growth and host interaction of mouse segmented filamentous bacteria in vitro. Nature. 520 (7545), 99-103 (2015).
- Chung, H., et al. Gut immune maturation depends on colonization with a host-specific microbiota. Cell. 149 (7), 1578-1593 (2012).
- Atarashi, K., et al. Th17 Cell Induction by Adhesion of Microbes to Intestinal Epithelial Cells. Cell. 163 (2), 367-380 (2015).

