Een darmorgaankweeksysteem voor het analyseren van host-microbiota-interacties
Summary
Dit artikel presenteert een unieke methode voor het analyseren van gastheer-microbioom interacties met behulp van een nieuw darmorgaancultuursysteem voor ex vivo experimenten.
Abstract
De structuur van het darmweefsel vergemakkelijkt nauwe en mutualistische interacties tussen de gastheer en de darmmicrobiota. Deze kruisbesprekingen zijn van cruciaal belang voor het behoud van lokale en systemische homeostase; veranderingen in de samenstelling van de darmmicrobiota (dysbiose) associëren met een breed scala aan menselijke ziekten. Methoden voor het ontleden van gastheer-microbiota-interacties omvatten een inherente afweging tussen het behoud van fysiologische weefselstructuur (bij gebruik van in vivo diermodellen) en het niveau van controle over de experimentfactoren (zoals in eenvoudige in vitro celkweeksystemen). Om deze afweging aan te pakken, ontwikkelden Yissachar et al. onlangs een darmorgaancultuursysteem. Het systeem behoudt een naïeve colonweefselconstructie en cellulaire mechanismen en het maakt ook strakke experimentele controle mogelijk, waardoor experimenten mogelijk zijn die niet gemakkelijk in vivokunnen worden uitgevoerd . Het is optimaal voor het ontleden van kortetermijnreacties van verschillende darmcomponenten (zoals epitheliale, immunologische en neuronale elementen) op luminale verstoringen (waaronder anaerobe of aerobe microben, hele microbiotamonsters van muizen of mensen, geneesmiddelen en metabolieten). Hier presenteren we een gedetailleerde beschrijving van een geoptimaliseerd protocol voor orgaancultuur van meerdere darmfragmenten met behulp van een op maat gemaakt darmcultuurapparaat. Gastheerreacties op luminale verstoringen kunnen worden gevisualiseerd door immunofluorescentiekleuring van weefselsecties of weefselfragmenten met hele montering, fluorescentie in situ hybridisatie (FISH) of time-lapse-beeldvorming. Dit systeem ondersteunt een breed scala aan uitlezingen, waaronder next-generation sequencing, flow cytometrie en verschillende cellulaire en biochemische assays. Over het algemeen ondersteunt dit driedimensionale orgaancultuursysteem de cultuur van grote, intacte darmweefsels en heeft het brede toepassingen voor hoge resolutie analyse en visualisatie van gastheer-microbiota interacties in de lokale darmomgeving.
Introduction
De darm is een zeer complex orgaan dat een breed scala aan celtypen bevat (epitheelcellen, cellen van het immuunsysteem, neuronen en meer) georganiseerd in een bepaalde structuur die cellen in staat stelt om met elkaar en met het luminale gehalte (microbiota, voedsel, enz.) te communiceren en te communiceren. 1. Momenteel omvat de onderzoekstoolbox die beschikbaar is voor het analyseren van gastheer-microbiota-interacties in vitro celculturen en in vivo diermodellen2. In vivo diermodellen bieden een fysiologische weefselconstructie3, maar met slechte experimentele controle en beperkt vermogen om de experimentomstandigheden te manipuleren. In vitro kweeksystemen daarentegen gebruiken primaire cellen of cellijnen die kunnen worden aangevuld met microben4, die strakke controle bieden over de experimentparameters, maar de cellulaire complexiteit en de weefselarchitectuur missen. Moderne in vitro assays maken het geavanceerde gebruik van gezonde en pathologische menselijke weefselmonsters mogelijk, zoals epitheliale organoïden afgeleid van muis of menselijke bronnen5,6, en monsters die het mucosale micromilieu nabootsen7. Een ander voorbeeld is de ‘gut on a chip’-test, die de menselijke colonische epitheelcellijn (Caco2), extracellulaire matrix en microfluïdische kanalen omvat om de fysiologische toestand van de darm invariant8na te bootsen . Hoe geavanceerd en innovatief in vitro monsters ook mogen zijn, ze behouden geen normale weefselarchitectuur of naïeve cellulaire samenstelling.
Om dat aan te pakken, ontwikkelden Yissachar et al. onlangs een ex vivo orgaankweeksysteem9 (figuur 1) dat intacte darmfragmenten ex vivobehoudt , profiterend van de voordelen van zowel in vivo als in vitro modellen. Dit ex vivo darmorgaankweeksysteem is gebaseerd op een op maat gemaakt kweekapparaat dat een multiplexed kweek van zes darmweefsels ondersteunt, waardoor experimentele ingangen onder vergelijkbare omstandigheden kunnen worden onderzocht terwijl de in- en uitgangen van het systeem worden gecontroleerd. Recente werken hebben aangetoond dat dit systeem waardevol is voor het analyseren van darmreacties op individuele darmbacteriën9, hele menselijke microbiotamonsters10 en microbiële metabolieten11. Dit systeem maakt voor het eerst de studie mogelijk van deze vroege gastheer-microbiota interacties met een hoog niveau van controle over de gastheer, microbiële en omgevingscomponenten. Bovendien maakt het het mogelijk om het systeem gedurende het hele experiment in realtime te volgen en te manipuleren.
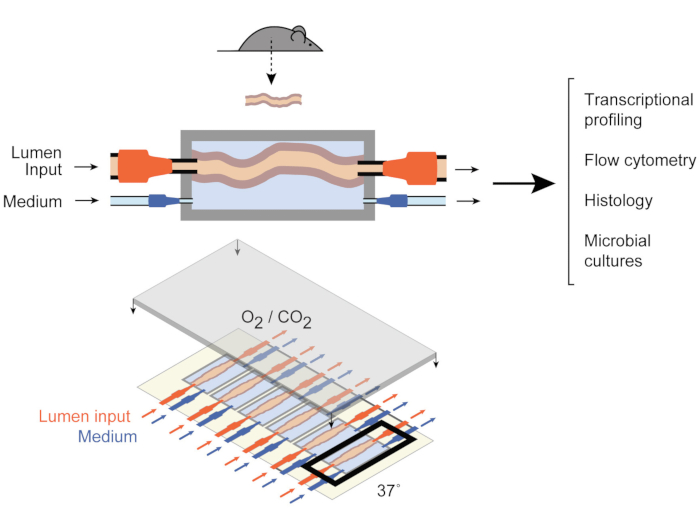
Figuur 1: Schema’s van het darmkweekapparaat. Een heel darmweefselfragment wordt bevestigd aan de output- en ingangspoorten van de kamer (boven), met pompen die de gemiddelde stroom in het lumen en in de externe middelgrote kamer regelen. Het hele apparaat (onder) bevat 6 van dergelijke kamers. Dit cijfer is aangepast van Yissachar et al. 2017. Klik hier om een grotere versie van deze afbeelding te bekijken.
Protocol
Representative Results
Discussion
Dit artikel beschrijft een geoptimaliseerd protocol voor ex vivo darmorgaanculturen die Yissachar et al. onlangs hebben ontwikkeld (gepubliceerde9 en niet-gepubliceerde gegevens). Het darmorgaankweeksysteem ondersteunt multiplexed cultuur van intacte darmfragmenten met behoud van de luminale stroom. Het biedt volledige controle over de intra- en extra-luminale omgeving (inclusief stimulatiedosis, belichtingstijd en debiet) en behoudt de naïeve darmweefselstructuur en de cellulaire comple…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
We danken voormalige en huidige leden van het Yissachar lab voor hun waardevolle bijdragen aan het optimaliseren van het darmorgaancultuursysteemprotocol. Wij danken Yael Laure voor de kritische bewerking van het manuscript. Dit werk werd ondersteund door de Israel Science Foundation (subsidie nr. 3114831), de Israel Science Foundation – Broad Institute Joint Program (subsidie nr. 8165162) en het Gassner Fund for Medical Research, Israël.
Materials
| Device | |||
| 18 Gauge Blunt Needle | Mcmaster | 75165a754 | |
| 22 Gauge Blunt Needle | Mcmaster | 75165a758 | |
| All Purpose Adhesive Selant 100% Silicone | DAP | 688 | |
| Cubic Vacuum Desiccator VDC-21+ 2 Shelves | AAAD4021 | ||
| Glass Slide 1 mm Thick | Corning | 2947-75X50 | |
| Mini Incubator im-10 | AAH24315K | ||
| MPC 301E Vacuum PUMP | VI-412711 | ||
| Plastic Quick Turn Tube Coupling Plugs | Mcmaster | 51525k121 | |
| plastic Quick Turn Tube Coupling Sockets | Mcmaster | 52525k211 | |
| Sylgard 184 Silicone Elastomer | Dow | Polydimethylsiloxane, PDMS | |
| Tubing | Mcmaster | 6516t11 | |
| Zortrax M200 | Zortrax | Zortrax Z-SUITE, Autodesk Fusion 360 | |
| Zortrax M200 Materials: z-ultrat | Zortrax | ||
| Medium | |||
| B27 Supplement (50x), Serum Free | Thermo Fisher Scientific | 17504044 | |
| HEPES Buffer (1M) | Thermo Fisher Scientific | 15630056 | |
| Iscove's Mod Dulbecco's Medium With Phenol Red (1x) | Thermo Fisher Scientific | 12440061 | |
| Knock-Out Serum | Thermo Fisher Scientific | 10828028 | |
| N2 Supplement (100x) | Thermo Fisher Scientific | A1370701 | |
| Non Essential Amino Acid (100x) | Thermo Fisher Scientific | 11140035 | |
| Surgical Tools | |||
| Large Scissors | Aseltech | 11-00-10 | |
| Sharp Forceps | F.S.T | 11297-10 | |
| Silk Braided Surgical Thread | SMI | 8010G | |
| Straight Scissors | F.S.T | 14091-09 | |
| Thin Forceps | F.S.T | 11051-10 | |
| Organ System | |||
| 0.1 µm Filter | Life Gene | ||
| 0.22 µm Filter | Life Gene | ||
| 5 mL Luer Lock Syringe | B-D | 309649 | |
| Greenough Stereo Microscope | ZEISS | Stemi 305 | |
| Recirculating Precision Air Heater "CUBE" | CUBE-2-LIS | ||
| Syringe Pump | new era pump systems inc | nep-ne-1600-em |
Riferimenti
- Mowat, A. M., Agace, W. W. Regional specialization within the intestinal immune system. Nature Reviews Immunology. 14 (10), 667-685 (2014).
- Pearce, S. C., et al. Intestinal in vitro and ex vivo Models to Study Host-Microbiome Interactions and Acute Stressors. Frontiers in Physiology. 9 (1584), (2018).
- Hooper, L. V., et al. Molecular analysis of commensal host-microbial relationships in the intestine. Science. 291 (5505), 881-884 (2001).
- Haller, D., et al. Non-pathogenic bacteria elicit a differential cytokine response by intestinal epithelial cell/leucocyte co-cultures. Gut. 47 (1), 79-87 (2000).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett’s epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Tsilingiri, K., et al. Probiotic and postbiotic activity in health and disease: comparison on a novel polarised ex-vivo organ culture model. Gut. 61 (7), 1007-1015 (2012).
- Gazzaniga, F. S., et al. Harnessing Colon Chip Technology to Identify Commensal Bacteria That Promote Host Tolerance to Infection. Frontiers in Cellular and Infection Microbiology. 11, 638014 (2021).
- Yissachar, N., et al. An Intestinal Organ Culture System Uncovers a Role for the Nervous System in Microbe-Immune Crosstalk. Cell. 168 (6), 1135-1148 (2017).
- Duscha, A., et al. Propionic Acid Shapes the Multiple Sclerosis Disease Course by an Immunomodulatory Mechanism. Cell. 180 (6), 1067-1080 (2020).
- Grosheva, I., et al. High-Throughput Screen Identifies Host and Microbiota Regulators of Intestinal Barrier Function. Gastroenterology. 159 (5), 1807-1823 (2020).
- Blaize, J. F., Corbo, C. P. Serial Dilutions and Plating: Microbial Enumeration. Journal of Visualized Experiments. , (2021).
- Ivanov, I. I., et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell. 139 (3), 485-498 (2009).
- Schnupf, P., et al. Growth and host interaction of mouse segmented filamentous bacteria in vitro. Nature. 520 (7545), 99-103 (2015).
- Chung, H., et al. Gut immune maturation depends on colonization with a host-specific microbiota. Cell. 149 (7), 1578-1593 (2012).
- Atarashi, K., et al. Th17 Cell Induction by Adhesion of Microbes to Intestinal Epithelial Cells. Cell. 163 (2), 367-380 (2015).

