מערכת תרבית איברי מעיים לניתוח אינטראקציות מארח-מיקרוביוטה
Summary
מאמר זה מציג שיטה ייחודית לניתוח אינטראקציות בין מארח למיקרוביום באמצעות מערכת תרבית איברי מעיים חדשנית לניסויים ex vivo.
Abstract
המבנה של רקמת המעי מאפשר אינטראקציות קרובות והדדיות בין הפונדקאי למיקרוביוטה במעיים. שיחות צולבות אלה חיוניות לשמירה על הומאוסטזיס מקומי ומערכתי; שינויים בהרכב המיקרוביוטה במעיים (דיסביוזיס) מקשרים למגוון רחב של מחלות אנושיות. שיטות לנתח אינטראקציות בין מארח למיקרוביוטה מקיפות החלפה אינהרנטית בין שימור מבנה הרקמה הפיזיולוגית (בעת שימוש במודלים של בעלי חיים של vivo) לבין רמת השליטה על גורמי הניסוי (כמו במערכות פשוטות בתרבית תאי חוץ גופיה). כדי לטפל בהחלפה זו, Yissachar ואח ‘ פיתחו לאחרונה מערכת תרבית איברי מעיים. המערכת משמרת בניית רקמת המעי הגס הנאיבית ומנגנונים תאיים והיא גם מאפשרת שליטה ניסיונית הדוקה, ומאפשרת ניסויים שלא ניתן לבצע בקלות ב- vivo. זה אופטימלי לנתח תגובות לטווח קצר של רכיבי מעיים שונים (כגון אפיתל, אלמנטים אימונולוגיים ונוירולוגיים) כדי הפרעות זוהר (כולל חיידקים אנאירוביים או אירוביים, דגימות מיקרוביוטה שלמות מעכברים או בני אדם, תרופות ומטבוליטים). כאן, אנו מציגים תיאור מפורט של פרוטוקול ממוטב לתרבות איברים של שברי מעיים מרובים באמצעות מכשיר תרבות מעיים מותאם אישית. תגובות מארחות להפרעות זוהרות יכולות להיות חזותיות על ידי כתמים אימונופלואורסצנטיים של מקטעי רקמות או שברי רקמות של הר שלם, הכלאה פלואורסצנטית במקום (FISH), או הדמיה לשגות זמן. מערכת זו תומכת במגוון רחב של קריאות, כולל רצף הדור הבא, ציטומטריית זרימה וביקורים תאיים וביוכימיים שונים. בסך הכל, מערכת תרבית איברים תלת ממדית זו תומכת בתרבות של רקמות מעיים גדולות ושלמות ויש לה יישומים רחבים לניתוח ברזולוציה גבוהה והדמיה של אינטראקציות בין מארח למיקרוביוטה בסביבת המעיים המקומית.
Introduction
המעי הוא איבר מורכב ביותר המכיל מגוון רחב של סוגי תאים (תאי אפיתל, תאי מערכת החיסון, נוירונים ועוד) המאורגן במבנה מסוים המאפשר לתאים לקיים אינטראקציה ולתקשר זה עם זה ועם התוכן הלומינלי (מיקרוביוטה, מזון וכו ‘). 1.נכון לעכשיו, ארגז הכלים המחקרי הזמין לניתוח אינטראקציות מארח-מיקרוביוטה כולל תרביות תאים במבחנה ומודלים של בעלי חיים ב- vivo 2. מודלים של בעלי חיים ב-Vivo מספקים בניית רקמות פיזיולוגיות3, אך עם שליטה ניסיונית לקויה ויכולת מוגבלת לתפעל את תנאי הניסוי. במערכות תרבית במבחנה, לעומת זאת, להשתמש בתאים ראשוניים או קווי תאים שניתן להשלים עם חיידקים4, המציע שליטה הדוקה על הפרמטרים הניסוי אבל חסר את המורכבות התאית ואת ארכיטקטורת הרקמות. בדיקות במבחנה מודרניות מאפשרות שימוש מתקדם בדגימות רקמה אנושית בריאה ופתולוגית, כמו אורגנוידים אפיתל שמקורם בעכבר או ממקורות אנושיים5,6, ודגימות המחקות את המיקרו-סביבה הרירית7. דוגמה נוספת היא “המעיים על שבב” assay, הכולל את קו התא אפיתל המעי הגס האנושי (Caco2), מטריצה חוץ תאית וערוצים microfluidic לחקות את המצב הפיזיולוגי של invariantהמעיים 8. עם זאת, מתקדם וחדשני כמו דגימות במבחנה עשוי להיות, הם אינם שומרים על ארכיטקטורת רקמות נורמלית או הרכב תאי נאיבי.
כדי להתמודד עם זה, Yissachar ואח ‘ פיתחו לאחרונה מערכת תרבות איברים ex vivo 9 (איור 1) השומרת על שברי מעיים שלמים ex vivo,נהנה מהיתרונות של הן ב- vivo והן במודלים במבחנה. מערכת זו של תרבית איברי המעיים ex vivo מבוססת על התקן תרבות מותאם אישית התומך בתרבית מולטיפלקסים של שש רקמות המעי הגס, ומאפשר לבחון תשומות ניסיוניות בתנאים דומים תוך שליטה על התשומות והתפוקות של המערכת. עבודות אחרונות הוכיחו כי מערכת זו היא בעלת ערך לניתוח תגובות מעיים לחיידקי מעיים בודדים 9 ,דגימותמיקרוביוטה אנושיות שלמות10 ומטבוליטים מיקרוביאליים11. מערכת זו מאפשרת, לראשונה, לחקור את האינטראקציות המוקדמות בין המארח למיקרוביוטה עם רמה גבוהה של שליטה על הרכיבים המארחים, המיקרוביאליים והסביבתיים. יתר על כן, הוא מאפשר ניטור ומניפולציה של המערכת לאורך כל הניסוי, בזמן אמת.
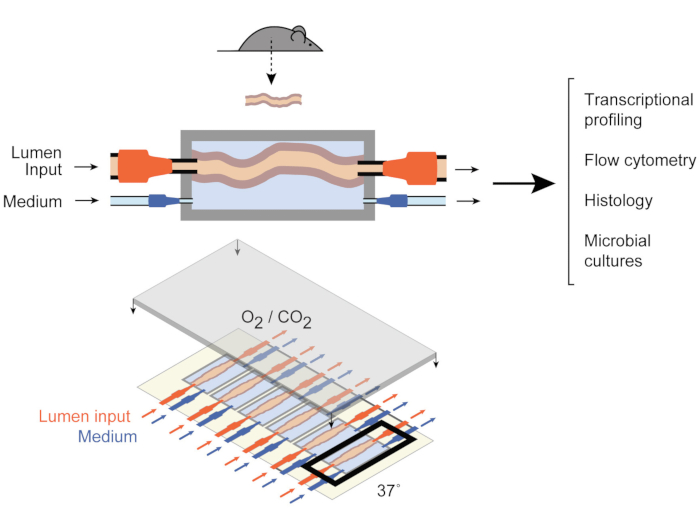
איור 1: שרטוטים של מכשיר תרבות המעיים. שבר רקמת מעיים שלם מחובר ליציאות היציאה והקלט של התא (למעלה), עם משאבות המסדירות את הזרימה הבינונית בתוך הלומן ובתא הבינוני החיצוני. המכשיר כולו (התחתון) מכיל 6 תאים כאלה. נתון זה שונה מישאר ואח’ 2017. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Protocol
Representative Results
Discussion
מאמר זה מתאר פרוטוקול ממוטב לתרבויות איברי המעיים ex vivo כי Yissachar ואח ‘ פיתחו לאחרונה(פורסם 9 נתונים שלא פורסמו). מערכת תרבית איברי המעיים תומכת בתרבית מולטיפלקסים של שברי מעיים שלמים תוך שמירה על זרימה זוהרת. הוא מספק שליטה מלאה על הסביבה הפנים-אור-זוהרת (כולל מינון גירוי, זמ…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
אנו מודים לחברי מעבדת יששכר בעבר ובהווה על תרומתם החשובה באופטימיזציה של פרוטוקול מערכת תרבות איברי הבטן. אנו מודים ליעל לור על העריכה הביקורתית של כתב היד. עבודה זו נתמכה על ידי הקרן הישראלית למדע (מענק מס’ 3114831), הקרן הישראלית למדע – תכנית משותפת של מכון רחב (מענק מס’ 8165162) וקרן גאסנר למחקר רפואי.
Materials
| Device | |||
| 18 Gauge Blunt Needle | Mcmaster | 75165a754 | |
| 22 Gauge Blunt Needle | Mcmaster | 75165a758 | |
| All Purpose Adhesive Selant 100% Silicone | DAP | 688 | |
| Cubic Vacuum Desiccator VDC-21+ 2 Shelves | AAAD4021 | ||
| Glass Slide 1 mm Thick | Corning | 2947-75X50 | |
| Mini Incubator im-10 | AAH24315K | ||
| MPC 301E Vacuum PUMP | VI-412711 | ||
| Plastic Quick Turn Tube Coupling Plugs | Mcmaster | 51525k121 | |
| plastic Quick Turn Tube Coupling Sockets | Mcmaster | 52525k211 | |
| Sylgard 184 Silicone Elastomer | Dow | Polydimethylsiloxane, PDMS | |
| Tubing | Mcmaster | 6516t11 | |
| Zortrax M200 | Zortrax | Zortrax Z-SUITE, Autodesk Fusion 360 | |
| Zortrax M200 Materials: z-ultrat | Zortrax | ||
| Medium | |||
| B27 Supplement (50x), Serum Free | Thermo Fisher Scientific | 17504044 | |
| HEPES Buffer (1M) | Thermo Fisher Scientific | 15630056 | |
| Iscove's Mod Dulbecco's Medium With Phenol Red (1x) | Thermo Fisher Scientific | 12440061 | |
| Knock-Out Serum | Thermo Fisher Scientific | 10828028 | |
| N2 Supplement (100x) | Thermo Fisher Scientific | A1370701 | |
| Non Essential Amino Acid (100x) | Thermo Fisher Scientific | 11140035 | |
| Surgical Tools | |||
| Large Scissors | Aseltech | 11-00-10 | |
| Sharp Forceps | F.S.T | 11297-10 | |
| Silk Braided Surgical Thread | SMI | 8010G | |
| Straight Scissors | F.S.T | 14091-09 | |
| Thin Forceps | F.S.T | 11051-10 | |
| Organ System | |||
| 0.1 µm Filter | Life Gene | ||
| 0.22 µm Filter | Life Gene | ||
| 5 mL Luer Lock Syringe | B-D | 309649 | |
| Greenough Stereo Microscope | ZEISS | Stemi 305 | |
| Recirculating Precision Air Heater "CUBE" | CUBE-2-LIS | ||
| Syringe Pump | new era pump systems inc | nep-ne-1600-em |
Riferimenti
- Mowat, A. M., Agace, W. W. Regional specialization within the intestinal immune system. Nature Reviews Immunology. 14 (10), 667-685 (2014).
- Pearce, S. C., et al. Intestinal in vitro and ex vivo Models to Study Host-Microbiome Interactions and Acute Stressors. Frontiers in Physiology. 9 (1584), (2018).
- Hooper, L. V., et al. Molecular analysis of commensal host-microbial relationships in the intestine. Science. 291 (5505), 881-884 (2001).
- Haller, D., et al. Non-pathogenic bacteria elicit a differential cytokine response by intestinal epithelial cell/leucocyte co-cultures. Gut. 47 (1), 79-87 (2000).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett’s epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Tsilingiri, K., et al. Probiotic and postbiotic activity in health and disease: comparison on a novel polarised ex-vivo organ culture model. Gut. 61 (7), 1007-1015 (2012).
- Gazzaniga, F. S., et al. Harnessing Colon Chip Technology to Identify Commensal Bacteria That Promote Host Tolerance to Infection. Frontiers in Cellular and Infection Microbiology. 11, 638014 (2021).
- Yissachar, N., et al. An Intestinal Organ Culture System Uncovers a Role for the Nervous System in Microbe-Immune Crosstalk. Cell. 168 (6), 1135-1148 (2017).
- Duscha, A., et al. Propionic Acid Shapes the Multiple Sclerosis Disease Course by an Immunomodulatory Mechanism. Cell. 180 (6), 1067-1080 (2020).
- Grosheva, I., et al. High-Throughput Screen Identifies Host and Microbiota Regulators of Intestinal Barrier Function. Gastroenterology. 159 (5), 1807-1823 (2020).
- Blaize, J. F., Corbo, C. P. Serial Dilutions and Plating: Microbial Enumeration. Journal of Visualized Experiments. , (2021).
- Ivanov, I. I., et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell. 139 (3), 485-498 (2009).
- Schnupf, P., et al. Growth and host interaction of mouse segmented filamentous bacteria in vitro. Nature. 520 (7545), 99-103 (2015).
- Chung, H., et al. Gut immune maturation depends on colonization with a host-specific microbiota. Cell. 149 (7), 1578-1593 (2012).
- Atarashi, K., et al. Th17 Cell Induction by Adhesion of Microbes to Intestinal Epithelial Cells. Cell. 163 (2), 367-380 (2015).

