Un sistema de cultivo de órganos intestinales intestinales para analizar las interacciones huésped-microbiota
Summary
Este artículo presenta un método único para analizar las interacciones huésped-microbioma utilizando un nuevo sistema de cultivo de órganos intestinales para experimentos ex vivo.
Abstract
La estructura del tejido intestinal facilita interacciones cercanas y mutualistas entre el huésped y la microbiota intestinal. Estas conversaciones cruzadas son cruciales para mantener la homeostasis local y sistémica; los cambios en la composición de la microbiota intestinal (disbiosis) se asocian con una amplia gama de enfermedades humanas. Los métodos para diseccionar las interacciones huésped-microbiota abarcan una compensación inherente entre la preservación de la estructura fisiológica del tejido (cuando se utilizan modelos animales in vivo) y el nivel de control sobre los factores del experimento (como en los sistemas simples de cultivo celular in vitro). Para abordar esta compensación, Yissachar et al. desarrollaron recientemente un sistema de cultivo de órganos intestinales. El sistema conserva una construcción ingenua del tejido del colon y mecanismos celulares y también permite un control experimental estricto, facilitando experimentaciones que no se pueden realizar fácilmente in vivo. Es óptimo para diseccionar respuestas a corto plazo de varios componentes intestinales (como elementos epiteliales, inmunológicos y neuronales) a perturbaciones luminales (incluidos microbios anaeróbicos o aeróbicos, muestras de microbiota completa de ratones o humanos, medicamentos y metabolitos). Aquí, presentamos una descripción detallada de un protocolo optimizado para el cultivo de órganos de múltiples fragmentos intestinales utilizando un dispositivo de cultivo intestinal hecho a medida. Las respuestas del huésped a las perturbaciones luminales se pueden visualizar mediante tinción de inmunofluorescencia de secciones de tejido o fragmentos de tejido de montaje completo, hibridación fluorescente in situ (FISH) o imágenes de lapso de tiempo. Este sistema admite una amplia gama de lecturas, incluida la secuenciación de próxima generación, la citometría de flujo y varios ensayos celulares y bioquímicos. En general, este sistema de cultivo de órganos tridimensionales admite el cultivo de tejidos intestinales grandes e intactos y tiene amplias aplicaciones para el análisis de alta resolución y la visualización de las interacciones huésped-microbiota en el entorno intestinal local.
Introduction
El intestino es un órgano altamente complejo que contiene una amplia gama de tipos de células (células epiteliales, células del sistema inmune, neuronas y más) organizadas en una estructura particular que permite a las células interactuar y comunicarse entre sí y con el contenido luminal (microbiota, alimentos, etc.) 1. Actualmente, la caja de herramientas de investigación disponible para analizar las interacciones huésped-microbiota incluye cultivos celulares in vitro y modelos animales in vivo 2. Los modelos animales in vivo proporcionan una construcción fisiológica del tejido3 pero con un control experimental deficiente y una capacidad limitada para manipular las condiciones del experimento. Los sistemas de cultivo in vitro, por otro lado, utilizan células primarias o líneas celulares que se pueden complementar con microbios4,ofreciendo un control estricto sobre los parámetros del experimento, pero carecen de la complejidad celular y la arquitectura del tejido. Los ensayos in vitro modernos permiten el uso avanzado de muestras de tejido humano sanas y patológicas, como organoides epiteliales derivados de fuentes de ratón ohumanas 5,6,y muestras que imitan el microambiente de la mucosa7. Otro ejemplo es el ensayo ‘gut on a chip’, que incluye la línea celular epitelial colónica humana (Caco2), la matriz extracelular y los canales microfluídicos para imitar la condición fisiológica del invariante intestinal8. Sin embargo, por muy avanzadas e innovadoras que puedan ser las muestras in vitro, no mantienen una arquitectura tisular normal ni una composición celular ingenua.
Para abordar eso, Yissachar et al. desarrollaron recientemente un sistema de cultivo de órganos ex vivo 9 (Figura 1)que mantiene intactos los fragmentos intestinales ex vivo,beneficiándose de las ventajas de los modelos in vivo e in vitro. Este sistema de cultivo de órganos intestinales ex vivo se basa en un dispositivo de cultivo personalizado que admite un cultivo multiplexado de seis tejidos del colon, lo que permite examinar las entradas experimentales en condiciones comparables mientras se controlan las entradas y salidas del sistema. Trabajos recientes han demostrado que este sistema es valioso para analizar las respuestas intestinales a bacterias intestinales individuales9,muestras enteras de microbiota humana10 y metabolitos microbianos11. Este sistema permite, por primera vez, el estudio de estas interacciones tempranas huésped-microbiota con un alto nivel de control sobre los componentes huésped, microbianos y ambientales. Además, permite monitorizar y manipular el sistema a lo largo del experimento, en tiempo real.
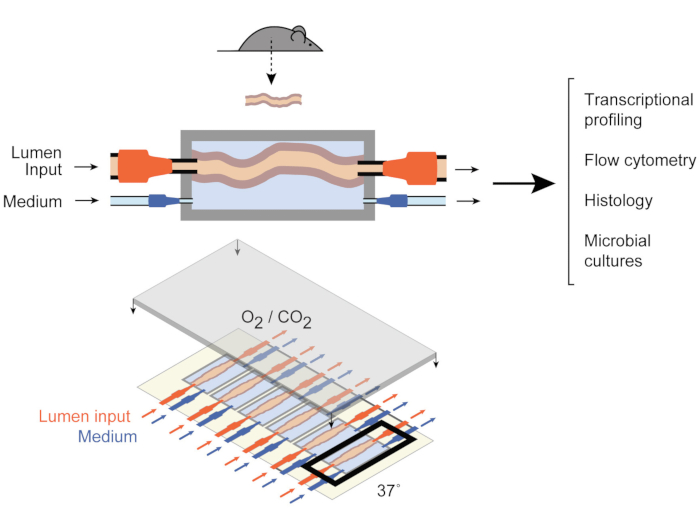
Figura 1: Esquemas del dispositivo de cultivo intestinal. Un fragmento de tejido intestinal entero está unido a los puertos de salida y entrada de la cámara (arriba), con bombas que regulan el flujo medio dentro del lumen y en la cámara media externa. Todo el dispositivo (parte inferior) contiene 6 cámaras de este tipo. Esta cifra ha sido modificada a partir de Yissachar et al. 2017. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
Este artículo describe un protocolo optimizado para cultivos de órganos intestinales ex vivo que Yissachar et al. han desarrollado recientemente (datos publicados9 y no publicados). El sistema de cultivo de órganos intestinales admite el cultivo multiplexado de fragmentos intestinales intactos mientras mantiene el flujo luminal. Proporciona un control total sobre el entorno intra y extra-luminal (incluyendo la dosis de estimulación, el tiempo de exposición y el caudal) y preserva la …
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Agradecemos a los miembros pasados y presentes del laboratorio de Yissachar por sus valiosas contribuciones en la optimización del protocolo del sistema de cultivo de órganos intestinales. Agradecemos a Yael Laure por la edición crítica del manuscrito. Este trabajo fue apoyado por la Fundación de Ciencia de Israel (subvención No. 3114831), la Fundación de Ciencia de Israel – Programa Conjunto del Instituto Broad (subvención No. 8165162) y el Fondo Gassner para la Investigación Médica, Israel.
Materials
| Device | |||
| 18 Gauge Blunt Needle | Mcmaster | 75165a754 | |
| 22 Gauge Blunt Needle | Mcmaster | 75165a758 | |
| All Purpose Adhesive Selant 100% Silicone | DAP | 688 | |
| Cubic Vacuum Desiccator VDC-21+ 2 Shelves | AAAD4021 | ||
| Glass Slide 1 mm Thick | Corning | 2947-75X50 | |
| Mini Incubator im-10 | AAH24315K | ||
| MPC 301E Vacuum PUMP | VI-412711 | ||
| Plastic Quick Turn Tube Coupling Plugs | Mcmaster | 51525k121 | |
| plastic Quick Turn Tube Coupling Sockets | Mcmaster | 52525k211 | |
| Sylgard 184 Silicone Elastomer | Dow | Polydimethylsiloxane, PDMS | |
| Tubing | Mcmaster | 6516t11 | |
| Zortrax M200 | Zortrax | Zortrax Z-SUITE, Autodesk Fusion 360 | |
| Zortrax M200 Materials: z-ultrat | Zortrax | ||
| Medium | |||
| B27 Supplement (50x), Serum Free | Thermo Fisher Scientific | 17504044 | |
| HEPES Buffer (1M) | Thermo Fisher Scientific | 15630056 | |
| Iscove's Mod Dulbecco's Medium With Phenol Red (1x) | Thermo Fisher Scientific | 12440061 | |
| Knock-Out Serum | Thermo Fisher Scientific | 10828028 | |
| N2 Supplement (100x) | Thermo Fisher Scientific | A1370701 | |
| Non Essential Amino Acid (100x) | Thermo Fisher Scientific | 11140035 | |
| Surgical Tools | |||
| Large Scissors | Aseltech | 11-00-10 | |
| Sharp Forceps | F.S.T | 11297-10 | |
| Silk Braided Surgical Thread | SMI | 8010G | |
| Straight Scissors | F.S.T | 14091-09 | |
| Thin Forceps | F.S.T | 11051-10 | |
| Organ System | |||
| 0.1 µm Filter | Life Gene | ||
| 0.22 µm Filter | Life Gene | ||
| 5 mL Luer Lock Syringe | B-D | 309649 | |
| Greenough Stereo Microscope | ZEISS | Stemi 305 | |
| Recirculating Precision Air Heater "CUBE" | CUBE-2-LIS | ||
| Syringe Pump | new era pump systems inc | nep-ne-1600-em |
Riferimenti
- Mowat, A. M., Agace, W. W. Regional specialization within the intestinal immune system. Nature Reviews Immunology. 14 (10), 667-685 (2014).
- Pearce, S. C., et al. Intestinal in vitro and ex vivo Models to Study Host-Microbiome Interactions and Acute Stressors. Frontiers in Physiology. 9 (1584), (2018).
- Hooper, L. V., et al. Molecular analysis of commensal host-microbial relationships in the intestine. Science. 291 (5505), 881-884 (2001).
- Haller, D., et al. Non-pathogenic bacteria elicit a differential cytokine response by intestinal epithelial cell/leucocyte co-cultures. Gut. 47 (1), 79-87 (2000).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett’s epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Tsilingiri, K., et al. Probiotic and postbiotic activity in health and disease: comparison on a novel polarised ex-vivo organ culture model. Gut. 61 (7), 1007-1015 (2012).
- Gazzaniga, F. S., et al. Harnessing Colon Chip Technology to Identify Commensal Bacteria That Promote Host Tolerance to Infection. Frontiers in Cellular and Infection Microbiology. 11, 638014 (2021).
- Yissachar, N., et al. An Intestinal Organ Culture System Uncovers a Role for the Nervous System in Microbe-Immune Crosstalk. Cell. 168 (6), 1135-1148 (2017).
- Duscha, A., et al. Propionic Acid Shapes the Multiple Sclerosis Disease Course by an Immunomodulatory Mechanism. Cell. 180 (6), 1067-1080 (2020).
- Grosheva, I., et al. High-Throughput Screen Identifies Host and Microbiota Regulators of Intestinal Barrier Function. Gastroenterology. 159 (5), 1807-1823 (2020).
- Blaize, J. F., Corbo, C. P. Serial Dilutions and Plating: Microbial Enumeration. Journal of Visualized Experiments. , (2021).
- Ivanov, I. I., et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell. 139 (3), 485-498 (2009).
- Schnupf, P., et al. Growth and host interaction of mouse segmented filamentous bacteria in vitro. Nature. 520 (7545), 99-103 (2015).
- Chung, H., et al. Gut immune maturation depends on colonization with a host-specific microbiota. Cell. 149 (7), 1578-1593 (2012).
- Atarashi, K., et al. Th17 Cell Induction by Adhesion of Microbes to Intestinal Epithelial Cells. Cell. 163 (2), 367-380 (2015).

