Ett tarm tarmorgankultursystem för analys av värd-mikrobiotainteraktioner
Summary
Den här artikeln presenterar en unik metod för att analysera värd-mikrobiom interaktioner med hjälp av ett nytt tarmorgan kultursystem för ex vivo experiment.
Abstract
Tarmvävnadens struktur underlättar nära och mutualistiska interaktioner mellan värden och tarmfloran. Dessa korssamtal är avgörande för att upprätthålla lokal och systemisk homeostas. förändringar i tarmflorans sammansättning (dysbios) associeras med ett brett spektrum av mänskliga sjukdomar. Metoder för dissekering av värd-mikrobiotainteraktioner omfattar en inneboende kompromiss mellan bevarandet av fysiologisk vävnadsstruktur (vid användning av in vivo-djurmodeller) och kontrollnivån över experimentfaktorerna (som i enkla in vitro-cellkultursystem). För att ta itu med denna kompromiss utvecklade Yissachar et al. nyligen ett tarmorgankultursystem. Systemet bevarar en naiv kolonvävnadskonstruktion och cellulära mekanismer och det tillåter också snäv experimentell kontroll, vilket underlättar experiment som inte lätt kan utföras in vivo. Det är optimalt för dissekering av kortsiktiga svar av olika tarmkomponenter (såsom epiteliala, immunologiska och neuronala element) på luminala störningar (inklusive anaeroba eller aeroba mikrober, hela mikrobiotaprover från möss eller människor, läkemedel och metaboliter). Här presenterar vi en detaljerad beskrivning av ett optimerat protokoll för organkultur av flera tarmfragment med hjälp av en skräddarsydd tarmkulturanordning. Värd svar på luminal stör kan visualiseras genom immunofluorescens färgning av vävnad avsnitt eller hela mount vävnad fragment, fluorescens in-situ hybridisering (FISH) eller time-lapse imaging. Detta system stöder ett brett utbud av avläsningar, inklusive nästa generations sekvensering, flödescytometri och olika cellulära och biokemiska analyser. Sammantaget stöder detta tredimensionella organkultursystem kulturen hos stora, intakta tarmvävnader och har breda tillämpningar för högupplöst analys och visualisering av värd-mikrobiotainteraktioner i den lokala tarmmiljön.
Introduction
Tarmarna är ett mycket komplext organ som innehåller ett brett spektrum av celltyper (epitelceller, immunsystemceller, nervceller och mer) organiserade i en viss struktur som gör det möjligt för celler att interagera och kommunicera med varandra och med det luminala innehållet (mikrobiota, mat, etc.) 1.För närvarande innehåller den forskningsverktygslåda som finns tillgänglig för analys av värd-mikrobiotainteraktioner in vitro-cellkulturer och in vivo-djurmodeller 2. In vivo djurmodeller ger en fysiologiskvävnadskonstruktion 3 men med dålig experimentell kontroll och begränsad förmåga att manipulera experimentförhållandena. In vitro-odlingssystem, å andra sidan, använder primära celler eller cellinjer som kan kompletteras med mikrober4, vilket ger strikt kontroll över experimentparametrarna men saknar cellulär komplexitet och vävnadsarkitekturen. Moderna in vitro-analyser möjliggör avancerad användning av friska och patologiska mänskliga vävnadsprover, som epitelorganoider som härrör från mus- eller mänskligakällor 5,6, och prover som efterliknar mukosal mikromiljön7. Ett annat exempel är “tarmen på ett chip” -analysen, som inkluderar den mänskliga colonic epitelcelllinjen (Caco2), extracellulär matris och mikrofluidiska kanaler för att efterlikna tarmens fysiologiska tillstånd invariant8. Men så avancerade och innovativa som in vitro-prover kan vara, upprätthåller de inte en normal vävnadsarkitektur eller naiv cellulär sammansättning.
För att ta itu med detta utvecklade Yissachar et al. nyligen ett ex vivo-organkultursystem 9 ( figur1) som upprätthåller intakta tarmfragment ex vivo, som drar nytta av fördelarna med både in vivo- och in vitro-modeller. Detta ex vivo tarmorgankultursystem är baserat på en skräddarsydd odlingsanordning som stöder en multiplexkultur av sex kolonvävnader, vilket gör det möjligt att undersöka experimentella ingångar under jämförbara förhållanden samtidigt som systemets ingångar och utgångar styrs. Nya arbeten har visat att detta system är värdefullt för att analysera tarmsvar på enskilda tarmbakterier9, hela mänskliga mikrobiotaprover10 och mikrobiella metaboliter11. Detta system möjliggör för första gången studier av dessa tidiga värd-mikrobiotainteraktioner med en hög kontrollnivå över värdkomponenterna, mikrobiella och miljömässiga komponenter. Dessutom tillåter det övervakning och manipulatering av systemet under hela experimentet, i realtid.
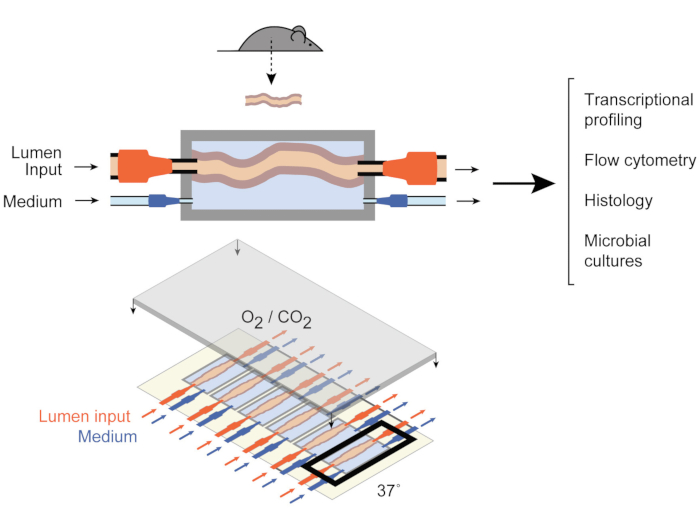
Figur 1: Schemat för tarmkulturanordningen. Ett helt tarmvävnadsfragment är fäst vid kammarens utgångs- och ingångsportar (överst), med pumpar som reglerar medelflödet inuti lumen och i den yttre medelkammaren. Hela enheten (botten) innehåller 6 sådana kammare. Denna siffra har ändrats från Yissachar et al. 2017. Klicka här om du vill visa en större version av den här figuren.
Protocol
Representative Results
Discussion
Denna artikel beskriver ett optimerat protokoll för ex vivo tarmorgan kulturer som Yissachar et al. nyligen har utvecklat(publicerad 9 och opublicerade data). Tarmorgankultursystemet stöder multiplexerad kultur av intakta tarmfragment samtidigt som luminalflödet bibehålls. Det ger full kontroll över den intra- och extra-luminal miljön (inklusive stimuleringsdos, exponeringstid och flödeshastighet) och bevarar den naiva tarmvävnadsstrukturen och dess cellulära komplexitet<sup clas…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Vi tackar tidigare och nuvarande medlemmar av Yissachar-labbet för deras värdefulla bidrag till att optimera tarmorgankultursystemets protokoll. Vi tackar Yael Laure för kritisk redigering av manuskriptet. Detta arbete stöddes av Israel Science Foundation (anslag nr 3114831), Israel Science Foundation – Broad Institute Joint Program (grant No. 8165162) och Gassner Fund for Medical Research, Israel.
Materials
| Device | |||
| 18 Gauge Blunt Needle | Mcmaster | 75165a754 | |
| 22 Gauge Blunt Needle | Mcmaster | 75165a758 | |
| All Purpose Adhesive Selant 100% Silicone | DAP | 688 | |
| Cubic Vacuum Desiccator VDC-21+ 2 Shelves | AAAD4021 | ||
| Glass Slide 1 mm Thick | Corning | 2947-75X50 | |
| Mini Incubator im-10 | AAH24315K | ||
| MPC 301E Vacuum PUMP | VI-412711 | ||
| Plastic Quick Turn Tube Coupling Plugs | Mcmaster | 51525k121 | |
| plastic Quick Turn Tube Coupling Sockets | Mcmaster | 52525k211 | |
| Sylgard 184 Silicone Elastomer | Dow | Polydimethylsiloxane, PDMS | |
| Tubing | Mcmaster | 6516t11 | |
| Zortrax M200 | Zortrax | Zortrax Z-SUITE, Autodesk Fusion 360 | |
| Zortrax M200 Materials: z-ultrat | Zortrax | ||
| Medium | |||
| B27 Supplement (50x), Serum Free | Thermo Fisher Scientific | 17504044 | |
| HEPES Buffer (1M) | Thermo Fisher Scientific | 15630056 | |
| Iscove's Mod Dulbecco's Medium With Phenol Red (1x) | Thermo Fisher Scientific | 12440061 | |
| Knock-Out Serum | Thermo Fisher Scientific | 10828028 | |
| N2 Supplement (100x) | Thermo Fisher Scientific | A1370701 | |
| Non Essential Amino Acid (100x) | Thermo Fisher Scientific | 11140035 | |
| Surgical Tools | |||
| Large Scissors | Aseltech | 11-00-10 | |
| Sharp Forceps | F.S.T | 11297-10 | |
| Silk Braided Surgical Thread | SMI | 8010G | |
| Straight Scissors | F.S.T | 14091-09 | |
| Thin Forceps | F.S.T | 11051-10 | |
| Organ System | |||
| 0.1 µm Filter | Life Gene | ||
| 0.22 µm Filter | Life Gene | ||
| 5 mL Luer Lock Syringe | B-D | 309649 | |
| Greenough Stereo Microscope | ZEISS | Stemi 305 | |
| Recirculating Precision Air Heater "CUBE" | CUBE-2-LIS | ||
| Syringe Pump | new era pump systems inc | nep-ne-1600-em |
Riferimenti
- Mowat, A. M., Agace, W. W. Regional specialization within the intestinal immune system. Nature Reviews Immunology. 14 (10), 667-685 (2014).
- Pearce, S. C., et al. Intestinal in vitro and ex vivo Models to Study Host-Microbiome Interactions and Acute Stressors. Frontiers in Physiology. 9 (1584), (2018).
- Hooper, L. V., et al. Molecular analysis of commensal host-microbial relationships in the intestine. Science. 291 (5505), 881-884 (2001).
- Haller, D., et al. Non-pathogenic bacteria elicit a differential cytokine response by intestinal epithelial cell/leucocyte co-cultures. Gut. 47 (1), 79-87 (2000).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett’s epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Tsilingiri, K., et al. Probiotic and postbiotic activity in health and disease: comparison on a novel polarised ex-vivo organ culture model. Gut. 61 (7), 1007-1015 (2012).
- Gazzaniga, F. S., et al. Harnessing Colon Chip Technology to Identify Commensal Bacteria That Promote Host Tolerance to Infection. Frontiers in Cellular and Infection Microbiology. 11, 638014 (2021).
- Yissachar, N., et al. An Intestinal Organ Culture System Uncovers a Role for the Nervous System in Microbe-Immune Crosstalk. Cell. 168 (6), 1135-1148 (2017).
- Duscha, A., et al. Propionic Acid Shapes the Multiple Sclerosis Disease Course by an Immunomodulatory Mechanism. Cell. 180 (6), 1067-1080 (2020).
- Grosheva, I., et al. High-Throughput Screen Identifies Host and Microbiota Regulators of Intestinal Barrier Function. Gastroenterology. 159 (5), 1807-1823 (2020).
- Blaize, J. F., Corbo, C. P. Serial Dilutions and Plating: Microbial Enumeration. Journal of Visualized Experiments. , (2021).
- Ivanov, I. I., et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell. 139 (3), 485-498 (2009).
- Schnupf, P., et al. Growth and host interaction of mouse segmented filamentous bacteria in vitro. Nature. 520 (7545), 99-103 (2015).
- Chung, H., et al. Gut immune maturation depends on colonization with a host-specific microbiota. Cell. 149 (7), 1578-1593 (2012).
- Atarashi, K., et al. Th17 Cell Induction by Adhesion of Microbes to Intestinal Epithelial Cells. Cell. 163 (2), 367-380 (2015).

