Konak-Mikrobiyota Etkileşimlerini Analiz Etmek için Bağırsak Bağırsak Organ Kültürü Sistemi
Summary
Bu makale, ex vivo deneyleri için yeni bir bağırsak organ kültürü sistemi kullanarak konak mikrobiyom etkileşimlerini analiz etmek için benzersiz bir yöntem salamaktadır.
Abstract
Bağırsak dokusunun yapısı, konakçı ile bağırsak mikrobiyotası arasındaki yakın ve karşılıklı etkileşimleri kolaylaştırır. Bu çapraz görüşmeler yerel ve sistemik homeostazların sürdürülmesi için çok önemlidir; bağırsak mikrobiyota bileşimindeki (disbiyozis) değişiklikler çok çeşitli insan hastalıkları ile ilişkilidir. Konak-mikrobiyota etkileşimlerini inceleme yöntemleri, fizyolojik doku yapısının korunması (in vivo hayvan modelleri kullanırken) ve deney faktörleri üzerindeki kontrol seviyesi (basit in vitro hücre kültürü sistemlerinde olduğu gibi) arasında doğal bir dengeyi kapsar. Bu dengeyi ele almak için, Yissachar ve arkadaşları yakın zamanda bir bağırsak organı kültür sistemi geliştirdiler. Sistem naif bir kolon dokusu yapımını ve hücresel mekanizmaları korur ve ayrıca sıkı deneysel kontrole izin vererek vivoolarak kolayca gerçekleştirilemeyen deneyleri kolaylaştırır. Çeşitli bağırsak bileşenlerinin (epitel, immünolojik ve nöronal elementler gibi) kısa süreli yanıtlarını ışık pertürbasyonlarına (anaerobik veya aerobik mikroplar, farelerden veya insanlardan gelen tüm mikrobiyota örnekleri, ilaçlar ve metabolitler dahil) ayırmak için en uygun olanıdır. Burada, özel yapım bir bağırsak kültürü cihazı kullanarak birden fazla bağırsak parçasının organ kültürü için optimize edilmiş bir protokolün ayrıntılı bir açıklamasını sunuyoruz. Luminal pertürbasyonlara konak yanıtları, doku bölümlerinin veya tüm montajlı doku parçalarının immünofluoresans boyanması, floresan yerinde hibridizasyon (FISH) veya zaman atlamalı görüntüleme ile görselleştirilebilir. Bu sistem, yeni nesil sıralama, akış sitometrisi ve çeşitli hücresel ve biyokimyasal tahliller de dahil olmak üzere çok çeşitli okumaları destekler. Genel olarak, bu üç boyutlu organ kültürü sistemi büyük, bozulmamış bağırsak dokularının kültürünü destekler ve yerel bağırsak ortamında konak-mikrobiyota etkileşimlerinin yüksek çözünürlüklü analizi ve görselleştirilmesi için geniş uygulamalara sahiptir.
Introduction
Bağırsak, hücrelerin birbirleriyle ve ışık içeriğiyle (mikrobiyota, gıda vb.) etkileşime girmesini ve iletişim kurmasını sağlayan belirli bir yapıda düzenlenmiş çok çeşitli hücre tipleri (epitel hücreleri, bağışıklık sistemi hücreleri, nöronlar ve daha fazlası) içeren son derece karmaşık bir organdır. 1. Şu anda, konak-mikrobiyota etkileşimlerini analiz etmek için mevcut olan araştırma araç kutusu in vitro hücre kültürlerini ve in vivo hayvan modellerini içerir2. In vivo hayvan modelleri fizyolojik doku konstrüksiyon3 sağlar, ancak zayıf deneysel kontrol ve deney koşullarını manipüle etme yeteneği sınırlıdır. İn vitro kültür sistemleri ise, mikroplarla desteklenebilen birincil hücreleri veya hücre hatlarını kullanın4Deney parametreleri üzerinde sıkı kontrol sağlar, ancak hücresel karmaşıklıktan ve doku mimarisinden yoksundur. Modern in vitro tahliller, fare veya insan kaynaklarından elde edilen epitel organoidler 5,6ve mukozal mikroçevreyi taklit eden örnekler gibi sağlıklı ve patolojik insan dokusu örneklerinin ileri düzeyde kullanılmasına izin verir7. Başka bir örnek, bağırsak değişmez8’infizyolojik durumunu taklit etmek için insan kolonik epitel hücre hattı (Caco2), hücre dışı matris ve mikroakışkan kanalları içeren ‘çip üzerindeki bağırsak’ tahlildir. Bununla birlikte, in vitro örnekler ne kadar gelişmiş ve yenilikçi olsalar da, normal bir doku mimarisi veya naif hücresel bileşim sağlamaz.
Bunu ele almak için, Yissachar ve arkadaşları son zamanlarda sağlam bağırsak parçalarını koruyan bir ex vivo organ kültürü sistemi geliştirdi9 (Şekil 1) ex vivo, hem in vivo hem de in vitro modellerin avantajlarından yararlanıyor. Bu ex vivo gut organ kültürü sistemi, altı kolon dokusunun çok katlı kültürünü destekleyen, sistemin giriş ve çıkışlarını kontrol ederken benzer koşullar altında deneysel girdilerin incelenmesine izin veren özel yapım bir kültür cihazına dayanmaktadır. Son çalışmalar, bu sistemin bireysel bağırsak bakterilerine bağırsak yanıtlarını analiz etmek için değerli olduğunu göstermiştir9, tüm insan mikrobiyota örnekleri10 ve mikrobiyal metabolitler11. Bu sistem, ilk kez, bu erken konak-mikrobiyota etkileşimlerinin konak, mikrobiyal ve çevresel bileşenler üzerinde yüksek düzeyde kontrol ile incelenmesine izin verir. Ayrıca, deney boyunca sistemin gerçek zamanlı olarak izlenmesine ve manipüle etmesine izin verir.
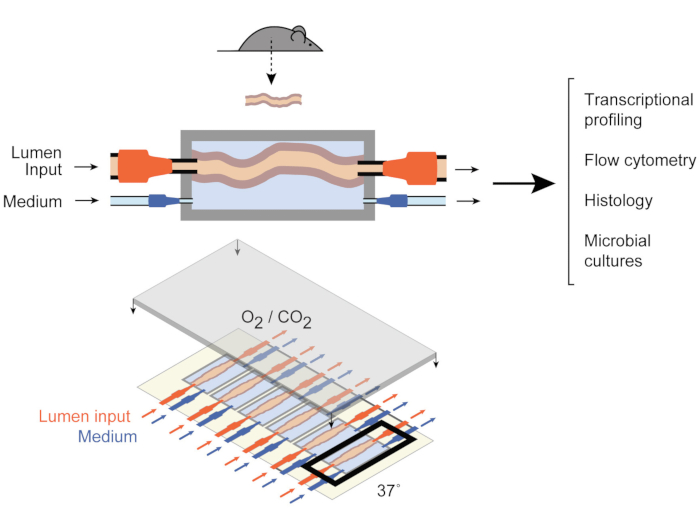
Şekil 1: Bağırsak kültürü cihazının şemaları. Bütün bir bağırsak dokusu parçası, odanın çıkış ve giriş portlarına (üstte), lümenin içindeki ve dış orta odanın içindeki orta akışı düzenleyen pompalarla tutturulur. Tüm cihaz (altta) bu tür 6 odacık içerir. Bu rakam Yissachar ve ark. 2017’den değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
Bu makalede, Yissachar ve arkadaşlarının yakın zamanda geliştirdiği ex vivo gut organ kültürleri için optimize edilmiş bir protokol açıklanmaktadır(yayınlanan 9 ve yayınlanmamış veriler). Bağırsak organ kültürü sistemi, parlak akışı korurken sağlam bağırsak parçalarının çok yönlü kültürünü destekler. İl içi ve ekstra-luminal ortam (stimülasyon dozu, maruz kalma süresi ve akış hızı dahil) üzerinde tam kontrol sağlar ve naif bağırsak dokusu …
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Yissachar laboratuvarının geçmiş ve şimdiki üyelerine bağırsak organ kültürü sistemi protokolünü optimize etmedeki değerli katkıları için teşekkür ederiz. Yael Laure’ye makalenin eleştirel düzenlemesi için teşekkür ederiz. Bu çalışma İsrail Bilim Vakfı (3114831 No. hibe), İsrail Bilim Vakfı – Broad Institute Ortak Programı (8165162 Sayılı hibe) ve gassner Tıbbi Araştırma Fonu, İsrail tarafından desteklendi.
Materials
| Device | |||
| 18 Gauge Blunt Needle | Mcmaster | 75165a754 | |
| 22 Gauge Blunt Needle | Mcmaster | 75165a758 | |
| All Purpose Adhesive Selant 100% Silicone | DAP | 688 | |
| Cubic Vacuum Desiccator VDC-21+ 2 Shelves | AAAD4021 | ||
| Glass Slide 1 mm Thick | Corning | 2947-75X50 | |
| Mini Incubator im-10 | AAH24315K | ||
| MPC 301E Vacuum PUMP | VI-412711 | ||
| Plastic Quick Turn Tube Coupling Plugs | Mcmaster | 51525k121 | |
| plastic Quick Turn Tube Coupling Sockets | Mcmaster | 52525k211 | |
| Sylgard 184 Silicone Elastomer | Dow | Polydimethylsiloxane, PDMS | |
| Tubing | Mcmaster | 6516t11 | |
| Zortrax M200 | Zortrax | Zortrax Z-SUITE, Autodesk Fusion 360 | |
| Zortrax M200 Materials: z-ultrat | Zortrax | ||
| Medium | |||
| B27 Supplement (50x), Serum Free | Thermo Fisher Scientific | 17504044 | |
| HEPES Buffer (1M) | Thermo Fisher Scientific | 15630056 | |
| Iscove's Mod Dulbecco's Medium With Phenol Red (1x) | Thermo Fisher Scientific | 12440061 | |
| Knock-Out Serum | Thermo Fisher Scientific | 10828028 | |
| N2 Supplement (100x) | Thermo Fisher Scientific | A1370701 | |
| Non Essential Amino Acid (100x) | Thermo Fisher Scientific | 11140035 | |
| Surgical Tools | |||
| Large Scissors | Aseltech | 11-00-10 | |
| Sharp Forceps | F.S.T | 11297-10 | |
| Silk Braided Surgical Thread | SMI | 8010G | |
| Straight Scissors | F.S.T | 14091-09 | |
| Thin Forceps | F.S.T | 11051-10 | |
| Organ System | |||
| 0.1 µm Filter | Life Gene | ||
| 0.22 µm Filter | Life Gene | ||
| 5 mL Luer Lock Syringe | B-D | 309649 | |
| Greenough Stereo Microscope | ZEISS | Stemi 305 | |
| Recirculating Precision Air Heater "CUBE" | CUBE-2-LIS | ||
| Syringe Pump | new era pump systems inc | nep-ne-1600-em |
Riferimenti
- Mowat, A. M., Agace, W. W. Regional specialization within the intestinal immune system. Nature Reviews Immunology. 14 (10), 667-685 (2014).
- Pearce, S. C., et al. Intestinal in vitro and ex vivo Models to Study Host-Microbiome Interactions and Acute Stressors. Frontiers in Physiology. 9 (1584), (2018).
- Hooper, L. V., et al. Molecular analysis of commensal host-microbial relationships in the intestine. Science. 291 (5505), 881-884 (2001).
- Haller, D., et al. Non-pathogenic bacteria elicit a differential cytokine response by intestinal epithelial cell/leucocyte co-cultures. Gut. 47 (1), 79-87 (2000).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett’s epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Tsilingiri, K., et al. Probiotic and postbiotic activity in health and disease: comparison on a novel polarised ex-vivo organ culture model. Gut. 61 (7), 1007-1015 (2012).
- Gazzaniga, F. S., et al. Harnessing Colon Chip Technology to Identify Commensal Bacteria That Promote Host Tolerance to Infection. Frontiers in Cellular and Infection Microbiology. 11, 638014 (2021).
- Yissachar, N., et al. An Intestinal Organ Culture System Uncovers a Role for the Nervous System in Microbe-Immune Crosstalk. Cell. 168 (6), 1135-1148 (2017).
- Duscha, A., et al. Propionic Acid Shapes the Multiple Sclerosis Disease Course by an Immunomodulatory Mechanism. Cell. 180 (6), 1067-1080 (2020).
- Grosheva, I., et al. High-Throughput Screen Identifies Host and Microbiota Regulators of Intestinal Barrier Function. Gastroenterology. 159 (5), 1807-1823 (2020).
- Blaize, J. F., Corbo, C. P. Serial Dilutions and Plating: Microbial Enumeration. Journal of Visualized Experiments. , (2021).
- Ivanov, I. I., et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell. 139 (3), 485-498 (2009).
- Schnupf, P., et al. Growth and host interaction of mouse segmented filamentous bacteria in vitro. Nature. 520 (7545), 99-103 (2015).
- Chung, H., et al. Gut immune maturation depends on colonization with a host-specific microbiota. Cell. 149 (7), 1578-1593 (2012).
- Atarashi, K., et al. Th17 Cell Induction by Adhesion of Microbes to Intestinal Epithelial Cells. Cell. 163 (2), 367-380 (2015).

