Fluorescerande mätning i realtid av synaptiska funktioner i modeller av amyotrofisk lateralskleros
Summary
Två relaterade metoder beskrivs för att visualisera subcellulära händelser som krävs för synaptisk överföring. Dessa protokoll möjliggör realtidsövervakning av dynamiken i presynaptisk kalciuminflöde och synaptisk vesiklarmembranfusion med hjälp av levande cellavbildning av in vitro-odlade neuroner.
Abstract
Före neuronal degeneration är orsaken till motoriska och kognitiva underskott hos patienter med amyotrofisk lateralskleros (ALS) och / eller frontotemporal lobdemens (FTLD) dysfunktion i kommunikationen mellan neuroner och motorneuroner och muskler. Den underliggande processen för synaptisk överföring involverar membrandepolariseringsberoende synaptisk vesiklarfusion och frisättning av neurotransmittorer i synapsen. Denna process sker genom lokaliserad kalciuminflöde i de presynaptiska terminalerna där synaptiska vesiklar finns. Här beskriver protokollet fluorescensbaserade live-imaging-metoder som på ett tillförlitligt sätt rapporterar depolariseringsmedierad synaptisk vesikleexocytos och presynaptisk terminal kalciuminflödesdynamik i odlade neuroner.
Med hjälp av ett styrylfärgämne som ingår i synaptiska vesiklarmembran belyses den synaptiska vesiklarsättningen. Å andra sidan, för att studera kalciuminträde, används Gcamp6m, en genetiskt kodad fluorescerande reporter. Vi använder hög kaliumkloridmedierad depolarisering för att efterlikna neuronal aktivitet. För att kvantifiera synaptisk vesiklexocytos entydigt mäter vi förlusten av normaliserad styrylfärgfluorescens som en funktion av tiden. Under liknande stimuleringsbetingelser, vid kalciuminflöde, ökar Gcamp6m-fluorescensen. Normalisering och kvantifiering av denna fluorescensförändring utförs på ett liknande sätt som styrylfärgprotokollet. Dessa metoder kan multiplexeras med transfektionsbaserat överuttryck av fluorescerande märkta mutanta proteiner. Dessa protokoll har använts i stor utsträckning för att studera synaptisk dysfunktion i modeller av FUS-ALS och C9ORF72-ALS, med användning av primära gnagare kortikala och motoriska neuroner. Dessa protokoll möjliggör enkelt snabb screening av föreningar som kan förbättra neuronal kommunikation. Som sådan är dessa metoder värdefulla inte bara för studier av ALS utan för alla områden av neurodegenerativ och utvecklingsneurovetenskaplig forskning.
Introduction
Modellering av amyotrofisk lateralskleros (ALS) i laboratoriet görs unikt utmanande på grund av den överväldigande sporadiska karaktären hos över 80 % av fallen1, i kombination med det stora antalet genetiska mutationer som är kända för att vara sjukdomsorsakande2. Trots detta delar alla fall av ALS den förenande egenskapen att före direkt neuronal degeneration finns det dysfunktionell kommunikation mellan presynaptiska motorneuroner och postsynaptiska muskelceller3,4. Kliniskt, när patienter förlorar anslutningen av de återstående övre och nedre motorneuronerna, presenterar de funktioner av neuronal hyper- och hypoexcitabilitet under hela sjukdomen5,6,7,8,9, vilket återspeglar komplexa underliggande molekylära förändringar i dessa synapser, som vi som ALS-forskare försöker förstå.
Flera transgena modeller har illustrerat att försämring och desorganisation av den neuromuskulära korsningen sker med uttrycket av ALS-orsakande genetiska mutationer, inklusive SOD110, FUS11,12, C9orf7213,14,15,16 och TDP4317,18,19 genom morfologiska bedömningar, inklusive utvärdering av synaptiska boutons, ryggradstätheter och pre/postsynaptisk organisation. Mekaniskt, sedan Coles, Hodgkins och Huxleys landmärkespapper på 1930-talet, har det också varit möjligt att utvärdera synaptiska svar genom elektrofysiologiska tekniker i antingen in vitro-cellodling eller vävnadsskivberedningar20. Genom dessa strategier har många modeller av ALS visat synaptiska överföringsunderskott. Till exempel orsakar en mutant variant av TDP43 förbättrad avfyrningsfrekvens och minskar tröskeln för åtgärdspotential i NSC-34 (ryggmärg x neuroblastom hybridcellinje 34) motorneuronliknande celler21. Samma variant orsakar också dysfunktionell synaptisk överföring vid den neuromuskulära korsningen (NMJ) före uppkomsten av beteendemässiga motoriska underskott i en musmodell22. Det har tidigare visats att muterat FUS-uttryck resulterar i minskad synaptisk överföring vid NMJ i en drosophilamodell av FUS-ALS före rörelsedefekter11. En nyligen genomförd rapport med användning av inducerade pluripotenta stamceller härledda från C9orf72-expansionsbärare avslöjade en minskning av den lätt frisläppbara poolen av synaptiska vesiklar23. Sammantaget belyser dessa studier och andra vikten av att bygga en mer omfattande förståelse för mekanismerna bakom synaptisk signalering i sjukdomsrelevanta modeller av ALS. Detta kommer att vara avgörande för att förstå patobiologin för ALS och utveckla potentiella terapeutiska mål för patienter.
Metoder för ström- och spänningsklämningsceller har varit ovärderliga för att bestämma membranegenskaper såsom konduktans, vilande membranpotential och kvantinnehåll i enskilda synapser20,24. En av de betydande begränsningarna med elektrofysiologi är dock att den är tekniskt utmanande och bara ger insikter från en enda neuron åt gången. Konfokalmikroskopi med levande celler, i kombination med specifika fluorescerande sonder, ger möjlighet att undersöka den synaptiska överföringen av neuroner på ett spatiotemporalt sätt25,26,27. Även om det inte är ett direkt mått på neuronal excitabilitet, kan denna fluorescensmetod ge en relativ mätning av två molekylära korrelationer av synaptisk funktion: synaptisk vesiklarsättning och kalciumtransienter vid synaptiska terminaler.
När en åtgärdspotential når den presynaptiska terminala regionen av neuroner utlöses kalciumtransienter, vilket underlättar övergången från en elektrisk signal till processen för frisättning av neurotransmittorer28. Spänningsgrindade kalciumkanaler lokaliserade till dessa områden reglerar kalciumsignaleringen tätt för att modulera kinetiken för frisättning av neurotransmittorer29. De första rapporterade fluorescensbaserade inspelningarna av kalciumtransienter utfördes med användning av antingen dubbelvåglängdsindikatorn Fura-2 AM eller det enda våglängdsfärgämnet Fluo-3 AM30,31,32. Även om dessa färgämnen erbjöd stor ny insikt vid den tiden, lider de av flera begränsningar, såsom icke-specifik uppdelning i celler, aktiv eller passiv färgförlust från märkta celler, fotoblekning och toxicitet om de avbildas under längre tidsperioder33. Under det senaste decenniet har genetiskt kodade kalciumindikatorer blivit arbetshästar för avbildning av olika former av neuronal aktivitet. Dessa indikatorer kombinerar ett modifierat fluorescerande protein med ett kalciumkelatorprotein som snabbt växlar fluorescensintensitet efter bindningen av Ca2+ joner34. Tillämpningen av dessa nya indikatorer är omfattande, vilket möjliggör mycket enklare visualisering av intracellulära kalciumtransienter både in vitro– och in vivo-inställningar. En familj av dessa genetiskt kodade reportrar, känd som GCaMP, används nu i stor utsträckning. Dessa indikatorer innehåller en C-terminal kalmodulindomän, följt av grönt fluorescerande protein (GFP), och är begränsade av en N-terminal kalmodulinbindande region35,36. Kalciumbindning till kalmodulindomänen utlöser en interaktion med den kalmodulinbindande regionen, vilket resulterar i en konformationsförändring i den totala proteinstrukturen och en väsentlig ökning av fluorescensen hos GFP-delen35,36. Under årens lopp har denna familj av reportrar genomgått flera utvecklingar för att möjliggöra distinkta avläsningar för specifika kalciumtransienter med specifik kinetik (långsam, medium och snabb), var och en med något olika egenskaper37,38. Här har användningen av reportern GcaMP6 belysts, som tidigare har visat sig detektera enstaka åtgärdspotentialer och dendritiska kalciumtransienter i neuroner både in vivo och in vitro37.
Kalciumtransienter i den presynaptiska regionen utlöser synaptiska vesiklarfusionshändelser, vilket orsakar frisättning av neurotransmittorer i synapsen och initiering av signalhändelser i den postsynaptiska cellen28,39. Synaptiska vesiklar frigörs både snabbt och återvinns, eftersom cellen homeostatiskt upprätthåller en stabil cellmembranyta och lätt frigörbar pool av fusionskapabla membranbundna vesiklar40. Styrylfärgämnet som används här har en affinitet mot lipidmembran och ändrar specifikt dess emissionsegenskaper baserat på ordningen av den omgivande lipidmiljön41,42. Således är det ett idealiskt verktyg för märkning av återvinning av synaptiska vesiklar och efterföljande spårning av dessa vesiklar när de senare frigörs efter neuronal stimulering41,42. Protokollet som har genererats och optimerats är en anpassning av de begrepp som ursprungligen beskrevs av Gaffield och kollegor, vilket gör att vi kontinuerligt kan visualisera styrylfärgmärkt synaptisk vesiklarecta över tiden41.
Här beskrivs två relaterade fluorescensbaserade metoder som på ett tillförlitligt sätt rapporterar specifika cellulära händelser som är involverade i synaptisk överföring. Protokoll har definierats för att undersöka dynamiken i depolariseringsmedierad presynaptisk terminal kalciuminflöde och synaptisk vesikleexocytos i odlade neuroner. Här fokuseras metoder och representativa resultat på att använda primära gnagare kortikala eller motoriska neuroner som in vitro-modellsystem, eftersom det finns publicerade studier med dessa celltyper43,44. Dessa metoder är emellertid också tillämpliga på differentierade humana i3 kortikala nervceller45, eftersom vi också har haft framgång med båda protokollen i för närvarande pågående experiment i vårt laboratorium. Det allmänna protokollet beskrivs i ett stegvis linjärt format, som visas i figur 1. I korthet, för att studera kalciumdynamiken i neuriter transfekteras mogna neuroner med plasmid-DNA för att uttrycka den fluorescerande reportern GCaMP6m under en Cytomegalovirus (CMV) promotor37,46. Transfekterade celler har en låg nivå av basal grön fluorescens, vilket ökar i närvaro av kalcium. Regioner av intresse specificeras för att övervaka fluorescensförändringar under hela vår manipulation. Detta gör det möjligt att mäta mycket rumsligt och tidsmässigt lokaliserade fluktuationer i kalcium37,46. För utvärdering av synaptisk vesiklarfusion och frisättning laddas mogna neuroner med styrylfärgämne införlivat i synaptiska vesiklarmembran när de återvinns, reformeras och laddas om med neurotransmittorer i presynaptiska celler41,42,43,47,48. De nuvarande färgämnena som används för detta ändamål märker synaptiska vesiklar längs neuriter och används som proxy för dessa regioner i live-imaging-experiment, vilket visades genom samfärgning av styrylfärgämne och synaptotagmin av Kraszewski och kollegor49. Här ingår representativa bilder av liknande färgning som också har utförts (figur 2A). Tidigare utredare har i stor utsträckning använt sådana färgämnen för att rapportera synaptisk vesikeldynamik vid den neuromuskulära korsningen och hippocampala neuroner48,49,50,51,52,53,54,55,56 . Genom att välja punkterade regioner av färgladdade vesiklar och genom att övervaka minskningar av fluorescensintensiteten efter vesiklarsättning kan funktionell synaptisk överföringskapacitet och temporal frisättningsdynamik studeras efter stimulering43. För båda metoderna används ett medium innehållande en hög koncentration av kaliumklorid för att depolarisera celler för att efterlikna neuronal aktivitet. Bildparametrar anges för att fånga intervall under sekunden som spänner över en baslinjenormalisering följt av vår stimuleringsfångstperiod. Fluorescensmätningar vid varje tidpunkt bestäms, normaliseras till bakgrunden och kvantifieras under den experimentella tidsperioden. Kalciuminflödesmedierad GCaMP6m fluorescensökning eller effektiv synaptisk vesiklarexocytocytos styrylfärgämne frisättning fluorescens minskning kan detekteras genom denna strategi. Detaljerad metodologisk inställning och parametrar för dessa två protokoll och en diskussion om deras fördelar och begränsningar beskrivs nedan.
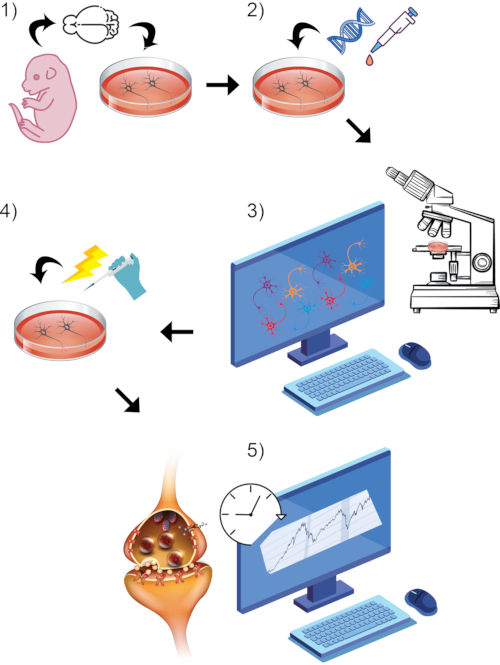
Bild 1: Visuell återgivning av den övergripande allmänna protokollprocessen. (1) Isolera och odla primära gnagareneuroner in vitro till vald mognadstidspunkt. (2) Introducera GCaMP-DNA eller styrylfärgämne som rapportörer av synaptisk aktivitet. (3) Inställningsavbildningsparadigm med hjälp av live-imaging-utrustat konfokalmikroskop och tillhörande programvara. Påbörja baslinjeinspelningsperioden. (4) Medan celler fortfarande genomgår live-image-fångst, stimulera neuroner via hög KCl-badperfusion. (5) Bedöma fluorescensintensitetsmätningar över tid för att mäta kalciumtransienter eller synaptisk vesiklarfusion. Klicka här för att se en större version av denna figur.
Protocol
Representative Results
Discussion
Tre steg som är gemensamma för båda metoderna som beskrivs är av avgörande betydelse för experimentell framgång och kvantifierbara resultat. För det första är det viktigt att förbereda färsk aCSF före varje experimentomgång enligt bifogade instruktioner. Underlåtenhet att göra detta kan förhindra lämplig neuronal depolarisering. Ett prov av obehandlade kontrollneuroner bör ständigt testas före stimulering av några experimentella grupper för att säkerställa korrekt cellulär depolarisering och ge …
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Vi vill tacka de nuvarande och tidigare medlemmarna i Jefferson Weinberg ALS Center för kritisk feedback och förslag för att optimera dessa tekniker och deras analyser. Detta arbete stöddes av finansiering från NIH (RF1-AG057882-01 och R21-NS0103118 till D.T), NINDS (R56-NS092572 och R01-NS109150 till P.P), Muscular Dystrophy Association (D.T.), Robert Packard Center for ALS Research (D.T.), Family Strong 4 ALS Foundation och Farber Family Foundation (B.K.J., K.K och P.P).
Materials
| 20x air objective | Nikon | For imaging | |
| 40x oil immersion objective | Nikon | For imaging | |
| B27 supplement | Thermo Scientific | 17504044 | Neuronal growth supplement |
| BD Syringes without Needle, 50 mL | Thermo Scientific | 13-689-8 | Part of gravity perfusion assembly |
| Biosafety cell culture hood | Baker | SterilGARD III SG403A | Asceptic cell culturing, transfection, and dye loading |
| b-Mercaptoethanol | Millipore Sigma | M3148 | For culturing and maintenance of neuronal cultures |
| Bovine Serum Albumin | Millipore Sigma | A9418 | For preparing neuronal cultures |
| Calcium chloride dihydrate | Millipore Sigma | 223506 | Component of aCSF solutions |
| Cell culture CO2 incubator | Thermo Scientific | 13-998-123 | For culturing and maintenance of neurons |
| Centrifuge | Eppendorf | 5810R | For neuronal culture preparation |
| Confocal microscope | Nikon | Eclipse Ti +A1R core | For fluorescence imaging |
| CoolSNAP ES2 CCD camera | Photometrics | For image acquisition | |
| D-Glucose | Millipore Sigma | G8270 | Component of aCSF solutions |
| DNase | Millipore Sigma | D5025 | For neuronal culture preparation |
| Female, timed-pregnancy Sprague Dawley rats | Charles river | 400SASSD | For preparing embryonic cortical and spinal motor neuron cultures |
| FITC Filter cube | Nikon | 77032509 | For imaging Gcamp calcium transients |
| FM4-64 styryl dye | Invitrogen | T13320 | For imaging synaptic vesicle release |
| Glass bottom petri dishes (Thickness #1.5) | CellVis | D35-10-1.5-N | For growth of neurons on imaging-compatible culture dish |
| Glass Pasteur pipette | Grainger | 52NK56 | For preparing neuronal cultures |
| Hank's Balanced Salt Solution (HBSS) | Millipore Sigma | H6648 | For preparing neuronal cultures |
| HEPES | Millipore Sigma | H3375 | Component of aCSF solutions |
| High KCl artifical cerebrospinal fluid (aCSF) | For imaging. Please see recipes* | ||
| horse serum | Millipore Sigma | H1138 | For culturing and maintenance of neurons |
| Laminar flow dissection hood | NUAIRE | NU-301-630 | For preparing neuronal cultures |
| Laminin | Thermo Scientific | 23017015 | For preparing neuronal cultures |
| Leibovitz's L-15 Medium | Thermo Scientific | 11415064 | For preparing neuronal cultures |
| Leibovitz's L-15 Medium, no phenol red | Thermo Scientific | 21083027 | For preparing neuronal cultures |
| L-Glutamine (200 mM) | Thermo Scientific | 25030149 | Neuronal culture supplement |
| Lipofectamine 2000 Transfection Reagent | Thermo Scientific | 11668019 | For neuronal transfections |
| Low KCl artifical cerebrospinal fluid (aCSF) | For imaging. Please see recipes* | ||
| Magnesium chloride | Millipore Sigma | 208337 | Component of aCSF solutions |
| Microsoft Excel | Microsoft | Software for data analysis/normalization | |
| Nalgene Filter Units, 0.2 µm PES | Thermo Scientific | 565-0020 | Filter unit for aCSF solution |
| Neurobasal medium | Thermo Scientific | 21103049 | For culturing and maintenance of neuronal cultures |
| NIS-Elements Advanced Research | Nikon | Software for image capture and analysis | |
| Nunc 15 mL Conical tubes | Thermo Scientific | 339650 | For preparing neuronal culture and buffer solutions |
| Nunc 50 mL conical tubes | Thermo Scientific | 339652 | For preparing neuronal culture and buffer solutions |
| Optiprep | Millipore Sigma | D1556 | For preparing neuronal cultures |
| Papain | Millipore Sigma | P4762 | For preparing neuronal cultures |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Scientific | 15140122 | To prevent bacterial contamination of neuronal cultures |
| Perfusion system | Warner Instruments | SF-77B | For exchange of aCSF |
| Perfusion tubing | Cole-Parmer | UX-30526-14 | Part of gravity perfusion assembly |
| pGP-CMV-Gcamp6m plasmid | Addgene | 40754 | For imaging calcium transients |
| Poly-D-lysine hydrobromide | Millipore Sigma | P7886 | Coating agent for glass bottom petri dishes |
| Potassium chloride | Millipore Sigma | P3911 | Component of aCSF solutions |
| Sodium bicarbonate | Millipore Sigma | S5761 | Component of aCSF solutions |
| Sodium Chloride | Millipore Sigma | S9888 | Component of aCSF solutions |
| Stage Top Incubator | Tokai Hit | For incubation of live neurons during imaging period | |
| TRITC Filter cube | Nikon | 77032809 | For imaging FM4-64 |
| Trypsin Inhibitor | Millipore Sigma | T6414 | For preparing neuronal cultures |
| Trypsin-EDTA (0.25%), phenol red | Thermo Scientific | 25200056 | For preparing neuronal cultures |
| Vibration Isolation table | New Port | VIP320X2430-135520 | Table/stand for microscope |
Riferimenti
- Gibson, S. B., et al. The evolving genetic risk for sporadic ALS. Neurology. 89 (3), 226-233 (2017).
- Kim, G., Gautier, O., Tassoni-Tsuchida, E., Ma, X. R., Gitler, A. D. ALS genetics: Gains, losses, and implications for future therapies. Neuron. 108 (5), 822-842 (2020).
- Nijssen, J., Comley, L. H., Hedlund, E. Motor neuron vulnerability and resistance in amyotrophic lateral sclerosis. Acta Neuropathologica. 133 (6), 863-885 (2017).
- Marttinen, M., Kurkinen, K. M., Soininen, H., Haapasalo, A., Hiltunen, M. Synaptic dysfunction and septin protein family members in neurodegenerative diseases. Molecular Neurodegeneration. 10, 16 (2015).
- Bae, J. S., Simon, N. G., Menon, P., Vucic, S., Kiernan, M. C. The puzzling case of hyperexcitability in amyotrophic lateral sclerosis. Journal of Clinical Neurology. 9 (2), 65-74 (2013).
- Kiernan, M. C. Hyperexcitability, persistent Na+ conductances and neurodegeneration in amyotrophic lateral sclerosis. Experimental Neurology. 218 (1), 1-4 (2009).
- Krarup, C. Lower motor neuron involvement examined by quantitative electromyography in amyotrophic lateral sclerosis. Clinical Neurophysiology. 122 (2), 414-422 (2011).
- Vucic, S., Nicholson, G. A., Kiernan, M. C. Cortical hyperexcitability may precede the onset of familial amyotrophic lateral sclerosis. Brain. 131, 1540-1550 (2008).
- Marchand-Pauvert, V., et al. Absence of hyperexcitability of spinal motoneurons in patients with amyotrophic lateral sclerosis. Journal of Physiology. 597 (22), 5445-5467 (2019).
- Fischer, L. R., et al. Amyotrophic lateral sclerosis is a distal axonopathy: evidence in mice and man. Experimental Neurology. 185 (2), 232-240 (2004).
- Markert, S. M., et al. Overexpression of an ALS-associated FUS mutation in C. elegans disrupts NMJ morphology and leads to defective neuromuscular transmission. Biology Open. 9 (12), (2020).
- Shahidullah, M., et al. Defects in synapse structure and function precede motor neuron degeneration in Drosophila models of FUS-related ALS. Journal of Neuroscience. 33 (50), 19590-19598 (2013).
- Liu, Y., et al. C9orf72 BAC Mouse Model with Motor Deficits and Neurodegenerative Features of ALS/FTD. Neuron. 90 (3), 521-534 (2016).
- Freibaum, B. D., et al. GGGGCC repeat expansion in C9orf72 compromises nucleocytoplasmic transport. Nature. 525 (7567), 129-133 (2015).
- Zhang, K., et al. The C9orf72 repeat expansion disrupts nucleocytoplasmic transport. Nature. 525 (7567), 56-61 (2015).
- Perry, S., Han, Y., Das, A., Dickman, D. Homeostatic plasticity can be induced and expressed to restore synaptic strength at neuromuscular junctions undergoing ALS-related degeneration. Human Molecular Genetics. 26 (21), 4153-4167 (2017).
- Romano, G., et al. Chronological requirements of TDP-43 function in synaptic organization and locomotive control. Neurobiology of Disease. 71, 95-109 (2014).
- Armstrong, G. A., Drapeau, P. Calcium channel agonists protect against neuromuscular dysfunction in a genetic model of TDP-43 mutation in ALS. Journal of Neuroscience. 33 (4), 1741-1752 (2013).
- Diaper, D. C., et al. Loss and gain of Drosophila TDP-43 impair synaptic efficacy and motor control leading to age-related neurodegeneration by loss-of-function phenotypes. Human Molecular Genetics. 22 (8), 1539-1557 (2013).
- Schwiening, C. J. A brief historical perspective: Hodgkin and Huxley. Journal of Physiology. 590 (11), 2571-2575 (2012).
- Dong, H., et al. Curcumin abolishes mutant TDP-43 induced excitability in a motoneuron-like cellular model of ALS. Neuroscienze. 272, 141-153 (2014).
- Chand, K. K., et al. Defects in synaptic transmission at the neuromuscular junction precede motor deficits in a TDP-43(Q331K) transgenic mouse model of amyotrophic lateral sclerosis. Federation of American Societies for Experimental Biology Journal. 32 (5), 2676-2689 (2018).
- Perkins, E. M., et al. Altered network properties in C9ORF72 repeat expansion cortical neurons are due to synaptic dysfunction. Molecular Neurodegeneration. 16 (1), 13 (2021).
- Ceccarelli, B., Hurlbut, W. P. Vesicle hypothesis of the release of quanta of acetylcholine. Physiological Reviews. 60 (2), 396-441 (1980).
- Ettinger, A., Wittmann, T. Fluorescence live cell imaging. Methods in Cell Biology. 123, 77-94 (2014).
- Ryan, J., Gerhold, A. R., Boudreau, V., Smith, L., Maddox, P. S. Introduction to Modern Methods in Light Microscopy. Methods in Molecular Biology. 1563, 1-15 (2017).
- Wang, L., Frei, M. S., Salim, A., Johnsson, K. Small-molecule fluorescent probes for live-cell super-resolution microscopy. Journal of the American Chemical Society. 141 (7), 2770-2781 (2019).
- Neher, E. Vesicle pools and Ca2+ microdomains: new tools for understanding their roles in neurotransmitter release. Neuron. 20 (3), 389-399 (1998).
- Dolphin, A. C., Lee, A. Presynaptic calcium channels: specialized control of synaptic neurotransmitter release. Nature Reviews Neuroscience. 21 (4), 213-229 (2020).
- Tsien, R. Y., Rink, T. J., Poenie, M. Measurement of cytosolic free Ca2+ in individual small cells using fluorescence microscopy with dual excitation wavelengths. Cell Calcium. 6 (1-2), 145-157 (1985).
- Takahashi, N., et al. Cytosolic Ca2+ dynamics in hamster ascending thin limb of Henle’s loop. American Journal of Physiology. 268 (6), 1148-1153 (1995).
- Cleemann, L., DiMassa, G., Morad, M. Ca2+ sparks within 200 nm of the sarcolemma of rat ventricular cells: evidence from total internal reflection fluorescence microscopy. Advances in Experimental Medicine and Biology. 430, 57-65 (1997).
- Roe, M. W., Lemasters, J. J., Herman, B. Assessment of Fura-2 for measurements of cytosolic free calcium. Cell Calcium. 11 (2-3), 63-73 (1990).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6 (12), 875-881 (2009).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein. Nature Biotechnology. 19 (2), 137-141 (2001).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Horikawa, K. Recent progress in the development of genetically encoded Ca2+ indicators. Journal of Medical Investigation. 62 (1-2), 24-28 (2015).
- Bohme, M. A., Grasskamp, A. T., Walter, A. M. Regulation of synaptic release-site Ca(2+) channel coupling as a mechanism to control release probability and short-term plasticity. Federation of European Biochemical Society Letters. 592 (21), 3516-3531 (2018).
- Li, Y. C., Kavalali, E. T. Synaptic vesicle-recycling machinery components as potential therapeutic targets. Pharmacological Reviews. 69 (2), 141-160 (2017).
- Gaffield, M. A., Betz, W. J. Imaging synaptic vesicle exocytosis and endocytosis with FM dyes. Nature Protocols. 1 (6), 2916-2921 (2006).
- Verstreken, P., Ohyama, T., Bellen, H. J. FM 1-43 labeling of synaptic vesicle pools at the Drosophila neuromuscular junction. Methods in Molecular Biology. 440, 349-369 (2008).
- Jensen, B. K., et al. Synaptic dysfunction induced by glycine-alanine dipeptides in C9orf72-ALS/FTD is rescued by SV2 replenishment. European Molecular Biology Organization Molecular Medicine. 12 (5), 10722 (2020).
- Kia, A., McAvoy, K., Krishnamurthy, K., Trotti, D., Pasinelli, P. Astrocytes expressing ALS-linked mutant FUS induce motor neuron death through release of tumor necrosis factor-alpha. Glia. 66 (5), 1016-1033 (2018).
- Fernandopulle, M. S., et al. Transcription Factor-Mediated Differentiation of Human iPSCs into Neurons. Current Protocols in Cell Biology. 79 (1), 51 (2018).
- Ye, L., Haroon, M. A., Salinas, A., Paukert, M. Comparison of GCaMP3 and GCaMP6f for studying astrocyte Ca2+ dynamics in the awake mouse brain. Public Library of Science One. 12 (7), 0181113 (2017).
- Angleson, J. K., Betz, W. J. Monitoring secretion in real time: capacitance, amperometry and fluorescence compared. Trends in Neuroscience. 20 (7), 281-287 (1997).
- Ryan, T. A., et al. The kinetics of synaptic vesicle recycling measured at single presynaptic boutons. Neuron. 11 (4), 713-724 (1993).
- Kraszewski, K., et al. Synaptic vesicle dynamics in living cultured hippocampal neurons visualized with CY3-conjugated antibodies directed against the lumenal domain of synaptotagmin. Journal of Neuroscience. 15 (6), 4328-4342 (1995).
- Betz, W. J., Mao, F., Bewick, G. S. Activity-dependent fluorescent staining and destaining of living vertebrate motor nerve terminals. Journal of Neuroscience. 12 (2), 363-375 (1992).
- Betz, W. J., Bewick, G. S. Optical analysis of synaptic vesicle recycling at the frog neuromuscular junction. Science. 255 (5041), 200-203 (1992).
- Ryan, T. A., Smith, S. J. Vesicle pool mobilization during action potential firing at hippocampal synapses. Neuron. 14 (5), 983-989 (1995).
- Betz, W. J., Ridge, R. M., Bewick, G. S. Comparison of FM1-43 staining patterns and electrophysiological measures of transmitter release at the frog neuromuscular junction. Journal of Physiology-Paris. 87 (3), 193-202 (1993).
- Wu, L. G., Betz, W. J. Nerve activity but not intracellular calcium determines the time course of endocytosis at the frog neuromuscular junction. Neuron. 17 (4), 769-779 (1996).
- Ryan, T. A., Smith, S. J., Reuter, H. The timing of synaptic vesicle endocytosis. Proceedings of the National Academy of Sciences of the United States of America. 93 (11), 5567-5571 (1996).
- Ramaswami, M., Krishnan, K. S., Kelly, R. B. Intermediates in synaptic vesicle recycling revealed by optical imaging of Drosophila neuromuscular junctions. Neuron. 13 (2), 363-375 (1994).
- Kayser, M. S., McClelland, A. C., Hughes, E. G., Dalva, M. B. Intracellular and trans-synaptic regulation of glutamatergic synaptogenesis by EphB receptors. Journal of Neuroscience. 26 (47), 12152-12164 (2006).
- Washburn, H. R., Xia, N. L., Zhou, W., Mao, Y. T., Dalva, M. B. Positive surface charge of GluN1 N-terminus mediates the direct interaction with EphB2 and NMDAR mobility. Nature Communications. 11 (1), 570 (2020).
- Magrane, J., Sahawneh, M. A., Przedborski, S., Estevez, A. G., Manfredi, G. Mitochondrial dynamics and bioenergetic dysfunction is associated with synaptic alterations in mutant SOD1 motor neurons. Journal of Neuroscience. 32 (1), 229-242 (2012).
- Casci, I., et al. Muscleblind acts as a modifier of FUS toxicity by modulating stress granule dynamics and SMN localization. Nature Communications. 10 (1), 5583 (2019).
- Hruska, M., Henderson, N., Le Marchand, S. J., Jafri, H., Dalva, M. B. Synaptic nanomodules underlie the organization and plasticity of spine synapses. Nature Neuroscience. 21 (5), 671-682 (2018).
- Rein, M. L., Deussing, J. M. The optogenetic (r)evolution. Molecular Genetics and Genomics. 287 (2), 95-109 (2012).
- Bertucci, C., Koppes, R., Dumont, C., Koppes, A. Neural responses to electrical stimulation in 2D and 3D in vitro environments. Brain Research Bulletin. 152, 265-284 (2019).
- Zhang, Y., et al. jGCaMP8 Fast genetically encoded calcium indicators. Janelia Research Campus. , (2020).
- Guerra-Gomes, S., Sousa, N., Pinto, L., Oliveira, J. F. Functional roles of astrocyte calcium elevations: From synapses to behavior. Frontiers in Cellular Neuroscience. 11, 427 (2017).
- Westergard, T., et al. Cell-to-cell transmission of dipeptide repeat proteins linked to C9orf72-ALS/FTD. Cell Reports. 17 (3), 645-652 (2016).
- Wen, X., et al. Antisense proline-arginine RAN dipeptides linked to C9ORF72-ALS/FTD form toxic nuclear aggregates that initiate in vitro and in vivo neuronal death. Neuron. 84 (6), 1213-1225 (2014).
- Daigle, J. G., et al. Pur-alpha regulates cytoplasmic stress granule dynamics and ameliorates FUS toxicity. Acta Neuropathologica. 131 (4), 605-620 (2016).

