Mesure fluorescente en temps réel des fonctions synaptiques dans les modèles de sclérose latérale amyotrophique
Summary
Deux méthodes connexes sont décrites pour visualiser les événements subcellulaires nécessaires à la transmission synaptique. Ces protocoles permettent de surveiller en temps réel la dynamique de l’afflux de calcium présynaptique et de la fusion de la membrane des vésicules synaptiques à l’aide de l’imagerie cellulaire vivante de neurones cultivés in vitro .
Abstract
Avant la dégénérescence neuronale, la cause des déficits moteurs et cognitifs chez les patients atteints de sclérose latérale amyotrophique (SLA) et / ou de démence du lobe frontotemporal (FTLD) est un dysfonctionnement de la communication entre les neurones et les motoneurones et les muscles. Le processus sous-jacent de transmission synaptique implique la fusion des vésicules synaptiques dépendantes de la dépolarisation membranaire et la libération de neurotransmetteurs dans la synapse. Ce processus se produit par l’afflux localisé de calcium dans les terminaux présynaptiques où résident les vésicules synaptiques. Ici, le protocole décrit des méthodologies d’imagerie en direct basées sur la fluorescence qui rapportent de manière fiable l’exocytose des vésicules synaptiques médiées par la dépolarisation et la dynamique de l’afflux de calcium terminal présynaptique dans les neurones cultivés.
À l’aide d’un colorant stylique incorporé dans les membranes des vésicules synaptiques, la libération des vésicules synaptiques est élucidée. D’autre part, pour étudier l’entrée du calcium, Gcamp6m est utilisé, un rapporteur fluorescent génétiquement codé. Nous utilisons une dépolarisation à haute teneur en chlorure de potassium pour imiter l’activité neuronale. Pour quantifier sans ambiguïté l’exocytose des vésicules synaptiques, nous mesurons la perte de fluorescence normalisée du colorant styryl en fonction du temps. Dans des conditions de stimulation similaires, en cas d’afflux de calcium, la fluorescence de Gcamp6m augmente. La normalisation et la quantification de ce changement de fluorescence sont effectuées de la même manière que le protocole du colorant styryl. Ces méthodes peuvent être multiplexées avec une surexpression basée sur la transfection de protéines mutantes marquées par fluorescence. Ces protocoles ont été largement utilisés pour étudier le dysfonctionnement synaptique dans des modèles de FUS-ALS et de C9ORF72-ALS, en utilisant des corticaux et des motoneurones de rongeurs primaires. Ces protocoles permettent facilement un dépistage rapide des composés susceptibles d’améliorer la communication neuronale. En tant que telles, ces méthodes sont précieuses non seulement pour l’étude de la SLA, mais aussi pour tous les domaines de la recherche en neurosciences neurodégénératives et développementales.
Introduction
La modélisation de la sclérose latérale amyotrophique (SLA) en laboratoire est rendue particulièrement difficile en raison de la nature extrêmement sporadique de plus de 80 % des cas1, associée au grand nombre de mutations génétiques connues pour être à l’origine de la maladie2. Malgré cela, tous les cas de SLA partagent la caractéristique unificatrice qu’avant la dégénérescence neuronale pure et simple, il existe une communication dysfonctionnelle entre les motoneurones présynaptiques et les cellules musculaires postsynaptiques3,4. Cliniquement, à mesure que les patients perdent la connectivité des motoneurones supérieurs et inférieurs restants, ils présentent des caractéristiques d’hyper- et d’hypoexcitabilité neuronale tout au long de la maladie5,6,7,8,9, reflétant des changements moléculaires sous-jacents complexes à ces synapses, que nous, en tant que chercheurs sur la SLA, cherchons à comprendre.
Plusieurs modèles transgéniques ont montré que la détérioration et la désorganisation de la jonction neuromusculaire se produisent avec l’expression de mutations génétiques responsables de la SLA, y compris SOD110, FUS11,12, C9orf7213,14,15,16 et TDP4317,18,19 par des évaluations morphologiques, y compris l’évaluation des boutons synaptiques, des densités de la colonne vertébrale et de l’organisation pré/postsynaptique. Mécaniquement, depuis les articles historiques de Cole, Hodgkin et Huxley dans les années 1930, il a également été possible d’évaluer les réponses synaptiques grâce à des techniques électrophysiologiques dans des cultures cellulaires in vitro ou des préparations de tranches de tissu20. Grâce à ces stratégies, de nombreux modèles de SLA ont démontré des déficits de transmission synaptique. Par exemple, une variante mutante de TDP43 améliore la fréquence de tir et diminue le seuil de potentiel d’action dans les cellules de type moteur-neurone NSC-34 (moelle épinière x neuroblastome hybride lignée 34)21. Cette même variante provoque également une transmission synaptique dysfonctionnelle à la jonction neuromusculaire (NMJ) avant l’apparition de déficits moteurs comportementaux chez un modèle murin22. Il a déjà été démontré que l’expression mutante de FUS entraîne une réduction de la transmission synaptique au NMJ dans un modèle de drosophile de FUS-ALS avant les défauts locomoteurs11. Un rapport récent utilisant des cellules souches pluripotentes induites dérivées de porteurs d’expansion C9orf72 a révélé une réduction du pool facilement libérable de vésicules synaptiques23. Dans l’ensemble, ces études et d’autres soulignent l’importance d’acquérir une compréhension plus complète des mécanismes sous-jacents à la signalisation synaptique dans les modèles de SLA pertinents pour la maladie. Cela sera essentiel pour comprendre la pathobiologie de la SLA et développer des cibles thérapeutiques potentielles pour les patients.
Les méthodes de serrage du courant et de la tension ont été inestimables pour déterminer les propriétés de la membrane telles que la conductance, le potentiel de la membrane au repos et le contenu quantifial des synapses individuelles20,24. Cependant, l’une des limites importantes de l’électrophysiologie est qu’elle est techniquement difficile et ne fournit des informations qu’à partir d’un seul neurone à la fois. La microscopie confocale à cellules vivantes, associée à des sondes fluorescentes spécifiques, offre la possibilité d’étudier la transmission synaptique des neurones de manière spatio-temporelle25,26,27. Bien qu’il ne s’agisse pas d’une mesure directe de l’excitabilité neuronale, cette approche de fluorescence peut fournir une mesure relative de deux corrélations moléculaires de la fonction synaptique: la libération de vésicules synaptiques et les transitoires calciques aux terminaux synaptiques.
Lorsqu’un potentiel d’action atteint la région terminale présynaptique des neurones, des transitoires calciques sont déclenchés, facilitant la transition d’un signal électrique au processus de libération de neurotransmetteurs28. Les canaux calciques voltage-dépendants localisés dans ces zones régulent étroitement la signalisation du calcium pour moduler la cinétique de libération de neurotransmetteurs29. Les premiers enregistrements basés sur la fluorescence des transitoires de calcium ont été effectués à l’aide de l’indicateur à double longueur d’onde Fura-2 AM ou du colorant à longueur d’onde unique Fluo-3 AM30,31,32. Bien que ces colorants aient offert de nouvelles perspectives à l’époque, ils souffrent de plusieurs limitations telles que le compartimentage non spécifique au sein des cellules, la perte de colorant actif ou passif des cellules marquées, le photoblanchiment et la toxicité s’ils sont imagés sur de longues périodes de temps33. Au cours de la dernière décennie, les indicateurs de calcium génétiquement codés sont devenus les chevaux de bataille pour l’imagerie de diverses formes d’activité neuronale. Ces indicateurs combinent une protéine fluorescente modifiée avec une protéine chélateur de calcium qui change rapidement d’intensité de fluorescence après la liaison des ions Ca2+34. L’application de ces nouveaux indicateurs est vaste, permettant une visualisation beaucoup plus facile des transitoires de calcium intracellulaires à la fois in vitro et in vivo. Une famille de ces rapporteurs génétiquement codés, connue sous le nom de GCaMP, est maintenant largement utilisée. Ces indicateurs contiennent un domaine de calmoduline C-terminal, suivi d’une protéine fluorescente verte (GFP), et sont coiffés d’une région de liaison à la calmoduline N-terminale35,36. La liaison du calcium au domaine de la calmoduline déclenche une interaction avec la région de liaison à la calmoduline, entraînant un changement conformationnel de la structure protéique globale et une augmentation substantielle de la fluorescence de la fraction GFP35,36. Au fil des ans, cette famille de rapporteurs a subi plusieurs évolutions pour permettre des lectures distinctes pour des transitoires de calcium particuliers avec une cinétique spécifique (lente, moyenne et rapide), chacune avec des propriétés légèrement différentes37,38. Ici, l’utilisation du rapporteur GcaMP6 a été mise en évidence, qui a déjà été montré pour détecter les potentiels d’action unique et les transitoires de calcium dendritique dans les neurones à la fois in vivo et di vitro37.
Les transitoires calciques dans la région présynaptique déclenchent des événements de fusion des vésicules synaptiques, provoquant la libération de neurotransmetteurs dans la synapse et l’initiation d’événements de signalisation dans la cellule postsynaptique28,39. Les vésicules synaptiques sont à la fois rapidement libérées et recyclées, car la cellule maintient homéostatiquement une surface de membrane cellulaire stable et un pool facilement libérable de vésicules membranaires capables de fusion40. Le colorant styryl utilisé ici a une affinité pour les membranes lipidiques et modifie spécifiquement ses propriétés d’émission en fonction de l’ordre de l’environnement lipidique environnant41,42. C’est donc un outil idéal pour marquer les vésicules synaptiques de recyclage et le suivi ultérieur de ces vésicules telles qu’elles sont libérées plus tard après une stimulation neuronale41,42. Le protocole qui a été généré et optimisé est une adaptation des concepts décrits initialement par Gaffield et ses collègues, ce qui nous permet de visualiser en continu les puncta de vésicules synaptiques marquées par un colorant styryl au fil du temps41.
Ici, deux méthodologies connexes basées sur la fluorescence sont décrites, rapportant de manière fiable des événements cellulaires spécifiques impliqués dans la transmission synaptique. Des protocoles ont été définis pour sonder la dynamique de l’afflux de calcium terminal présynaptique médié par la dépolarisation et de l’exocytose des vésicules synaptiques dans les neurones en culture. Ici, les méthodes et les résultats représentatifs sont axés sur l’utilisation de corticaux ou de motoneurones primaires de rongeurs comme système de modèle in vitro, car il existe des études publiées utilisant ces types de cellules43,44. Cependant, ces méthodes sont également applicables aux neurones corticaux i3 humains différenciés45, car nous avons également eu du succès avec les deux protocoles dans l’expérimentation actuellement en cours dans notre laboratoire. Le protocole général est décrit dans un format linéaire par étapes, illustré à la figure 1. En bref, pour étudier la dynamique du calcium dans les neurites, les neurones matures sont transfectés avec de l’ADN plasmidique pour exprimer le rapporteur fluorescent GCaMP6m sous un promoteur de cytomégalovirus (CMV)37,46. Les cellules transfectées ont un faible niveau de fluorescence vert basal, ce qui augmente en présence de calcium. Les régions d’intérêt sont spécifiées pour surveiller les changements de fluorescence tout au long de notre manipulation. Cela permet de mesurer des fluctuations de calcium très localisées dans l’espace et dans le temps37,46. Pour évaluer la fusion et la libération des vésicules synaptiques, les neurones matures sont chargés de colorant styryl incorporé dans les membranes des vésicules synaptiques au fur et à mesure qu’ils sont recyclés, reformés et rechargés en neurotransmetteurs dans les cellules présynaptiques41,42,43,47,48. Les colorants actuels utilisés à cette fin marquent les vésicules synaptiques le long des neurites et sont utilisés comme proxy pour ces régions dans des expériences d’imagerie en direct, comme l’ont montré la co-coloration du colorant styryl et de la synaptotagmine par Kraszewski et ses collègues49. Sont incluses ici des images représentatives de taches similaires qui ont également été effectuées (Figure 2A). Des chercheurs antérieurs ont largement utilisé ces colorants pour rapporter la dynamique des vésicules synaptiques à la jonction neuromusculaire et aux neurones de l’hippocampe48,49,50,51,52,53,54,55,56 . En sélectionnant les régions ponctuées des vésicules chargées de colorant et en surveillant les diminutions de l’intensité de fluorescence après la libération des vésicules, la capacité de transmission synaptique fonctionnelle et la dynamique temporelle de libération peuvent être étudiées après stimulation43. Pour les deux méthodes, un milieu contenant une forte concentration de chlorure de potassium est utilisé pour dépolariser les cellules afin d’imiter l’activité neuronale. Les paramètres d’imagerie sont spécifiés pour capturer des intervalles inférieurs à la seconde couvrant une normalisation de base suivie de notre période de capture de stimulation. Les mesures de fluorescence à chaque point temporel sont déterminées, normalisées à l’arrière-plan et quantifiées au cours de la période expérimentale. L’augmentation de la fluorescence GCaMP6m médiée par l’afflux de calcium ou la diminution efficace de l’exocytose de la vésicule synaptique par la libération de colorant styryl peut être détectée grâce à cette stratégie. La configuration méthodologique détaillée et les paramètres de ces deux protocoles ainsi qu’une discussion sur leurs avantages et leurs limites sont décrits ci-dessous.
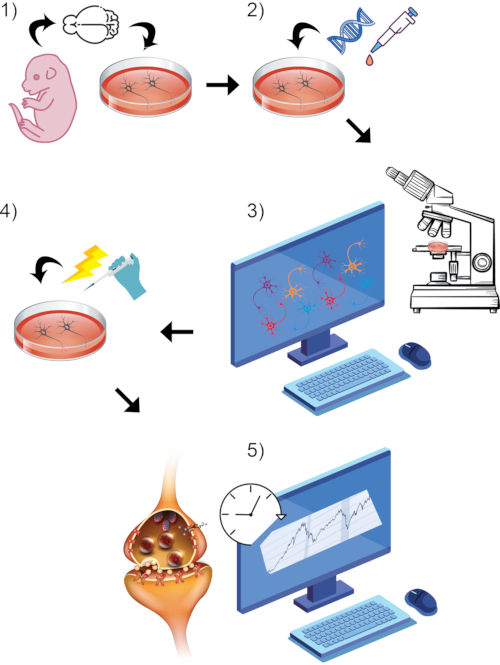
Figure 1 : Rendu visuel de l’ensemble du processus général du protocole. (1) Isoler et cultiver les neurones primaires des rongeurs in vitro jusqu’au point de temps de maturation choisi. (2) Introduire l’ADN GCaMP ou le colorant styryl comme rapporteurs de l’activité synaptique. (3) Configurer le paradigme de l’imagerie à l’aide d’un microscope confocal équipé d’imagerie en direct et du logiciel associé. Commencez la période d’enregistrement de référence. (4) Pendant que les cellules subissent encore une capture d’images en direct, stimulez les neurones via une perfusion de bain KCl élevée. (5) Évaluer les mesures d’intensité de fluorescence au fil du temps pour mesurer les transitoires calciques ou la fusion des vésicules synaptiques. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocol
Representative Results
Discussion
Trois étapes communes aux deux méthodes décrites sont d’une importance cruciale pour le succès expérimental et les résultats quantifiables. Tout d’abord, la préparation d’un CSF frais avant chaque série d’expériences est essentielle, en suivant les instructions ci-jointes. Ne pas le faire peut empêcher une dépolarisation neuronale appropriée. Un échantillon de neurones témoins non traités doit être constamment testé avant la stimulation de tout groupe expérimental afin d’assurer une dépolaris…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Nous tenons à remercier les membres actuels et anciens du Jefferson Weinberg ALS Center pour leurs commentaires critiques et leurs suggestions visant à optimiser ces techniques et leurs analyses. Ce travail a été soutenu par le financement des NIH (RF1-AG057882-01 et R21-NS0103118 à D.T.), du NINDS (R56-NS092572 et R01-NS109150 à P.P.), de la Muscular Dystrophy Association (D.T.), du Robert Packard Center for ALS Research (D.T.), de la Family Strong 4 ALS Foundation et de la Farber Family Foundation (B.K.J., K.K. et P.P).
Materials
| 20x air objective | Nikon | For imaging | |
| 40x oil immersion objective | Nikon | For imaging | |
| B27 supplement | Thermo Scientific | 17504044 | Neuronal growth supplement |
| BD Syringes without Needle, 50 mL | Thermo Scientific | 13-689-8 | Part of gravity perfusion assembly |
| Biosafety cell culture hood | Baker | SterilGARD III SG403A | Asceptic cell culturing, transfection, and dye loading |
| b-Mercaptoethanol | Millipore Sigma | M3148 | For culturing and maintenance of neuronal cultures |
| Bovine Serum Albumin | Millipore Sigma | A9418 | For preparing neuronal cultures |
| Calcium chloride dihydrate | Millipore Sigma | 223506 | Component of aCSF solutions |
| Cell culture CO2 incubator | Thermo Scientific | 13-998-123 | For culturing and maintenance of neurons |
| Centrifuge | Eppendorf | 5810R | For neuronal culture preparation |
| Confocal microscope | Nikon | Eclipse Ti +A1R core | For fluorescence imaging |
| CoolSNAP ES2 CCD camera | Photometrics | For image acquisition | |
| D-Glucose | Millipore Sigma | G8270 | Component of aCSF solutions |
| DNase | Millipore Sigma | D5025 | For neuronal culture preparation |
| Female, timed-pregnancy Sprague Dawley rats | Charles river | 400SASSD | For preparing embryonic cortical and spinal motor neuron cultures |
| FITC Filter cube | Nikon | 77032509 | For imaging Gcamp calcium transients |
| FM4-64 styryl dye | Invitrogen | T13320 | For imaging synaptic vesicle release |
| Glass bottom petri dishes (Thickness #1.5) | CellVis | D35-10-1.5-N | For growth of neurons on imaging-compatible culture dish |
| Glass Pasteur pipette | Grainger | 52NK56 | For preparing neuronal cultures |
| Hank's Balanced Salt Solution (HBSS) | Millipore Sigma | H6648 | For preparing neuronal cultures |
| HEPES | Millipore Sigma | H3375 | Component of aCSF solutions |
| High KCl artifical cerebrospinal fluid (aCSF) | For imaging. Please see recipes* | ||
| horse serum | Millipore Sigma | H1138 | For culturing and maintenance of neurons |
| Laminar flow dissection hood | NUAIRE | NU-301-630 | For preparing neuronal cultures |
| Laminin | Thermo Scientific | 23017015 | For preparing neuronal cultures |
| Leibovitz's L-15 Medium | Thermo Scientific | 11415064 | For preparing neuronal cultures |
| Leibovitz's L-15 Medium, no phenol red | Thermo Scientific | 21083027 | For preparing neuronal cultures |
| L-Glutamine (200 mM) | Thermo Scientific | 25030149 | Neuronal culture supplement |
| Lipofectamine 2000 Transfection Reagent | Thermo Scientific | 11668019 | For neuronal transfections |
| Low KCl artifical cerebrospinal fluid (aCSF) | For imaging. Please see recipes* | ||
| Magnesium chloride | Millipore Sigma | 208337 | Component of aCSF solutions |
| Microsoft Excel | Microsoft | Software for data analysis/normalization | |
| Nalgene Filter Units, 0.2 µm PES | Thermo Scientific | 565-0020 | Filter unit for aCSF solution |
| Neurobasal medium | Thermo Scientific | 21103049 | For culturing and maintenance of neuronal cultures |
| NIS-Elements Advanced Research | Nikon | Software for image capture and analysis | |
| Nunc 15 mL Conical tubes | Thermo Scientific | 339650 | For preparing neuronal culture and buffer solutions |
| Nunc 50 mL conical tubes | Thermo Scientific | 339652 | For preparing neuronal culture and buffer solutions |
| Optiprep | Millipore Sigma | D1556 | For preparing neuronal cultures |
| Papain | Millipore Sigma | P4762 | For preparing neuronal cultures |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Scientific | 15140122 | To prevent bacterial contamination of neuronal cultures |
| Perfusion system | Warner Instruments | SF-77B | For exchange of aCSF |
| Perfusion tubing | Cole-Parmer | UX-30526-14 | Part of gravity perfusion assembly |
| pGP-CMV-Gcamp6m plasmid | Addgene | 40754 | For imaging calcium transients |
| Poly-D-lysine hydrobromide | Millipore Sigma | P7886 | Coating agent for glass bottom petri dishes |
| Potassium chloride | Millipore Sigma | P3911 | Component of aCSF solutions |
| Sodium bicarbonate | Millipore Sigma | S5761 | Component of aCSF solutions |
| Sodium Chloride | Millipore Sigma | S9888 | Component of aCSF solutions |
| Stage Top Incubator | Tokai Hit | For incubation of live neurons during imaging period | |
| TRITC Filter cube | Nikon | 77032809 | For imaging FM4-64 |
| Trypsin Inhibitor | Millipore Sigma | T6414 | For preparing neuronal cultures |
| Trypsin-EDTA (0.25%), phenol red | Thermo Scientific | 25200056 | For preparing neuronal cultures |
| Vibration Isolation table | New Port | VIP320X2430-135520 | Table/stand for microscope |
Riferimenti
- Gibson, S. B., et al. The evolving genetic risk for sporadic ALS. Neurology. 89 (3), 226-233 (2017).
- Kim, G., Gautier, O., Tassoni-Tsuchida, E., Ma, X. R., Gitler, A. D. ALS genetics: Gains, losses, and implications for future therapies. Neuron. 108 (5), 822-842 (2020).
- Nijssen, J., Comley, L. H., Hedlund, E. Motor neuron vulnerability and resistance in amyotrophic lateral sclerosis. Acta Neuropathologica. 133 (6), 863-885 (2017).
- Marttinen, M., Kurkinen, K. M., Soininen, H., Haapasalo, A., Hiltunen, M. Synaptic dysfunction and septin protein family members in neurodegenerative diseases. Molecular Neurodegeneration. 10, 16 (2015).
- Bae, J. S., Simon, N. G., Menon, P., Vucic, S., Kiernan, M. C. The puzzling case of hyperexcitability in amyotrophic lateral sclerosis. Journal of Clinical Neurology. 9 (2), 65-74 (2013).
- Kiernan, M. C. Hyperexcitability, persistent Na+ conductances and neurodegeneration in amyotrophic lateral sclerosis. Experimental Neurology. 218 (1), 1-4 (2009).
- Krarup, C. Lower motor neuron involvement examined by quantitative electromyography in amyotrophic lateral sclerosis. Clinical Neurophysiology. 122 (2), 414-422 (2011).
- Vucic, S., Nicholson, G. A., Kiernan, M. C. Cortical hyperexcitability may precede the onset of familial amyotrophic lateral sclerosis. Brain. 131, 1540-1550 (2008).
- Marchand-Pauvert, V., et al. Absence of hyperexcitability of spinal motoneurons in patients with amyotrophic lateral sclerosis. Journal of Physiology. 597 (22), 5445-5467 (2019).
- Fischer, L. R., et al. Amyotrophic lateral sclerosis is a distal axonopathy: evidence in mice and man. Experimental Neurology. 185 (2), 232-240 (2004).
- Markert, S. M., et al. Overexpression of an ALS-associated FUS mutation in C. elegans disrupts NMJ morphology and leads to defective neuromuscular transmission. Biology Open. 9 (12), (2020).
- Shahidullah, M., et al. Defects in synapse structure and function precede motor neuron degeneration in Drosophila models of FUS-related ALS. Journal of Neuroscience. 33 (50), 19590-19598 (2013).
- Liu, Y., et al. C9orf72 BAC Mouse Model with Motor Deficits and Neurodegenerative Features of ALS/FTD. Neuron. 90 (3), 521-534 (2016).
- Freibaum, B. D., et al. GGGGCC repeat expansion in C9orf72 compromises nucleocytoplasmic transport. Nature. 525 (7567), 129-133 (2015).
- Zhang, K., et al. The C9orf72 repeat expansion disrupts nucleocytoplasmic transport. Nature. 525 (7567), 56-61 (2015).
- Perry, S., Han, Y., Das, A., Dickman, D. Homeostatic plasticity can be induced and expressed to restore synaptic strength at neuromuscular junctions undergoing ALS-related degeneration. Human Molecular Genetics. 26 (21), 4153-4167 (2017).
- Romano, G., et al. Chronological requirements of TDP-43 function in synaptic organization and locomotive control. Neurobiology of Disease. 71, 95-109 (2014).
- Armstrong, G. A., Drapeau, P. Calcium channel agonists protect against neuromuscular dysfunction in a genetic model of TDP-43 mutation in ALS. Journal of Neuroscience. 33 (4), 1741-1752 (2013).
- Diaper, D. C., et al. Loss and gain of Drosophila TDP-43 impair synaptic efficacy and motor control leading to age-related neurodegeneration by loss-of-function phenotypes. Human Molecular Genetics. 22 (8), 1539-1557 (2013).
- Schwiening, C. J. A brief historical perspective: Hodgkin and Huxley. Journal of Physiology. 590 (11), 2571-2575 (2012).
- Dong, H., et al. Curcumin abolishes mutant TDP-43 induced excitability in a motoneuron-like cellular model of ALS. Neuroscienze. 272, 141-153 (2014).
- Chand, K. K., et al. Defects in synaptic transmission at the neuromuscular junction precede motor deficits in a TDP-43(Q331K) transgenic mouse model of amyotrophic lateral sclerosis. Federation of American Societies for Experimental Biology Journal. 32 (5), 2676-2689 (2018).
- Perkins, E. M., et al. Altered network properties in C9ORF72 repeat expansion cortical neurons are due to synaptic dysfunction. Molecular Neurodegeneration. 16 (1), 13 (2021).
- Ceccarelli, B., Hurlbut, W. P. Vesicle hypothesis of the release of quanta of acetylcholine. Physiological Reviews. 60 (2), 396-441 (1980).
- Ettinger, A., Wittmann, T. Fluorescence live cell imaging. Methods in Cell Biology. 123, 77-94 (2014).
- Ryan, J., Gerhold, A. R., Boudreau, V., Smith, L., Maddox, P. S. Introduction to Modern Methods in Light Microscopy. Methods in Molecular Biology. 1563, 1-15 (2017).
- Wang, L., Frei, M. S., Salim, A., Johnsson, K. Small-molecule fluorescent probes for live-cell super-resolution microscopy. Journal of the American Chemical Society. 141 (7), 2770-2781 (2019).
- Neher, E. Vesicle pools and Ca2+ microdomains: new tools for understanding their roles in neurotransmitter release. Neuron. 20 (3), 389-399 (1998).
- Dolphin, A. C., Lee, A. Presynaptic calcium channels: specialized control of synaptic neurotransmitter release. Nature Reviews Neuroscience. 21 (4), 213-229 (2020).
- Tsien, R. Y., Rink, T. J., Poenie, M. Measurement of cytosolic free Ca2+ in individual small cells using fluorescence microscopy with dual excitation wavelengths. Cell Calcium. 6 (1-2), 145-157 (1985).
- Takahashi, N., et al. Cytosolic Ca2+ dynamics in hamster ascending thin limb of Henle’s loop. American Journal of Physiology. 268 (6), 1148-1153 (1995).
- Cleemann, L., DiMassa, G., Morad, M. Ca2+ sparks within 200 nm of the sarcolemma of rat ventricular cells: evidence from total internal reflection fluorescence microscopy. Advances in Experimental Medicine and Biology. 430, 57-65 (1997).
- Roe, M. W., Lemasters, J. J., Herman, B. Assessment of Fura-2 for measurements of cytosolic free calcium. Cell Calcium. 11 (2-3), 63-73 (1990).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6 (12), 875-881 (2009).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein. Nature Biotechnology. 19 (2), 137-141 (2001).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Horikawa, K. Recent progress in the development of genetically encoded Ca2+ indicators. Journal of Medical Investigation. 62 (1-2), 24-28 (2015).
- Bohme, M. A., Grasskamp, A. T., Walter, A. M. Regulation of synaptic release-site Ca(2+) channel coupling as a mechanism to control release probability and short-term plasticity. Federation of European Biochemical Society Letters. 592 (21), 3516-3531 (2018).
- Li, Y. C., Kavalali, E. T. Synaptic vesicle-recycling machinery components as potential therapeutic targets. Pharmacological Reviews. 69 (2), 141-160 (2017).
- Gaffield, M. A., Betz, W. J. Imaging synaptic vesicle exocytosis and endocytosis with FM dyes. Nature Protocols. 1 (6), 2916-2921 (2006).
- Verstreken, P., Ohyama, T., Bellen, H. J. FM 1-43 labeling of synaptic vesicle pools at the Drosophila neuromuscular junction. Methods in Molecular Biology. 440, 349-369 (2008).
- Jensen, B. K., et al. Synaptic dysfunction induced by glycine-alanine dipeptides in C9orf72-ALS/FTD is rescued by SV2 replenishment. European Molecular Biology Organization Molecular Medicine. 12 (5), 10722 (2020).
- Kia, A., McAvoy, K., Krishnamurthy, K., Trotti, D., Pasinelli, P. Astrocytes expressing ALS-linked mutant FUS induce motor neuron death through release of tumor necrosis factor-alpha. Glia. 66 (5), 1016-1033 (2018).
- Fernandopulle, M. S., et al. Transcription Factor-Mediated Differentiation of Human iPSCs into Neurons. Current Protocols in Cell Biology. 79 (1), 51 (2018).
- Ye, L., Haroon, M. A., Salinas, A., Paukert, M. Comparison of GCaMP3 and GCaMP6f for studying astrocyte Ca2+ dynamics in the awake mouse brain. Public Library of Science One. 12 (7), 0181113 (2017).
- Angleson, J. K., Betz, W. J. Monitoring secretion in real time: capacitance, amperometry and fluorescence compared. Trends in Neuroscience. 20 (7), 281-287 (1997).
- Ryan, T. A., et al. The kinetics of synaptic vesicle recycling measured at single presynaptic boutons. Neuron. 11 (4), 713-724 (1993).
- Kraszewski, K., et al. Synaptic vesicle dynamics in living cultured hippocampal neurons visualized with CY3-conjugated antibodies directed against the lumenal domain of synaptotagmin. Journal of Neuroscience. 15 (6), 4328-4342 (1995).
- Betz, W. J., Mao, F., Bewick, G. S. Activity-dependent fluorescent staining and destaining of living vertebrate motor nerve terminals. Journal of Neuroscience. 12 (2), 363-375 (1992).
- Betz, W. J., Bewick, G. S. Optical analysis of synaptic vesicle recycling at the frog neuromuscular junction. Science. 255 (5041), 200-203 (1992).
- Ryan, T. A., Smith, S. J. Vesicle pool mobilization during action potential firing at hippocampal synapses. Neuron. 14 (5), 983-989 (1995).
- Betz, W. J., Ridge, R. M., Bewick, G. S. Comparison of FM1-43 staining patterns and electrophysiological measures of transmitter release at the frog neuromuscular junction. Journal of Physiology-Paris. 87 (3), 193-202 (1993).
- Wu, L. G., Betz, W. J. Nerve activity but not intracellular calcium determines the time course of endocytosis at the frog neuromuscular junction. Neuron. 17 (4), 769-779 (1996).
- Ryan, T. A., Smith, S. J., Reuter, H. The timing of synaptic vesicle endocytosis. Proceedings of the National Academy of Sciences of the United States of America. 93 (11), 5567-5571 (1996).
- Ramaswami, M., Krishnan, K. S., Kelly, R. B. Intermediates in synaptic vesicle recycling revealed by optical imaging of Drosophila neuromuscular junctions. Neuron. 13 (2), 363-375 (1994).
- Kayser, M. S., McClelland, A. C., Hughes, E. G., Dalva, M. B. Intracellular and trans-synaptic regulation of glutamatergic synaptogenesis by EphB receptors. Journal of Neuroscience. 26 (47), 12152-12164 (2006).
- Washburn, H. R., Xia, N. L., Zhou, W., Mao, Y. T., Dalva, M. B. Positive surface charge of GluN1 N-terminus mediates the direct interaction with EphB2 and NMDAR mobility. Nature Communications. 11 (1), 570 (2020).
- Magrane, J., Sahawneh, M. A., Przedborski, S., Estevez, A. G., Manfredi, G. Mitochondrial dynamics and bioenergetic dysfunction is associated with synaptic alterations in mutant SOD1 motor neurons. Journal of Neuroscience. 32 (1), 229-242 (2012).
- Casci, I., et al. Muscleblind acts as a modifier of FUS toxicity by modulating stress granule dynamics and SMN localization. Nature Communications. 10 (1), 5583 (2019).
- Hruska, M., Henderson, N., Le Marchand, S. J., Jafri, H., Dalva, M. B. Synaptic nanomodules underlie the organization and plasticity of spine synapses. Nature Neuroscience. 21 (5), 671-682 (2018).
- Rein, M. L., Deussing, J. M. The optogenetic (r)evolution. Molecular Genetics and Genomics. 287 (2), 95-109 (2012).
- Bertucci, C., Koppes, R., Dumont, C., Koppes, A. Neural responses to electrical stimulation in 2D and 3D in vitro environments. Brain Research Bulletin. 152, 265-284 (2019).
- Zhang, Y., et al. jGCaMP8 Fast genetically encoded calcium indicators. Janelia Research Campus. , (2020).
- Guerra-Gomes, S., Sousa, N., Pinto, L., Oliveira, J. F. Functional roles of astrocyte calcium elevations: From synapses to behavior. Frontiers in Cellular Neuroscience. 11, 427 (2017).
- Westergard, T., et al. Cell-to-cell transmission of dipeptide repeat proteins linked to C9orf72-ALS/FTD. Cell Reports. 17 (3), 645-652 (2016).
- Wen, X., et al. Antisense proline-arginine RAN dipeptides linked to C9ORF72-ALS/FTD form toxic nuclear aggregates that initiate in vitro and in vivo neuronal death. Neuron. 84 (6), 1213-1225 (2014).
- Daigle, J. G., et al. Pur-alpha regulates cytoplasmic stress granule dynamics and ameliorates FUS toxicity. Acta Neuropathologica. 131 (4), 605-620 (2016).

