Generere transgener og knockouts i Strongyloides arter ved mikroinjeksjon
Summary
Det funksjonelle genomiske verktøysettet for de parasittiske nematodene Strongyloides stercoralis og Strongyloides ratti inkluderer transgenese, CRISPR/Cas9-mediert mutagenese og RNAi. Denne protokollen vil demonstrere hvordan man bruker intragonadal mikroinjeksjon for å introdusere transgenes og CRISPR-komponenter i S. stercoralis og S. ratti.
Abstract
Slekten Strongyloides består av flere arter av hudgjennomtrengende nematoder med forskjellige vertsområder, inkludert Strongyloides stercoralis og Strongyloides ratti. S. stercoralis er en menneske-parasittisk, hudgjennomtrengende nematode som infiserer ca 610 millioner mennesker, mens rotteparasitten S. ratti er nært beslektet med S. stercoralis og brukes ofte som laboratoriemodell for S. stercoralis. Både S. stercoralis og S. ratti er lett mottagelige for genereringen av transgener og knockouts gjennom den eksogene nukleinsyreleveringsteknikken for intragonadal mikroinjeksjon, og som sådan har dukket opp som modellsystemer for andre parasittiske helminter som ennå ikke er mottagelige for denne teknikken.
Parasittiske Strongyloides voksne bor i tynntarmen til verten og frigjør avkom i miljøet via avføringen. En gang i miljøet utvikler larvene seg til frittlevende voksne, som lever i avføring og produserer avkom som må finne og invadere en ny vert. Denne miljøgenerasjonen er unik for Strongyloides-artene og ligner nok i morfologi til modellen frittlevende nematode Caenorhabditis elegans som teknikker utviklet for C. elegans kan tilpasses for bruk med disse parasittiske nematodene, inkludert intragonadal mikroinjeksjon. Ved hjelp av intragonadal mikroinjeksjon kan et bredt utvalg av transgenes innføres i Strongyloides. CRISPR/Cas9-komponenter kan også mikroinjiseres for å skape mutante Strongyloides larver. Her beskrives teknikken for intragonadal mikroinjeksjon i Strongyloides, inkludert fremstilling av frittlevende voksne, injeksjonsprosedyren og valg av transgen avkom. Bilder av transgene Strongyloides larver laget ved hjelp av CRISPR / Cas9 mutagenesis er inkludert. Målet med denne artikkelen er å gjøre det mulig for andre forskere å bruke mikroinjeksjon for å skape transgene og mutante Strongyloides.
Introduction
Strongyloides stercoralis har lenge blitt oversett som et viktig menneskelig patogen sammenlignet med de mer anerkjente krokormene og rundorm Ascaris lumbricoides1. Tidligere studier av ormbyrde undervurderte ofte utbredelsen av S. stercoralis på grunn av den lave følsomheten til vanlige diagnostiske metoder for S. stercoralis2. De siste årene har epidemiologiske studier basert på forbedrede diagnostiske verktøy anslått at den sanne forekomsten av S. stercoralis-infeksjoner er mye høyere enn tidligere rapportert, omtrent 610 millioner mennesker over hele verden2.
Både S. stercoralis og andre Strongyloides-arter, inkludert den nært beslektede rotteparasitten og den vanlige laboratoriemodellen S. ratti, har en uvanlig livssyklus som er fordelaktig for eksperimentelle genomiske studier fordi den består av både parasittiske og frittlevende (miljømessige) generasjoner3 (figur 1). Spesielt kan både S. stercoralis og S. ratti sykle gjennom en enkelt frittlevende generasjon. Den frittlevende generasjonen består av post-parasittiske larver som utvikler seg til frittlevende voksne menn og kvinner; alle avkom av de frittlevende voksne utvikler seg til smittende larver, som må infisere en vert for å fortsette livssyklusen. Videre kan denne miljømessige eller frittlevende generasjonen eksperimentelt manipuleres i laboratoriet. Fordi frittlevende Strongyloides voksne og C. elegans voksne deler lignende morfologi, kan teknikker som intragonadal mikroinjeksjon som opprinnelig ble utviklet for C. elegans tilpasses for bruk med frittlevende voksen Strongyloides 4,5. Mens DNA generelt introduseres til frittlevende voksne kvinner, kan både menn og kvinner av Strongyloides mikroinjiseres6. Dermed er funksjonelle genomiske verktøy tilgjengelige for å forhøre mange aspekter av Strongyloides biologi. Andre parasittiske nematoder mangler en frittlevende generasjon, og som et resultat er det ikke så lett egnet til funksjonelle genomiske teknikker3.
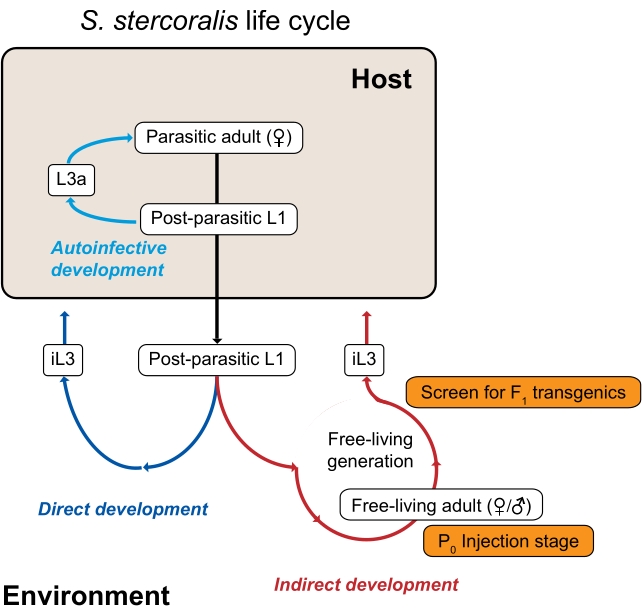
Figur 1: Strongyloides stercoralis livssyklus. S. stercoralis parasittiske kvinner bor i tynntarmen til sine pattedyrverter (mennesker, ikke-menneskelige primater, hunder). De parasittiske hunnene reproduserer ved parthenogenese og legger egg i tynntarmen. Eggene klekkes mens de fortsatt er inne i verten i postparasittiske larver, som deretter overføres inn i miljøet med avføring. Hvis de postparasittiske larver er mannlige, utvikler de seg til frittlevende voksne menn. Hvis de postparasittiske larver er kvinnelige, kan de enten utvikle seg til frittlevende voksne kvinner (indirekte utvikling) eller tredjetrinns infektive larver (iL3s; direkte utvikling). De frittlevende hannene og hunnene reproduserer seksuelt for å skape avkom som er begrenset til å bli iL3s. Under visse forhold kan S. stercoralis også gjennomgå autoinfeksjon, der noen av de postparasittiske larver forblir inne i vertstarmen i stedet for å passere inn i miljøet i avføring. Disse larvene kan utvikle seg til autoinfektive larver (L3a) inne i verten, trenge gjennom tarmveggen, migrere gjennom kroppen og til slutt gå tilbake til tarmen for å bli reproduktive voksne. Livssyklusen til S. ratti er lik, bortsett fra at S. ratti infiserer rotter og ikke har en autoinfective syklus. Miljøgenerasjonen er nøkkelen til å bruke Strongyloides arter til genetiske studier. De frittlevende voksne hunnene (P0) kan mikroinjiseres; deres avkom, som alle vil bli iL3s, er potensielle F1 transgenics. Denne figuren er endret fra Castelletto et al. 3. Klikk her for å se en større versjon av denne figuren.
S. stercoralis deler mange aspekter av sin biologi med andre gastrointestinale menneske-parasittiske nematoder, inkludert vertsinvasjon og vertsimmunmodulering. For eksempel smitter human-parasittiske krokorm i slekten Necator og Ancylostoma også ved hudpenetrasjon, navigerer på samme måte gjennom kroppen, og til slutt bor som parasittiske voksne i tynntarmen7. Dermed bruker mange gastrointestinale nematoder sannsynligvis vanlig sensorisk oppførsel og immununndragelsesteknikker. Som et resultat vil kunnskapen fra Strongyloides utfylle funn i andre mindre genetisk gjennomførbare nematoder og føre til en mer fullstendig forståelse av disse komplekse og viktige parasittene.
Denne mikroinjeksjonsprotokollen skisserer metoden for å introdusere DNA i Strongyloides frittlevende voksne kvinner for å lage transgene og mutante avkom. Belastningsvedlikeholdskravene, inkludert utviklingstid for voksne ormer for mikroinjeksjoner og innsamling av transgent avkom, er beskrevet. Protokoller og en demonstrasjon av den komplette mikroinjeksjonsteknikken, sammen med protokoller for dyrking og screening av transgent avkom, er inkludert, sammen med en liste over alt nødvendig utstyr og forbruksvarer.
Protocol
Representative Results
Discussion
Denne mikroinjeksjonsprotokollen beskriver metodene for innføring av konstruksjoner for transgenese og CRISPR/Cas9-mediert mutagenese i S. stercoralis og S. ratti. For både S. stercoralis og S. ratti er overlevelse etter injeksjon og graden av transgenese eller mutagenese underlagt flere variabler som kan finjusteres.
Det første kritiske hensynet for vellykket transgenese er hvordan plasmidtransgenes er konstruert. Tidligere studier har funnet at uttrykk…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
pPV540 og pPV402 var snille gaver fra Dr. James Lok ved University of Pennsylvania. Vi takker Astra Bryant for nyttige kommentarer til manuskriptet. Dette arbeidet ble finansiert av en Burroughs-Wellcome Fund Investigators in the Pathogenesis of Disease Award, en Howard Hughes Medical Institute Faculty Scholar Award og National Institutes of Health R01 DC017959 (E.A.H.).
Materials
| (−)-Nicotine, ≥99% (GC), liquid | Sigma-Aldrich | N3876-5ML | nicotine for paralyzing worms |
| 3" iron C-clamp, 3" x 2" (capacity x depth) | VWR | 470121-790 | C-clamp to secure setup to bench top |
| Agarose LE | Phenix | RBA-500 | agarose for slides |
| Bone char, 4 lb pail, 10 x 28 mesh | Ebonex | n/a | charcoal for fecal-charcoal cultures |
| Bone char, granules, 10 x 28 mesh | Reade | bonechar10x28 | charcoal for fecal-cultures (alternative to the above) |
| Coarse micromanipulator | Narishige | MMN-1 | coarse micromanipulator |
| Corning Costar Spin-X centrifuge tube filters | Fisher | 07-200-385 | microfilter column |
| Cover glass, 48 x 60 mm, No. 1 thickness | Brain Research Lab | 4860-1 | coverslips (48 x 60 mm) |
| Deep Petri dishes, heavy version with 6 vents, 100 mm diameter | VWR | 82050-918 | 10 cm Petri dishes (for fecal-charcoal cultures) |
| Eisco retort base w/ rod | Fisher | 12-000-101 | stand for Baermann apparatus |
| Eppendorf FemtoJet microinjector microloader tips | VWR | 89009-310 | for filling microinjection needles |
| Fisherbrand absorbent underpads | Fisher | 14-206-62 | bench paper (for prepping) |
| Fisherbrand Cast-Iron Rings | Fisher | 14-050CQ | Baermann o-ring |
| Fisherbrand tri-cornered polypropylene beakers | Fisher | 14-955-111F | Plastic beaker (for mixing) |
| Fisherbrand tri-cornered polypropylene beakers | Fisher | 14-955-111F | Plastic beaker (for catch bucket/water bucket) |
| Fisherbrand tri-cornered polypropylene beakers | Fisher | 14-955-111F | Plastic beaker (x2) (to make holder) |
| Gorilla epoxie in syringe | McMaster-Carr | 7541A51 | glue (to attach tubing) |
| Halocarbon oil 700 | Sigma-Aldrich | H8898-50ML | halocarbon oil |
| High-temperature silicone rubber tubing for food and beverage, 1/2" ID, 5/8" OD | McMaster-Carr | 3038K24 | tubing (for funnel) |
| KIMAX funnels, long stem, 60° Angle, Kimble Chase | VWR | 89001-414 | Baermann funnel |
| Kimberly-Clark Professional Kimtech Science benchtop protectors | Fisher | 15-235-101 | bench paper (for prepping) |
| Leica stereomicroscope with fluorescence | Leica | M165 FC | GFP stereomicroscope for identifying and sorting transgenic worms |
| microINJECTOR brass straight arm needle-holder | Tritech | MINJ-4 | microinjection needle holder |
| microINJECTOR system | Tritech | MINJ-1 | microinjection system |
| Mongolian Gerbils | Charles River Laboratories | 213-Mongolian Gerbil | gerbils for maintenance of S. stercoralis, male 4-6 weeks |
| Nasco Whirl-Pak easy-to-close bags, 18 oz | VWR | 11216-776 | Whirl-Pak sample bags |
| Nylon tulle (mesh) | Jo-Ann Fabrics | zprd_14061949a | nylon mesh for Baermann holder |
| Platinum wire, 36 Gauge, per inch | Thomas Scientific | 1233S72 | platinum/iridium wire for worm picks |
| Puritan tongue depressors, 152 mm (L) x 17.5 mm (W) | VWR | 62505-007 | wood sticks (for mixing samples) |
| QIAprep Spin Miniprep Kit (250) | QIAGEN | 27106 | QIAGEN miniprep kit |
| Rats-Long Evans | Envigo | 140 HsdBlu:LE Long Evans | rats for maintenance of S. ratti, female 4-6 weeks |
| Rats-Sprague Dawley | Envigo | 002 Hsd:Sprague Dawley SD | rats for maintenance of S. ratti, female 4-6 weeks |
| Really Useful Boxes translucent storage boxes with lids, 1.6 L capacity, 7-5/8" x 5-5/16" x 4-5/16" | Office Depot | 452369 | plastic boxes for humidified chamber |
| Shepherd techboard, 8 x 16.5 inches | Newco | 999589 | techboard |
| Stainless steel raised wire floor | Ancare | R20SSRWF | wire cage bottoms |
| StalkMarket compostable cutlery spoons, 6", white, pack of 1,000 | Office Depot | 9587303 | spoons |
| Stender dish, stacking type, 37 x 25 mm | Carolina (Science) | 741012 | watch glasses (small, round) |
| Stereomicroscope | Motic | K-400 LED | dissecting prep scope |
| Storage tote, color clear/white, outside height 4-7/8 in, outside length 13-5/8 in, Sterilite | Grainger | 53GN16 | plastic boxes for humidified chamber |
| Sutter P-30 micropipette puller | Sutter | P-30/P | needle puller with platinum/iridium filament |
| Syracuse watch glasses | Fisher | S34826 | watch glasses (large, round) |
| Thermo Scientific Castaloy fixed-angle clamps | Fisher | 05-769-2Q | funnel clamps (2x) |
| Three-axis hanging joystick oil hydrolic micromanipulator | Narishige | MM0-4 | fine micromanipulator |
| United Mohr pinchcock clamps | Fisher | S99422 | Pinch clamps (2x) |
| Vented, sharp-edge Petri dishes (60 mm diameter) | Tritech Research | T3308P | 6 cm Petri dishes (for small-scale fecal-charcoal cultures) |
| VWR light-duty tissue wipers | VWR | 82003-820 | lining for Baermann holder |
| watch glass, square, 1-5/8 in | Carolina (Science) | 742300 | watch glasses (small, square) |
| Whatman qualitative grade plain circles, grade 1, 5.5 cm diameter | Fisher | 09-805B | filter paper (for 6 cm Petri dishes) |
| Whatman qualitative grade plain circles, grade 1, 9 cm diameter | Fisher | 09-805D | filter paper (for 10 cm Petri dishes) |
| World Precision Instrument borosilicate glass capillary, 1.2 mm x 4 in | Fisher | 50-821-813 | glass capillaries for microinjection needles |
| X-Acto Knives, No. 1 Knife With No. 11 Blade | Office Depot | 238816 | X-Acto knives without blades to hold worm picks |
| Zeiss AxioObserver A1 | Zeiss | n/a | inverted microscope |
Riferimenti
- Krolewiecki, A. J., et al. A public health response against Strongyloides stercoralis: time to look at soil-transmitted helminthiasis in full. PLoS Neglected Tropical Diseases. 7 (5), 2165 (2013).
- Buonfrate, D., et al. The global prevalence of Strongyloides stercoralis infection. Pathogens. 9 (6), 468 (2020).
- Castelletto, M. L., Gang, S. S., Hallem, E. A. Recent advances in functional genomics for parasitic nematodes of mammals. Journal of Experimental Biology. 223, 206482 (2020).
- Evans, T. C., et al. Transformation and microinjection. WormBook. , (2006).
- Lok, J. B., Unnasch, T. R., et al. Transgenesis in animal parasitic nematodes: Strongyloides spp. and Brugia spp. WormBook. , (2013).
- Shao, H. G., Li, X. S., Lok, J. B. Heritable genetic transformation of Strongyloides stercoralis by microinjection of plasmid DNA constructs into the male germline. International Journal for Parasitology. 47 (9), 511-515 (2017).
- Schafer, T. W., Skopic, A. Parasites of the small intestine. Current Gastroenterology Reports. 8 (4), 312-320 (2006).
- Stiernagle, T. Maintenance of C. elegans. The C. elegans Research Community, WormBook. , (2006).
- Gang, S. S., et al. Targeted mutagenesis in a human-parasitic nematode. PLoS Pathogens. 13 (10), 1006675 (2017).
- Lok, J. B. Strongyloides stercoralis: a model for translational research on parasitic nematode biology. The C. elegans Research Community, WormBook. , (2007).
- Hawdon, J. M., Schad, G. A. Long-term storage of hookworm infective larvae in buffered saline solution maintains larval responsiveness to host signals. Proceedings of the Helminthological Society of Washington (USA). 58 (1), 140-142 (1991).
- Bargmann, C. I., Hartwieg, E., Horvitz, H. R. Odorant-selective genes and neurons mediate olfaction in C. elegans. Cell. 74 (3), 515-527 (1993).
- Junio, A. B., et al. Strongyloides stercoralis: cell- and tissue-specific transgene expression and co-transformation with vector constructs incorporating a common multifunctional 3′ UTR. Experimental Parasitology. 118 (2), 253-265 (2008).
- Gang, S. S., et al. Chemosensory mechanisms of host seeking and infectivity in skin-penetrating nematodes. Proceedings of the National Academy of Sciences of the United States of America. 117 (30), 17913-17923 (2020).
- Bryant, A. S., et al. A critical role for thermosensation in host seeking by skin-penetrating nematodes. Current Biology. 28 (14), 2338-2347 (2018).
- Lok, J. B. Nucleic acid transfection and transgenesis in parasitic nematodes. Parasitology. 139 (5), 574-588 (2012).
- Shao, H., et al. Transposon-mediated chromosomal integration of transgenes in the parasitic nematode Strongyloides ratti and establishment of stable transgenic lines. PLoS Pathogens. 8 (8), 1002871 (2012).
- Lok, J. piggyBac: a vehicle for integrative DNA transformation of parasitic nematodes. Mobile Genetic Elements. 3 (2), 24417 (2013).
- Li, X., et al. Successful transgenesis of the parasitic nematode Strongyloides stercoralis requires endogenous non-coding control elements. International Journal for Parasitology. 36 (6), 671-679 (2006).
- Bryant, A. S., Hallem, E. A. The Wild Worm Codon Adapter: a web tool for automated codon adaptation of transgenes for expression in non-Caenorhabditis nematodes. G3. 3 (7), (2021).
- Crane, M., et al. In vivo measurements reveal a single 5′-intron is sufficient to increase protein expression level in Caenorhabditis elegans. Scientific Reports. 9 (1), 9192 (2019).
- Han, Z., et al. Improving transgenesis efficiency and CRISPR-associated tools through codon optimization and native intron addition in Pristionchus nematodes. Genetica. 216 (4), 947-956 (2020).
- Adams, S., Pathak, P., Shao, H., Lok, J. B., Pires-daSilva, A. Liposome-based transfection enhances RNAi and CRISPR-mediated mutagenesis in non-model nematode systems. Scientific Reports. 9 (1), 483 (2019).
- Dulovic, A., Puller, V., Streit, A. Optimizing culture conditions for free-living stages of the nematode parasite Strongyloides ratti. Experimental Parasitology. 168, 25-30 (2016).
- Harvey, S. C., Gemmill, A. W., Read, A. F., Viney, M. E. The control of morph development in the parasitic nematode Strongyloides ratti. Proceedings of the Royal Society B: Biological Sciences. 267 (1457), 2057-2063 (2000).
- Kim, A., Pyykko, I. Size matters: versatile use of PiggyBac transposons as a genetic manipulation tool. Molecular and Cellular Biochemistry. 354 (1-2), 301-309 (2011).
- Lok, J. B., Shao, H., Massey, H. C., Li, X. Transgenesis in Strongyloides and related parasitic nematodes: historical perspectives, current functional genomic applications and progress towards gene disruption and editing. Parasitology. 144 (3), 327-342 (2017).
- Farboud, B., Meyer, B. J. Dramatic enhancement of genome editing by CRISPR/Cas9 through improved guide RNA design. Genetica. 199 (4), 959-971 (2015).
- Cheong, M. C., et al. Identification of a nuclear receptor/coactivator developmental signaling pathway in the nematode parasite Strongyloides stercoralis. Proceedings of the National Academy of Sciences of the United States of America. 118 (8), 2021864118 (2021).
- Nolan, T. J., Megyeri, Z., Bhopale, V. M., Schad, G. A. Strongyloides stercoralis: the first rodent model for uncomplicated and hyperinfective strongyloidiasis, the Mongolian gerbil (Meriones unguiculatus). Journal of Infectious Diseases. 168 (6), 1479-1484 (1993).
- Li, X., et al. Transgenesis in the parasitic nematode Strongyloides ratti. Molecular and Biochemical Parasitology. 179 (2), 114-119 (2011).
- Viney, M. E. Exploiting the life cycle of Strongyloides ratti. Parasitology Today. 15 (6), 231-235 (1999).
- Stoltzfus, J. D., Massey, H. C., Nolan, T. J., Griffith, S. D., Lok, J. B. Strongyloides stercoralis age-1: a potential regulator of infective larval development in a parasitic nematode. PLoS ONE. 7 (6), 38587 (2012).
- Castelletto, M. L., Massey, H. C., Lok, J. B. Morphogenesis of Strongyloides stercoralis infective larvae requires the DAF-16 ortholog FKTF-1. PLoS Pathogens. 5 (4), 1000370 (2009).
- Douglas, B., et al. Transgenic expression of a T cell epitope in Strongyloides ratti reveals that helminth-specific CD4+ T cells constitute both Th2 and Treg populations. PLoS Pathogens. 17 (7), 1009709 (2021).

