Raccolta, espansione e differenziazione di modelli primari di cellule epiteliali nasali umane per la quantificazione della frequenza del battito delle ciglia
Summary
Questo protocollo descrive la raccolta, l’espansione e la differenziazione delle cellule epiteliali nasali in modelli organotipici di cellule epiteliali delle vie aeree e la quantificazione della frequenza del battito delle ciglia tramite imaging di cellule vive e script personalizzati.
Abstract
Le misurazioni della funzione delle ciglia (frequenza del battito, pattern) sono state stabilite come strumenti diagnostici per le malattie respiratorie come la discinesia ciliare primaria. Tuttavia, l’applicazione più ampia di queste tecniche è limitata dall’estrema suscettibilità della funzione ciliare ai cambiamenti dei fattori ambientali, ad esempio temperatura, umidità e pH. Nelle vie aeree dei pazienti con fibrosi cistica (FC), l’accumulo di muco impedisce il battito delle ciglia. La funzione delle ciglia è stata studiata in modelli cellulari primari delle vie aeree come indicatore dell’attività del canale CFTR (Transmembrane Conductance Regulator). Tuttavia, una notevole variabilità da paziente a paziente nella frequenza di battitura delle ciglia è stata riscontrata in risposta ai farmaci modulanti CFTR, anche per i pazienti con le stesse mutazioni CFTR . Inoltre, l’impatto della secrezione disfunzionale di cloruro regolata da CFTR sulla funzione ciliare è poco compreso. Attualmente non esiste un protocollo completo che dimostri la preparazione del campione di modelli in vitro delle vie aeree, l’acquisizione di immagini e l’analisi della frequenza del battito delle ciglia (CBF). Le condizioni di coltura standardizzate e l’acquisizione di immagini eseguite in una condizione controllata dal punto di vista ambientale consentirebbero una quantificazione coerente e riproducibile del CBF tra individui e in risposta ai farmaci modulanti CFTR. Questo protocollo descrive la quantificazione del CBF in tre diversi sistemi modello di cellule epiteliali delle vie aeree: 1) fogli epiteliali nativi, 2) modelli di interfaccia aria-liquido ripresi su inserti di supporto permeabili e 3) organoidi tridimensionali incorporati in matrice extracellulare. Questi ultimi due replicano la fisiologia polmonare in vivo , con ciglia battenti e produzione di muco. La funzione ciliare viene catturata utilizzando una videocamera ad alta velocità in una camera controllata dall’ambiente. Per l’analisi di CBF vengono utilizzati script personalizzati. La traduzione delle misurazioni CBF in clinica è considerata un importante strumento clinico per prevedere la risposta ai farmaci modulanti CFTR su base paziente.
Introduction
Le misurazioni della frequenza e del pattern del battito delle ciglia (CBF) sono state stabilite come strumenti diagnostici per malattie respiratorie come la discinesia ciliare primaria (PCD)1. Nella fibrosi cistica (FC), la disfunzione del canale del cloruro CFTR (Transmembrane Conductance Regulator) CFTR causa disidratazione del liquido superficiale delle vie aeree e compromissione della clearance mucociliare2. La funzione ciliare è stata studiata in vitro in modelli cellulari primari delle vie aeree come indicatore dell’attività del canale CFTR3. Tuttavia, esiste una notevole variabilità da paziente a paziente nel CBF in risposta ai farmaci modulanti CFTR, anche per i pazienti con le stesse mutazioni CFTR 3. Inoltre, l’impatto della secrezione disfunzionale di cloruro regolata da CFTR sulla funzione ciliare è poco compreso. Attualmente non esiste un protocollo completo che dimostri la preparazione del campione di modelli in vitro delle vie aeree, l’acquisizione di immagini e l’analisi del CBF.
I fogli epiteliali nasali isolati dalle spazzolature della mucosa nasale sono utilizzati direttamente per le misurazioni della funzione ciliare per la diagnosi di PCD4. Tuttavia, mentre non vi è alcun controllo sulle dimensioni o sulla qualità dei fogli epiteliali nasali ottenuti, il CBF varia a seconda che venga misurato su singole cellule o fogli cellulari e su bordi ciliati del foglio epiteliale che sono interrotti o ininterrotti5. Pertanto, le discinesie secondarie causate da danni alle cellule durante la raccolta delle spazzolature della mucosa nasale possono influenzare il CBF. La coltura cellulare primaria di cellule epiteliali nasali e la loro differenziazione all’interfaccia aria-liquido (ALI) o nella matrice tridimensionale della membrana basale in organoidi epiteliali delle vie aeree ciliate danno origine a ciglia esenti da discinesie secondarie 4,6,7,8. Le cellule epiteliali delle vie aeree differenziate all’ALI (d’ora in poi denominate modelli ALI) sono state considerate un importante aiuto diagnostico secondario che replica i pattern del battito ciliare e la frequenza delle spazzolature ex vivo della mucosa nasale6 e consente l’analisi dell’ultrastruttura ciliare, del pattern del battito e della frequenza del battito mantenendo i difetti specifici del paziente9 . Tuttavia, esistono discrepanze nelle metodologie utilizzate per creare questi modelli cellulari differenziati pseudostratificati e mucociliari. Diversi protocolli di espansione o differenziazione della coltura potrebbero indurre fenotipi epiteliali distinti (ciliati o secretori)10 e determinare differenze significative nel CBF11. La CBF è stata quantificata in spazzolature epiteliali nasali 4,6,12,13,14,15,16, organoidi epiteliali delle vie aeree 14,17,18 e modelli ALI 3,4,6,13,19,20, 21. Tuttavia, tra questi protocolli, ci sono grandi variabilità e spesso molti parametri non sono controllati. Ad esempio, in alcuni studi, il CBF viene ripreso in situ mentre le cellule del modello ALI rimangono sull’inserto di supporto permeabile 3,19,20,21, altre ancora raschiano le cellule dall’inserto di supporto permeabile e le visualizzano sospese nei media 4,6,13.
Inoltre, la più ampia applicazione di tecniche che misurano la funzione ciliare è limitata dall’estrema suscettibilità della funzione ciliare ai cambiamenti dei fattori ambientali. Fattori ambientali come la temperatura22, l’umidità 23,24 e il pH 25,26 influenzano la funzione ciliare e devono essere regolati per quantificare accuratamente il CBF. I vari parametri fisiologici utilizzati in diversi laboratori e il modo in cui influenzano il CBF sono stati rivisti in precedenza27.
In letteratura sono riportate varie tecnologie di imaging e approcci alle misurazioni CBF. Per la diagnostica PCD, la microscopia video viene utilizzata per misurare la funzione ciliare28,29. Recentemente, un algoritmo di analisi video basato sulla microscopia dinamica differenziale è stato utilizzato per quantificare sia il CBF che la coordinazione delle ciglianei modelli ALI 3,30 delle cellule epiteliali delle vie aeree. Questo metodo consente la caratterizzazione del battito ciliare nelle cellule epiteliali delle vie aeree in modo rapido e completamente automatizzato, senza la necessità di segmentare o selezionare regioni. Vari metodi per l’imaging e la quantificazione del CBF possono aggiungere alle differenze riportate in CBF in letteratura (Supplementary File 1).
Un protocollo dalla coltura alla quantificazione per semplificare i metodi esistenti, la standardizzazione delle condizioni di coltura e l’acquisizione di immagini, eseguite in rigorose condizioni di controllo ambientale, consentirebbero una quantificazione coerente e riproducibile del CBF all’interno e tra gli individui.
Questo protocollo fornisce una descrizione completa della raccolta di cellule epiteliali, delle condizioni di crescita di espansione e differenziazione e della quantificazione del CBF in tre diversi sistemi modello di cellule epiteliali delle vie aeree di origine nasale: 1) fogli epiteliali nativi, 2) modelli ALI ripresi su inserti di supporto permeabili e 3) organoidi tridimensionali incorporati nella matrice extracellulare (ECM) (Figura 1 ). Le cellule epiteliali nasali ottenute da spazzolature dei turbinati inferiori nasali sono utilizzate come rappresentanti dell’epitelio delle vie aeree poiché sono un surrogato efficace per le cellule epiteliali bronchiali31 superando la procedura invasiva associata alla raccolta di spazzolature bronchiali. Il metodo Conditional Reprogramming Cell (CRC) viene utilizzato per espandere le cellule epiteliali primarie delle vie aeree per la creazione di modelli ALI e organoidi tridimensionali. La riprogrammazione condizionale delle cellule epiteliali delle vie aeree in uno stato simile alle cellule staminali è indotta dalla co-coltura con il sistema cellulare alimentatore di fibroblasti arrestato dalla crescita e l’inibitore della chinasi Rho-associata (ROCK)32. È importante sottolineare che il metodo CRC aumenta il raddoppio della popolazione nelle cellule epiteliali delle vie aeree mantenendo il loro potenziale di differenziazione tessuto-specifico33,34. In tutti i modelli di cellule epiteliali delle vie aeree, la funzione ciliare viene catturata in una camera a temperatura controllata utilizzando una videocamera ad alta velocità con impostazioni di acquisizione delle immagini standardizzate. Per la quantificazione del CBF vengono utilizzati script personalizzati.
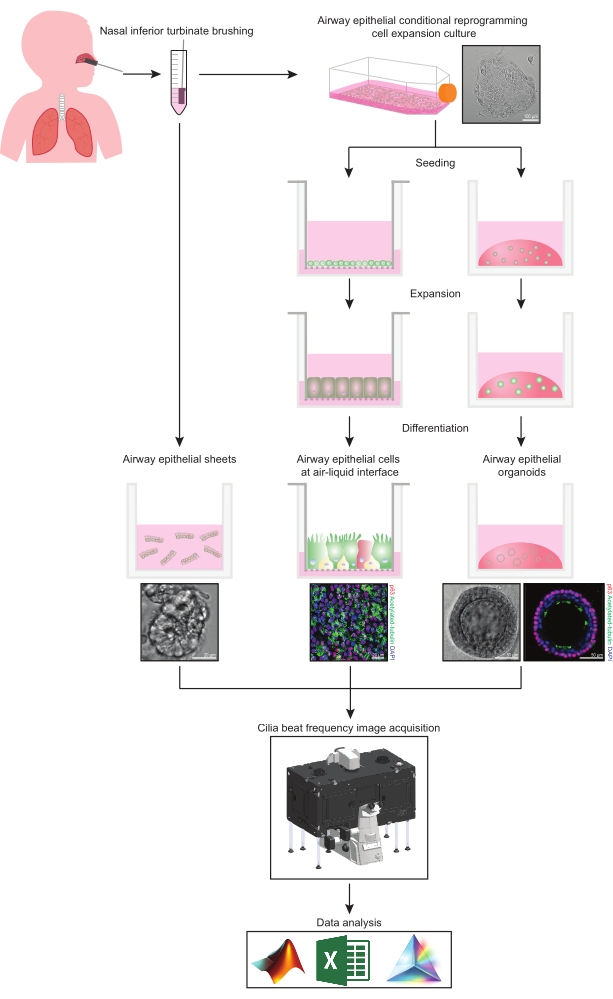
Figura 1: Schema del flusso di lavoro. Dopo aver spazzolato il turbinato inferiore nasale dei partecipanti, le cellule epiteliali delle vie aeree vengono utilizzate in uno dei due modi. I fogli epiteliali delle vie aeree sono isolati e la frequenza del battito delle ciglia viene immediatamente visualizzata, oppure le cellule epiteliali delle vie aeree vengono espanse tramite il metodo della cellula di riprogrammazione condizionale. Le cellule epiteliali delle vie aeree espanse con CRC sono differenziate per stabilire cellule epiteliali delle vie aeree in un’interfaccia aria-liquido o colture organoidi epiteliali delle vie aeree. L’imaging della frequenza del battito ciliare viene acquisito utilizzando un microscopio di imaging a cellule vive con una camera ambientale di riscaldamento e umidità e una fotocamera scientifica ad alta frequenza di fotogrammi (>100Hz). L’analisi dei dati viene eseguita utilizzando script personalizzati. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Protocol
Representative Results
Discussion
Ci sono molteplici fattori che potrebbero oscurare la quantificazione del CBF nei fogli epiteliali nasali. I fogli epiteliali devono essere visualizzati entro 3-9 ore dalla raccolta del campione poiché la funzione ciliare è più stabile durante questo periodo37. Meno globuli rossi e detriti sono più ottimali per l’imaging poiché interferiscono con l’acquisizione dei dati. Quando si seleziona un ROI per l’imaging, è importante selezionare un foglio epiteliale che non sia stato danneggiato o in…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Ringraziamo i partecipanti allo studio e le loro famiglie per i loro contributi. Apprezziamo l’assistenza del dipartimento respiratorio di Randwick del Sydney Children’s Hospitals (SCH) nell’organizzazione e nella raccolta di campioni biologici dei pazienti – un ringraziamento speciale al Dr. John Widger, alla dottoressa Yvonne Belessis, Leanne Plush, Amanda Thompson e Rhonda Bell. Riconosciamo l’assistenza di Iveta Slapetova e Renee Whan della Katharina Gaus Light Microscopy Facility all’interno del Mark Wainwright Analytical Centre presso UNSW Sydney. Questo lavoro è supportato dal National Health and Medical Research Council (NHMRC) Australia (GNT1188987), CF Foundation Australia e Sydney Children’s Hospital Foundation. Gli autori desiderano riconoscere Luminesce Alliance – Innovation for Children’s Health per il suo contributo e supporto. Luminesce Alliance – Innovation for Children’s Health è una joint venture cooperativa senza scopo di lucro tra il Sydney Children’s Hospitals Network, il Children’s Medical Research Institute e il Children’s Cancer Institute. È stato istituito con il supporto del governo del NSW per coordinare e integrare la ricerca pediatrica. Luminesce Alliance è anche affiliata con l’Università di Sydney e l’Università del New South Wales Sydney. KMA è supportata da una borsa di studio del programma di formazione per la ricerca del governo australiano. LKF è sostenuta dal Rotary Club di Sydney Cove/Sydney Children’s Hospital Foundation e dalle borse di studio post-laurea dell’UNSW University.
Materials
| Adenine | Sigma-Aldrich | A2786 | 10 mg/mL |
| Advanced DMEM/F-12 | Thermo Fisher Scientific | 12634-010 | |
| Alanyl-glutamine | Sigma-Aldrich | G8541 | 200 mM |
| Andor Zyla 4.2 sCMOS | Oxford Instruments | Fast frame rate (>100 Hz) scientific camera | |
| Bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Ceftazidime hydrate | Sigma-Aldrich | A6987 | 50 mg/mL |
| Cell Culture Microscope | Olympus | CKX53 | |
| CFI S Plan Fluor ELWD 20XC | Nikon Instruments Inc. | MRH08230 | Long working distance objective lens. NA0.45 WD 8.2-6.9 |
| Cholera toxin | Sigma-Aldrich | C8052-1MG | 200 µg/mL |
| Corning Gel Strainer 40 UM | Sigma-Aldrich | CLS431750 | Pore size 40 μm |
| Corning Matrigel Matrix (Phenol red-free) | Corning | 356231 | Extracellular matrix (ECM) |
| Corning bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Corning CoolCell LX Cell Freezing Container | Sigma-Aldrich | CLS432002 | |
| Corning Transwell polyester membrane cell culture inserts | Sigma-Aldrich | CLS3470 | Permeable support inserts. 6.5 mm Transwell with 0.4 μm pore polyester membrane insert. |
| Countess Cell Counting Chamber Slides | Thermo Fisher Scientific | C10228 | |
| Countess II Automated Cell Counter | ThermoFisher Scientific | AMQAX1000 | Automated cell counter |
| Cytology brushes | McFarlane Medical | 33009 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM-High Glucose | Thermo Fisher Scientific | 11965-092 | |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Eclipse Ti2-E | Nikon | Live-cell imaging microscope. | |
| Fetal Bovine Serum, certified, heat inactivated, United States | Thermo Fisher Scientific | 10082147 | |
| Fungizone (Amphotericin B) | Thermo Fisher Scientific | 15290018 | 250 µg/mL |
| Gentamicin solution | Sigma-Aldrich | G1397 | 50 mg/mL |
| Graphpad Prism | Graphpad | Scientific analysis software | |
| Greiner Cryo.s vials | Sigma-Aldrich | V3135 | Cryogenic vials |
| HEPES solution | Sigma-Aldrich | H0887 | 1 M |
| HI-FBS | Thermo Fisher Scientific | 10082-147 | |
| Hydrocortisone | Sigma-Aldrich | H0888 | 3.6 mg/mL |
| Incubator NL Ti2 BLACK 2000 | PeCon | Microscope environmental chamber. Allows warm air incubation and local CO2 and O2 gassing | |
| Insulin | Sigma-Aldrich | I2643 | 2 mg/mL |
| Lab Armor 74220 706 Waterless Bead Bath 6L | John Morris Group | 74220 706 | Bead bath |
| Lab Armor Beads | Thermo Fisher Scientific | A1254302 | Thermal beads |
| MATLAB | MathWorks | Computing software | |
| Microsoft Excel | Microscoft | Spreadsheet software | |
| NIH/3T3 | American Type Culture Collection | CRL-1658 | Irradiated NIH-3T3 mouse embryonic feeder cells |
| NIS-Elements AR | Nikon Instruments Inc. | Image acquisition software | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | 10,000 units penicillin and 10 mg streptomycin/mL |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| PneumaCult Airway Organoid Kit | StemCell Technologies | 5060 | Airway Organoid Kit |
| PneumaCult-ALI Medium | StemCell Technologies | 5001 | |
| PneumaCult-Ex Plus Medium | StemCell Technologies | 5040 | |
| PureCol-S | Advanced BioMatrix | 5015 | Type I Collagen solution |
| ReagentPack Subculture Reagents | Lonza | CC-5034 | |
| rhEGF (Epidermal Growth Factor, human) | Sigma-Aldrich | E9644 | 25 µg/mL |
| Y-27632 2HCl (ROCK inhibitor) | Selleckchem | S1049 | 10 mM |
| Tobramycin | Sigma-Aldrich | T4014 | 100 mg/mL |
| Trypan blue solution | Sigma-Aldrich | T8154 | 0.4% |
| UNO Stage Top Incubator | Okolab | Microscope incubator. Allows temperature, humidity and CO2 conditioning |
Riferimenti
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. European Respiratory Journal. 34 (6), 1264-1276 (2009).
- Cutting, G. R. Cystic fibrosis genetics: from molecular understanding to clinical application. Nature Reviews Genetics. 16 (1), 45-56 (2015).
- Chioccioli, M., Feriani, L., Kotar, J., Bratcher, P. E., Cicuta, P. Phenotyping ciliary dynamics and coordination in response to CFTR-modulators in Cystic Fibrosis respiratory epithelial cells. Nature Communications. 10 (1), 1763 (2019).
- Hirst, R. A., Rutman, A., Williams, G., O’Callaghan, C. Ciliated air-liquid cultures as an aid to diagnostic testing of primary ciliary dyskinesia. Chest. 138 (6), 1441-1447 (2010).
- Thomas, B., Rutman, A., O’Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Coles, J. L., et al. A revised protocol for culture of airway epithelial cells as a diagnostic tool for primary ciliary dyskinesia. Journal of Clinical Medicine. 9 (11), (2020).
- Pifferi, M., et al. Simplified cell culture method for the diagnosis of atypical primary ciliary dyskinesia. Thorax. 64 (12), 1077-1081 (2009).
- Pifferi, M., et al. Rapid diagnosis of primary ciliary dyskinesia: cell culture and soft computing analysis. European Respiratory Journal. 41 (4), 960-965 (2013).
- Lee, D. D. H., et al. Higher throughput drug screening for rare respiratory diseases: Readthrough therapy in primary ciliary dyskinesia. European Respiratory Journal. 58 (4), 2000455 (2021).
- Saint-Criq, V., et al. Choice of differentiation media significantly impacts cell lineage and response to CFTR modulators in fully differentiated primary cultures of cystic fibrosis human airway epithelial cells. Cells. 9 (9), (2020).
- Awatade, N. T., et al. Significant functional differences in differentiated Conditionally Reprogrammed (CRC)- and Feeder-free Dual SMAD inhibited-expanded human nasal epithelial cells. Journal of Cystic Fibrosis. 20 (2), 364-371 (2021).
- Dabrowski, M., Bukowy-Bieryllo, Z., Jackson, C. L., Zietkiewicz, E. Properties of non-aminoglycoside compounds used to stimulate translational readthrough of PTC mutations in primary ciliary dyskinesia. International Journal of Molecular Sciences. 22 (9), (2021).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PloS One. 9 (2), 89675 (2014).
- Marthin, J. K., Stevens, E. M., Larsen, L. A., Christensen, S. T., Nielsen, K. G. Patient-specific three-dimensional explant spheroids derived from human nasal airway epithelium: a simple methodological approach for ex vivo studies of primary ciliary dyskinesia. Cilia. 6, 3 (2017).
- Chilvers, M. A., O’Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Chilvers, M. A., Rutman, A., O’Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Castillon, N., et al. Polarized expression of cystic fibrosis transmembrane conductance regulator and associated epithelial proteins during the regeneration of human airway surface epithelium in three-dimensional culture. Laboratory Investigation. 82 (8), 989-998 (2002).
- Jorissen, M., Bessems, A. Normal ciliary beat frequency after ciliogenesis in nasal epithelial cells cultured sequentially as monolayer and in suspension. Acta Oto-Laryngologica. 115 (1), 66-70 (1995).
- Conger, B. T., et al. Comparison of cystic fibrosis transmembrane conductance regulator (CFTR) and ciliary beat frequency activation by the CFTR Modulators Genistein, VRT-532, and UCCF-152 in primary sinonasal epithelial cultures. JAMA Otolaryngology-Head & Neck Surgery. 139 (8), 822-827 (2013).
- Pique, N., De Servi, B. Rhinosectan((R)) spray (containing xyloglucan) on the ciliary function of the nasal respiratory epithelium; results of an in vitro study. Allergy, Asthma & Clinical Immunology. 14, 41 (2018).
- Chen, Q., et al. Host antiviral response suppresses ciliogenesis and motile ciliary functions in the nasal epithelium. Frontiers in Cell and Developmental Biology. 8, 581340 (2020).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Ballenger, J. J., Orr, M. F. Quantitative measurement of human ciliary activity. Annals of Otology, Rhinology and Laryngology. 72, 31-39 (1963).
- Mercke, U. The influence of varying air humidity on mucociliary activity. Acta Oto-Laryngologica. 79 (1-2), 133-139 (1975).
- Sutto, Z., Conner, G. E., Salathe, M. Regulation of human airway ciliary beat frequency by intracellular pH. Journal of Physiology. 560, 519-532 (2004).
- Salathe, M. Regulation of mammalian ciliary beating. Annual Review of Physiology. 69, 401-422 (2007).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of ciliary beat pattern in three different beating planes in healthy subjects. Chest. 151 (5), 993-1001 (2017).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Feriani, L., et al. Assessing the collective dynamics of motile cilia in cultures of human airway cells by multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Brewington, J. J., et al. Brushed nasal epithelial cells are a surrogate for bronchial epithelial CFTR studies. JCI Insight. 3 (13), (2018).
- Liu, X., et al. ROCK inhibitor and feeder cells induce the conditional reprogramming of epithelial cells. The American Journal of Pathology. 180 (2), 599-607 (2012).
- Suprynowicz, F. A., et al. Conditionally reprogrammed cells represent a stem-like state of adult epithelial cells. Proceedings of the National Academy of Sciences of the United States of America. 109 (49), 20035-20040 (2012).
- Martinovich, K. M., et al. Conditionally reprogrammed primary airway epithelial cells maintain morphology, lineage and disease specific functional characteristics. Scientific Reports. 7 (1), 17971 (2017).
- Wong, J. Y., Rutman, A., O’Callaghan, C. Recovery of the ciliated epithelium following acute bronchiolitis in infancy. Thorax. 60 (7), 582-587 (2005).
- Gentzsch, M., et al. Pharmacological rescue of conditionally reprogrammed cystic fibrosis bronchial epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 56 (5), 568-574 (2017).
- Sommer, J. U., Gross, S., Hormann, K., Stuck, B. A. Time-dependent changes in nasal ciliary beat frequency. European Archives of Oto-Rhino-Laryngology. 267 (9), 1383-1387 (2010).
- Ratjen, F., et al. Cystic fibrosis. Nature Reviews Disease Primers. 1, 15010 (2015).
- Delmotte, P., Sanderson, M. J. Ciliary beat frequency is maintained at a maximal rate in the small airways of mouse lung slices. American Journal of Respiratory Cell and Molecular Biology. 35 (1), 110-117 (2006).
- Smith, C. M., et al. Cooling of cilia allows functional analysis of the beat pattern for diagnostic testing. Chest. 140 (1), 186-190 (2011).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).

