المقايسات القائمة على التلألؤ الكيميائي للكشف عن أكسيد النيتريك ومشتقاته من الأتمتة ومركبات النيتروجين
Summary
هنا ، نقدم بروتوكولات للكشف عن أكسيد النيتريك ومشتقاته ذات الصلة بيولوجيا باستخدام الفحوصات القائمة على التلألؤ الكيميائي بحساسية عالية.
Abstract
نشاط أكسيد النيتريك (NO) في الجسم الحي هو النتائج المشتركة لآثاره المباشرة ، وعمل مشتقاته الناتجة عن عدم autoxidation ، وتأثيرات المركبات النيتروجينية. يعد قياس مستقلبات NO ضروريا لدراسة نشاط NO على مستوى الأوعية الدموية وفي الأنسجة الأخرى ، خاصة في الإعدادات التجريبية حيث يتم إعطاء NO الخارجي. تسمح اختبارات التلألؤ الكيميائي القائمة على الأوزون بإجراء قياسات دقيقة للمستقلبات NO و NO في كل من السوائل (بما في ذلك البلازما ، ومتجانسات الأنسجة ، ومزارع الخلايا) ومخاليط الغاز (على سبيل المثال ، التنفس الزفير). لا يتفاعل مع الأوزون لتوليد ثاني أكسيد النيتروجين في حالة مثيرة. يسمح انبعاث الضوء الناتج عن ذلك بالكشف الضوئي وتوليد إشارة كهربائية تعكس محتوى NO للعينة. يمكن استخدام Aliquots من نفس العينة لقياس مستقلبات NO محددة ، مثل النترات والنتريت و S-nitrosothiols ومجمعات الحديد والنيتروزيل. بالإضافة إلى ذلك ، لا يستهلك الهيموغلوبين الخالي من الخلايا أيضا كميا مع تحليل التلألؤ الكيميائي. يتم توفير مثال توضيحي لجميع هذه التقنيات.
Introduction
منذ أن حدد سلفادور مونكادا والحائزون على جائزة نوبل روبرت فورشغوت ولويس إغنارو وفريد مراد أكسيد النيتريك (NO) باعتباره عامل الاسترخاء المشتق من البطانية المعروف سابقا (EDRF) ، تم تأسيس الدور المركزي ل NO في العديد من الآليات الرئيسية التي تمتد عبر بيولوجيا الأوعية الدموية وعلوم الأعصاب والتمثيل الغذائي واستجابة المضيف1،2،3،4،5،6،7 . أصبح الإعطاء الخارجي للغاز NO علاجا راسخا لفشل الجهاز التنفسي بسبب ارتفاع ضغط الدم الرئوي في حديثي الولادة8. كما تم التحقيق في غاز أكسيد النيتريك لعلاج عدوى الفيروس المخلوي التنفسي (RSV) ، والملاريا والأمراض المعدية الأخرى ، وإصابة نقص التروية ، وللوقاية من إصابات الكلى الحادة في المرضى الذين يخضعون لجراحة القلب9،10،11،12. تنشأ الحاجة إلى تقنيات قياس دقيقة لتقييم مستويات NO ، ومستقلباتها ، ومستويات البروتينات والمركبات المستهدفة من كل من الدراسات الميكانيكية والتداخلية.
نظرا لتفاعله العالي ، قد يخضع NO لتفاعلات مختلفة اعتمادا على المصفوفة البيولوجية التي يتم إنتاجها و / أو إطلاقها. في حالة عدم وجود الهيموغلوبين (Hb) أو غيرها من أوكسي هيموبروتينات ، يتأكسد NO بالكامل تقريبا إلى النتريت (NO2–).
2NO + O 2 → 2NO2
رقم 2 + لا → N2O3
N 2 O3 + H 2 O → NO2– + H+
لا يخضع NO أولا للأتمتة مع الأكسجين الجزيئي (O 2) لإنتاج ثاني أكسيد النيتروجين (NO 2) ويتفاعل مع NO 2 نفسه لتوليد ثالث أكسيد ثنائي النيتروجين (N2 O3). يتفاعل جزيء واحد من N 2 O3 مع الماء (H 2 O) لتشكيل جزيئين من NO2– وبروتون (H +)13. داخل الدم الكامل14,15 ، NO و NO 2- يتم تحويلها بسرعة إلى نترات (NO 3-) حيث تتفاعل هذه الجزيئات بحماس مع مجموعات الهيم المؤكسدة من Hb [Hb-Fe2+-O2 أو oxyhemoglobin (oxyHb)] لإنتاج NO 3–. يقترن هذا التفاعل بانتقال مجموعة الهيم إلى الحالة الحديدية [Hb-Fe3+ أو methemoglobin (metHb)]:
Hb-Fe2+-O2 + NO → Hb-Fe3+ + NO3–
حاجز خلايا الدم الحمراء (RBC) والمساحة المجاورة مباشرة للبطانة هي العوامل الرئيسية التي تحد من هذا التفاعل وتسمح لجزء صغير من NO الذي تطلقه البطانة بالعمل كEDRF16,17. في الواقع ، من المعروف أن Hb الخالي من الخلايا في الدورة الدموية يعطل توسع الأوعية في الإعدادات التجريبية والسريرية17,18. داخل RBC ، اعتمادا على الأوكسجين وتركيز NO 2 ، يتفاعل جزء من NO مع deoxyhemoglobin (Hb-Fe2+) لتشكيل الحديد والنيتروزيل Hb (Hb-Fe2 + -NO أو HbNO):
Hb-Fe2 + + بدون → Hb-Fe2+-NO
في RBC15,17 ، يمكن أن يشكل NO 2- Hb-Fe 3+ عن طريق تقليل Hb-Fe 2+ مما يؤدي إلى إطلاق NO ، والذي بدوره يربط Hb-Fe 2+-O2 (بشكل تفضيلي) أو Hb-Fe 2+.
لا ينبغي اعتبار توليد المشتقات NO-derivatives أحادي الاتجاه بشكل صارم حيث يمكن تجديد NO من NO2 – و NO3 – في الأنسجة المختلفة وبواسطة إنزيمات مختلفة (على سبيل المثال ، بواسطة البكتيريا المعوية أو داخل الميتوكوندريا ، خاصة في ظل ظروف نقص الأكسجين) 19,20.
تؤدي كمية متغيرة من NO المنتجة (أو المدارة) إلى توليد المصب من S-nitrosothiols ، بشكل رئيسي عن طريق نقل الميثيول من N 2 O3 في وجود نوكليوفيل يخلق وسيطا مانحا NO+ (Nuc-NO+-NO2–):
N 2 O3 + RS – → RS-NO + NO2–
هناك احتمال آخر لتوليد S-nitrosothiols وهو نيتروزيل الثيولات المؤكسدة (لا يتفاعل مع الثيول المؤكسد):
RS• + لا يوجد → RS-NO
قد تكون هذه الآلية وأكسدة الثيول المباشرة بواسطة NO2 ممكنة فقط في ظروف محددة للغاية موصوفة في مكان آخر21. تتراوح S-nitrosothiols من جزيئات الضوء مثل S-nitrosoglutathione إلى البروتينات الكبيرة المحتوية على الثيول. يتكون S-nitrosohemoglobin (S-NO-Hb) من نيتروز مجموعة ثيول من بقايا السيستين المحفوظة في السلسلة β (β93C)22.
يعد توليد واستقلاب S-nitrosothiols جزءا من الآليات التنظيمية المهمة. ومن الأمثلة على ذلك تنظيم الجلوتاثيون ، كاسباز ، N-methyl-D-Aspartate (NMDA) ، ومستقبلات الريانودين23،24،25،26،27،28. كان يعتبر سابقا وسيطا رئيسيا لبيولوجيا NO في الجسم الحي ، ويبدو أن الألبومين النيتروجيني (S-nitroso-albumin) هو ناقل NO / NO+ دون أي نشاط بيولوجي إضافي محدد29.
عند قياس تركيز NO ومشتقاته من عينة بيولوجية محددة داخل مصفوفة بيولوجية ، من المهم مراعاة خصائص مثل الحموضة والأوكسجين ودرجة الحرارة ووجود الكواشف. ومن الأمثلة على ذلك الجهات المانحة الخارجية التي يتم إعطاؤها ، وفي حالة الالتهاب الحاد ، يتفاعل بيروكسيد الهيدروجين (H 2 O 2) مع NO2مما يؤدي إلى توليد تركيز خارق للطبيعة من الجذور الحرة مثل البيروكسينتريت (ONOO–)21. بالإضافة إلى الطريقة التحليلية المستخدمة ، فإن مرحلة ما قبل التحليل لإعداد العينات وتخزينها أمر أساسي. يجب التنبؤ بالتفاعلات النهائية التي لا تمثل أي نشاط في الجسم الحي والنظر فيها وحظرها. ومن الأمثلة الصالحة على ذلك عدم استقرار S-NO-Hb ، مما يتطلب علاجا مخصصا لعينات الدم عندما يتم استهدافها للقياس22.
الفحوصات القائمة على التلألؤ الكيميائي هي المعيار الذهبي للكشف عن مستويات NO ومستقلباته الرئيسية [NO2-، NO3-، S-NO ومجمعات الحديد والنيتروزيل (Fe-NO)] في أي سائل بيولوجي ، بما في ذلك تجانس الأنسجة30,31. تعتمد هذه الطرق على كاشف التلألؤ الكيميائي (CLD) ، وهو جهاز يضم تفاعل NO مع الأوزون (O3) ، مما يولد NO 2 في حالة إثارة (NO2•). يؤدي استرخاء NO2 • إلى انبعاث فوتون من الضوء يتم اكتشافه بواسطة أنبوب مضاعف ضوئي ، مما يولد إشارة كهربائية تتناسب طرديا مع محتوى NO لخليط الغاز الذي تم أخذ عينات منه32. يتم تمثيل مخطط مبسط ل CLD.
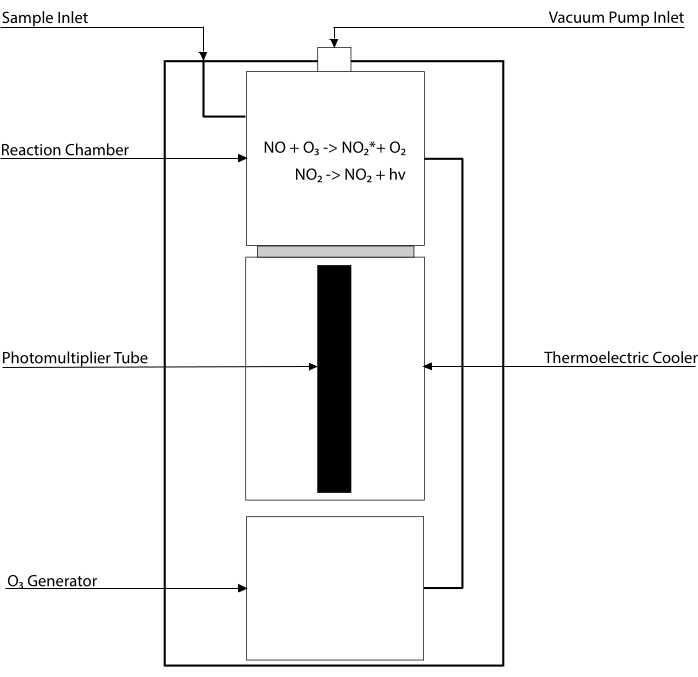
الشكل 1: مخطط مبسط لكاشف التلألؤ الكيميائي لغاز أكسيد النيتريك. الكشف القائم على التلألؤ الكيميائي لأكسيد النيتريك (NO) هو توليد stoichiometric لفوتون واحد لكل جزيء غاز NO يتم إدخاله في كاشف التلألؤ الكيميائي (CLD). يتم الحصول على تفاعل التلألؤ الكيميائي في غرفة معينة مزودة بالأوزون (O3) من مولد داخلي ، والذي يتم الاحتفاظ به عند ضغط سلبي عن طريق الاتصال بمضخة خارجية ، مما يسمح بالتدفق المستمر والمستمر لغاز العينة. يتطلب توليد O3 أكسجين ثنائي الذرة (O 2) يتم توفيره بواسطة خزان O2 مخصص متصل ب CLD (توفر الشركات المصنعة الأخرى CLDs تعمل بالهواء المحيط). داخل غرفة التفاعل ، يتفاعل كل جزيء من غاز NO الموجود في الغاز الذي تم أخذ العينات منه مع الأكسجين لإنتاج جزيء واحد من ثاني أكسيد النيتروجين في الحالة المنشطة (NO2 *). بالعودة إلى حالته الأرضية، ينبعث كل جزيء NO2* من فوتون واحد يتم اكتشافه بواسطة أنبوب مضاعف ضوئي (PMT) يقع بجوار غرفة التفاعل. ينتج PMT مع مكبر الصوت المرتبط به ووحدة المعالجة المركزية إشارة تتناسب مع عدد الفوتون وعدد جزيئات NO في غرفة التفاعل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
يمكن توصيل مدخل العينة من CLD بنظام الأواني الزجاجية الذي يحتوي على غرفة تفاعل للعينات السائلة. يتم تطهير النظام باستمرار بغاز خامل مثل النيتروجين أو الهيليوم أو الأرجون ، مما ينقل NO من غرفة التفاعل إلى CLD. يتم حقن عينات الطور السائل من خلال غشاء مخصص في وعاء التطهير.
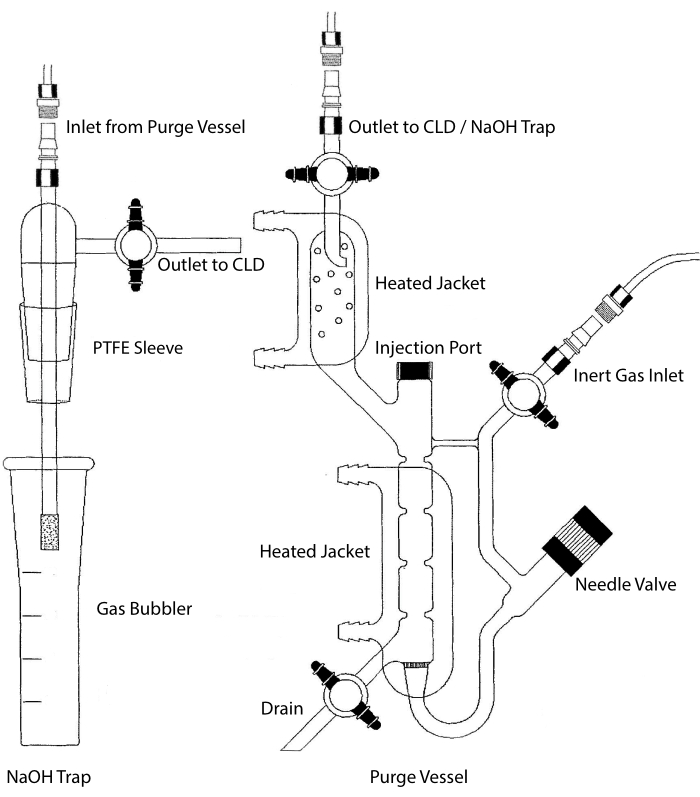
الشكل 2: هيكل وعاء التطهير للكشف القائم على التلألؤ الكيميائي لغاز أكسيد النيتريك يسمح وعاء التطهير (يمين) بالكشف عن غاز أكسيد النيتريك (NO) أو أي مركب آخر يمكن تحويله بسهولة إلى غاز NO عند إطلاقه من كاشف الطور السائل. يتم توصيل مدخل الغاز الخامل بمصدر (خزان) لغاز خامل مثل الأرجون أو زيون أو النيتروجين ثنائي الذرة (N2). يستخدم صمام الإبرة (يفتح إلى اليسار) للتحكم في الضغط داخل وعاء التطهير ويمكن إزالته بالكامل لتنظيف الوعاء. يتم تغطية منفذ الحقن بغطاء مع حاجز غشائي لحقن العينة. يجب استبدال الغشاء في كثير من الأحيان. تحيط سترة ساخنة بغرفة التفاعل ويتم توصيلها بحمام ماء ساخن لإجراء فحص VCl3 في HCl. يتم توصيل منفذ وعاء التطهير بكاشف التلألؤ الكيميائي (CLD) أو بمصيدة NaOH (المطلوبة ل VCl3 في فحوصات HCl). لتصريف محتوى غرفة التفاعل ، قم أولا بإغلاق السدادات عند مدخل الغاز الخامل ومخرج وعاء التطهير ، وأغلق صمام الإبرة ، وأزل الغطاء في منفذ الحقن ، وأخيرا افتح السدادة في البالوعة. يجب وضع مصيدة NaOH (يسار) في خط مستقيم بين وعاء التطهير و CLD إذا تم إجراء فحص VCl3 في HCl بسبب تآكل HCl. يتطلب الاتصال ب CLD دائما وضع مرشح عازل مكثف للمجال (IFD) بين CLD وإخراج وعاء التطهير (أو مصيدة NaOH ، إذا تم استخدامها). يزيل مرشح IFD الجسيمات المحمولة جوا ويمنع السائل من المرور عبر وعاء التطهير. PTFE = بولي تترافلورو إيثيلين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
ونتيجة لذلك ، يمكن اكتشاف أي مركب يمكن تحويله إلى NO من خلال تفاعل كيميائي محدد وخاضع للرقابة بحساسية عالية في أي سائل بيولوجي ونسيج متجانس24. يتم إجراء القياس المباشر للمرحلة الغازية NO من خلال التلألؤ الكيميائي في كل من الإعدادات التجريبية والسريرية. يتم وصف هذه التقنيات على نطاق واسع في أماكن أخرى33،34،35. يمكن إجراء قياس NO2-و S-nitrosothiols و S-nitrosated proteins و Fe-NOs عن طريق إضافة عينات في خليط تفاعل مع ثلاثي يوديد (I3–) ، والذي يطلق غاز NO من جميع هذه المركبات:
I3– → I2 + I–
2NO 2− +2I− +4H+ → 2NO + I 2 +2H 2 O
I3− + 2RS-NO → 3I− + RSSR + 2NO+
2NO+ + 2I− → 2NO + I2
بينما أنا 3- لا يتفاعل مع NO 3-15. وتصبح القياسات الدقيقة لكل مركب ممكنة عن طريق المعالجة المسبقة لعينات الأليكوت بالسلفانيلاميد المحمض (AS) مع أو بدون كلوريد الزئبق (HgCl2). على وجه التحديد ، تزيل المعالجة المسبقة باستخدام AS جميع محتويات NO 2. ونتيجة لذلك، فإن محتوى NO الذي تم قياسه بواسطة CLD لا يعكس سوى مجموع تركيز S-NOs و Fe-NOs. يؤدي حقن HgCl 2 في عينة أليكوت قبل حقن AS إلى إطلاق NO2– بواسطة S-NO. يضمن العلاج باستخدام AS (مما يؤدي إلى إزالة NO2) أن محتوى NO المقاس يعكس فقط تركيز Fe-NOs. تسمح سلسلة من عمليات الطرح بين التقييمات بحساب التركيز الدقيق لمشتقات NO الثلاثة22.
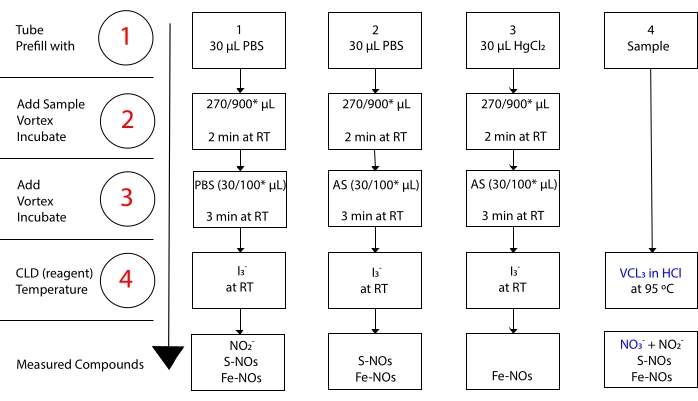
الشكل 3: خطوات إعداد العينة لفحص التلألؤ الكيميائي I3– في حمض الخليك. يتم توضيح الخطوات المتسلسلة لإعداد اختبار التلألؤ الكيميائي I3– في حمض الخليك. مطلوب استخدام أنابيب الطرد المركزي المحمية من الضوء. الأنابيب 1 و 2 و 3 هي تلك المستخدمة للتحضير للفحص. هناك حاجة إلى عينة أخرى من أليكوت (الأنبوب 4) لفحص VCl 3 في HCl إذا كان قياس النترات (NO3–) مطلوبا. يشار إلى الخطوات بالأرقام باللون الأحمر. الملء المسبق (الخطوة 1) كما هو موضح بمحلول ملحي عازل للفوسفات (PBS) أو HgCl2 قبل إضافة حجم العينة. أضف حجم العينة (2) كما هو موضح ، دوامة ، واحتضن لمدة دقيقتين في درجة حرارة الغرفة (RT). أضف (3) PBS أو السلفانيلاميد المحمض (AS) كما هو موضح ، دوامة ، واحتضن لمدة 3 دقائق في RT. قم بتشغيل الفحص (4). التركيز الذي يقاس بالفحص هو مجموع تركيز المركبات المبلغ عنها تحت كل أنبوب. سيسمح الأنبوب رقم 1 بقياسات النتريت (NO2-) و S-nitrosothiols (S-NO) ومجمعات الحديد والنيتروزيل (Fe-NOs) كإشارة واحدة. لقياس النترات (NO 3-) ، يجب تشغيل العينات باستخدام كل من I 3– في حمض الخليك و VCl 3 في مقايسات HCl ، ويجب طرح القيمة التي تم الحصول عليها من الأنبوب 1 من القيمة التي تم الحصول عليها من الأنبوب 4. * الكميات المقترحة لاستخدامها في تحليل Hb لتحديد الكميات المتبقية NO2-و S-nitrosohemoglobin والحديد-النيتروزيل-الهيموغلوبين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
لقياس NO 3 ، يتم استخدام كلوريد الفاناديوم (III) (VCl 3) في حمض الهيدروكلوريك (HCl) لتحويل NO 3- إلى NO في وعاء التطهير من أجل قياس NO 3– stoichiometrically مع CLD:
2 NO 3–+ 3V +3 + 2H 2 O →2NO+ 3VO2+ + 4H+
لتحقيق تحويل سريع بما فيه الكفاية ، يجب إجراء التفاعل عند 90-95 درجة مئوية. يقترن الانخفاض من NO3 – إلى NO 2– بتخفيض NO2 – إلى NO بواسطة HCl. كما يقلل معدن الفاناديوم من S-NOs مما يحرر NO moiety22,36. يعكس التركيز النهائي الذي تم الحصول عليه بواسطة CLD مع VCl 3 في HCl التركيز الكلي ل NO 3-و NO2 والمركبات النيتروجينية الأخرى. يسمح طرح القيمة الأخيرة من التركيز الناتج عن CLD مع I 3- بحساب تركيز NO 3– 36,37 (الشكل 3).
في فحص الاستهلاك NO ، فإن الإطلاق المستمر ل NO في وعاء التطهير من قبل مانحين NO مثل (Z)-1-[2-(2-aminoethyl)-N-(2-ammonioethyl)amino]diazen-1-ium-1,2-diolate (DETA-NONOate) يولد إشارة مستقرة تسمح بتحديد كمية أوكسي Hb الخالي من الخلايا في العينات المحقونة. كمية NO المستهلكة في وعاء التطهير هي في علاقة stoichiometric مع كمية oxyHb في العينة38.
وتوضح بروتوكولات قياس ال NO2-، و NO3–، و S-nitrosothiols، ومجمعات الحديد والنيتروزيل، وعدم استهلاك Hb الخالي من الخلايا في عينات البلازما. تتطلب الدراسات التي أجريت على NO في بيئة RBC معالجة عينة محددة تليها كروماتوغرافيا الاستبعاد لقياس S-NO-Hb و Hb-NO الهشة للغاية إلى جانب تحديد تركيز Hb الكلي15,22. يعد إعداد العينة مفيدا في تصحيح القياس. يمكن أن يؤدي الوجود المسبق ل NO 2– في H 2 O وإطلاق NO2– أثناء الفحص إلى قياس تركيزات أعلى بشكل مصطنع من مشتقات NO مثل S-NO-Hb14,39. كما يتم عرض جوانب مهمة من إعداد العينات.
Protocol
Representative Results
Discussion
نظرا للحساسية العالية ، فإن الفحوصات القائمة على التلألؤ الكيميائي لتحديد NO والمركبات ذات الصلة لديها خطر كبير من تلوث NO 2. يجب اختبار كل كاشف (خاصة محلول الحجب NO 2) والمخفف (بما في ذلك ddH 2 O) المستخدم في التجربة لمحتواه NO 2– لتصحيحه لإشارة الخلفية. الن?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
أصبحت البروتوكولات الواردة في هذه المخطوطة ممكنة بفضل المساهمات المتراكمة للزملاء السابقين في مختبر الدكتور وارن زابول لأبحاث التخدير في الرعاية الحرجة ، قسم التخدير في مستشفى ماساتشوستس العام. ونعرب عن تقديرنا لمساهمة الدكاترة أكيتو ناكاغاوا، وفرانشيسكو زاديك، وإيمانويل فاسينا، وتشونغ لي، وياسوكو ناغاساكا، وإستر سباغنولي، وإيمانويل ريزواغلي.
Materials
| Acetic Acid | Sigma | 45754 | 500 mL – liquid |
| Antifoam B Emulsion | Sigma | A5757 | 250 mL – liquid |
| DETA NONOate | Cayman | 82120 | 10 mg |
| Gibco DPBS (1x) no calcium, no magnesium | ThermoFisher | 14190144 | 500 mL |
| Hydroochloric Acid 37% (1 M) | Sigma | 258148 | 500 mL – liquid |
| Iodine | SAFC | 207772 | 100 g – solid |
| Kimwipes | Kimtech | 34155 | |
| Mercury (II) Chloride ACS reagent> 99.5% | Sigma | 215465 | 100 g – solid (dissolve in water) |
| Mili-Q Water Purification System | Millipore | ||
| Model 705 RN 50 μL syringe | Hamilton | 80530 | Microliter syringe |
| Model 802 N 25 μL Syringe | Hamilton | 84854 | Microliter syringe |
| N-ethylmaleimide | Sigma | 4260 | 25 g – crystalline |
| Nitric Oxide Analyzer + Bundle Software – Purge Vessel | Zysense | NOA 280i | Chemiluminescence Detector |
| Nonidet p-40 (NP-40) | ThermoFisher | 85125 | 10% – 500 mL |
| Potassium hexacyanoferrate (III) ACS reagent≥ 99% | Sigma | 244023 | 100 g – powder |
| Potassium Iodide ACS reagent> 99% | Sigma | 221945 | 100 g – solid |
| Potassium Nitrite cryst. For analysis EMSURE ACS | Supelco | 105067 | 250 g – crystalline |
| PowerGen 125 | Fisher Scientific | 14-359-251 | Mechanic Homogenizer |
| RV3 Two Stage Rotary Vane Pump | Edwards | A65201906 | Vacuum Pump – Bundled with analyzer |
| Sodium Heparin – BD Hemogard Clo | BD Biosciences | BD367871 | 75 USP Units |
| Sodium hydroxide anhydrous ACS reagent ≥ 97% | Sigma | 795429 | 1 kg – pelletts |
| Sodium Nitrate ACS reagent ≥ 99% | Sigma | 221341 | 500 g – powder |
| Sodium nitrite ≥ 99% | Sigma | S2252 | 500 g – crystalline |
| Sulfanilamide ≥ 98% | Sigma | S9251 | 100 g – solid |
| Vanadium (III) Chloride | Sigma | 112393 | 25 g – solid – Caution (exothermic) |
| Whatman 1 Filter Paper | Sigma | WHA10010155 |
Riferimenti
- Palmer, R. M. J., Ferrige, A. G., Moncada, S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature. 327 (6122), 524-526 (1987).
- Furchgott, R. F. The discovery of endothelium-derived relaxing factor and its importance in the identification of nitric oxide. JAMA: The Journal of the American Medical Association. 276 (14), 1186 (1996).
- Ignarro, L. J., Buga, G. M., Byrns, R. E., Wood, K. S., Chaudhuri, G. Endothelium-derived relaxing factor and nitric oxide possess identical pharmacologic properties as relaxants of bovine arterial and venous smooth muscle. The Journal of Pharmacology and Experimental Therapeutics. 246 (1), 218-226 (1998).
- Arnold, W. P., Mittal, C. K., Katsuki, S., Murad, F. Nitric oxide activates guanylate cyclase and increases guanosine 3′:5′-cyclic monophosphate levels in various tissue preparations. Proceedings of the National Academy of Sciences of the United States of America. 74 (8), 3203-3207 (1977).
- Hayashida, K., et al. Depletion of vascular nitric oxide contributes to poor outcomes after cardiac arrest. American Journal of Respiratory and Critical Care Medicine. 199 (10), 1288-1290 (2019).
- Ignarro, L. J. Inhaled NO and COVID-19. British Journal of Pharmacology. 177 (16), 3848-3849 (2020).
- Gantner, B. N., LaFond, K. M., Bonini, M. G. Nitric oxide in cellular adaptation and disease. Redox Biology. 34, 101550 (2020).
- Clark, R. H., et al. Low-dose nitric oxide therapy for persistent pulmonary hypertension of the newborn. New England Journal of Medicine. 342 (7), 469-474 (2000).
- Goldbart, A., et al. Inhaled nitric oxide therapy in acute bronchiolitis: A multicenter randomized clinical trial. Scientific Reports. 10 (1), (2020).
- Bangirana, P., et al. Inhaled nitric oxide and cognition in pediatric severe malaria: A randomized double-blind placebo controlled trial. PloS One. 13 (1), 0191550 (2018).
- Jiang, S., Dandu, C., Geng, X. Clinical application of nitric oxide in ischemia and reperfusion injury: A literature review. Brain Circulation. 6 (4), 248-253 (2020).
- Lei, C., et al. Nitric oxide decreases acute kidney injury and stage 3 chronic kidney disease after cardiac surgery. American Journal of Respiratory and Critical Care Medicine. 198 (10), 1279-1287 (2018).
- Kelm, M. Nitric oxide metabolism and breakdown. Biochimica et Biophysica Acta. 1411 (2-3), 273-289 (1999).
- Bryan, N. S., Grisham, M. B. Methods to detect nitric oxide and its metabolites in biological samples. Free Radical Biology and Medicine. 43 (5), 645-657 (2007).
- Macarthur, P. H., Shiva, S., Gladwin, M. T. Measurement of circulating nitrite and S-nitrosothiols by reductive chemiluminescence. Journal of Chromatography B. 851 (1-2), 93-105 (2007).
- Helms, C., Kim-Shapiro, D. B. Hemoglobin-mediated nitric oxide signaling. Free Radical Biology and Medicine. 61, 464-472 (2013).
- Kim-Shapiro, D. B., Schechter, A. N., Gladwin, M. T. Unraveling the reactions of nitric oxide, nitrite, and hemoglobin in physiology and therapeutics. Arteriosclerosis, Thrombosis, and Vascular Biology. 26 (4), 697-705 (2006).
- Rezoagli, E., et al. Pulmonary and systemic vascular resistances after cardiopulmonary bypass: role of hemolysis. Journal of Cardiothoracic and Vascular Anesthesia. 31 (2), 505-515 (2017).
- Shiva, S. Nitrite: A physiological store of nitric oxide and modulator of mitochondrial function. Redox Biology. 1 (1), 40-44 (2013).
- Lundberg, J. O., Weitzberg, E., Gladwin, M. T. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nature Reviews Drug Discovery. 7 (2), 156-167 (2008).
- Heinrich, T. A., Da Silva, R. S., Miranda, K. M., Switzer, C. H., Wink, D. A., Fukuto, J. M. Biological nitric oxide signalling: chemistry and terminology. British Journal of Pharmacology. 169 (7), 1417-1429 (2013).
- Yang, B. K., Vivas, E. X., Reiter, C. D., Gladwin, M. T. Methodologies for the sensitive and specific measurement of s -nitrosothiols, iron-nitrosyls, and nitrite in biological samples. Free Radical Research. 37 (1), 1-10 (2003).
- Hayashida, K., et al. Improvement in outcomes after cardiac arrest and resuscitation by inhibition of s-nitrosoglutathione reductase. Circulation. 139 (6), 815-827 (2019).
- Rodríguez-Ortigosa, C. M., et al. Biliary secretion of S-nitrosoglutathione is involved in the hypercholeresis induced by ursodeoxycholic acid in the normal rat. Hepatology. 52 (2), 667-677 (2010).
- Mitchell, D. A., Marletta, M. A. Thioredoxin catalyzes the S-nitrosation of the caspase-3 active site cysteine. Nature Chemical Biology. 1 (3), 154-158 (2005).
- Mannick, J. B., et al. Fas-induced caspase denitrosylation. Science. 284 (5414), 651-654 (1999).
- Choi, Y. -. B., et al. Molecular basis of NMDA receptor-coupled ion channel modulation by S-nitrosylation. Nature Neuroscience. 3 (1), 15-21 (2000).
- Eu, J. P., Sun, J., Xu, L., Stamler, J. S., Meissner, G. The skeletal muscle calcium release channel: Coupled O2 sensor and NO signaling functions. Cell. 102 (4), 499-509 (2000).
- Stamler, J. S., et al. Nitric oxide circulates in mammalian plasma primarily as an S-nitroso adduct of serum albumin. Proceedings of the National Academy of Sciences of the United States of America. 89 (16), 7674-7677 (1992).
- Dunham, A. J., Barkley, R. M., Sievers, R. E. Aqueous nitrite ion determination by selective reduction and gas phase nitric oxide chemiluminescence. Analytical Chemistry. 67 (1), 220-224 (1995).
- Hogg, N., Zielonka, J., Kalyanaraman, B., Ignarro, L. J., Freeman, B. A. Detection of Nitric Oxide and Peroxynitrite in Biological Systems: A State-of-the-Art Review. Nitric Oxide (Third Edition). , 23-44 (2017).
- Gudem, M., Hazra, A. Mechanism of the chemiluminescent reaction between nitric oxide and ozone. The Journal of Physical Chemistry A. 123 (4), 715-722 (2019).
- Ishibe, Y., Liu, R., Hirosawa, J., Kawamura, K., Yamasaki, K., Saito, N. Exhaled nitric oxide level decreases after cardiopulmonary bypass in adult patients. Critical Care Medicine. 28 (12), 3823-3827 (2000).
- American Thoracic Society, European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide, 2005. American Journal of Respiratory and Critical Care Medicine. 171 (8), 912-930 (2005).
- Cuthbertson, B. H., Stott, S. A., Webster, N. R. Exhaled nitric oxide as a marker of lung injury in coronary artery bypass surgery. British Journal of Anaesthesia. 89 (2), 247-250 (2002).
- Ewing, J. F., Janero, D. R. Specific S-nitrosothiol (thionitrite) quantification as solution nitrite after vanadium(III) reduction and ozone-chemiluminescent detection. Free Radical Biology and Medicine. 25 (4-5), 621-628 (1998).
- Braman, R. S., Hendrix, S. A. Nanogram nitrite and nitrate determination in environmental and biological materials by vanadium(III) reduction with chemiluminescence detection. Analytical Chemistry. 61 (24), 2715-2718 (1989).
- Wang, X., et al. Biological activity of nitric oxide in the plasmatic compartment. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11477-11482 (2004).
- Bryan, N. S., Rassaf, T., Rodriguez, J., Feelisch, M. Bound NO in human red blood cells: fact or artifact. Nitric Oxide. 10 (4), 221-228 (2004).
- Kida, K., Shirozu, K., Yu, B., Mandeville, J. B., Bloch, K. D., Ichinose, F. Beneficial effects of nitric oxide on outcomes after cardiac arrest and cardiopulmonary resuscitation in hypothermia-treated mice. Anesthesiology. 120 (4), 880-889 (2014).
- Gladwin, M. T., et al. S-Nitrosohemoglobin is unstable in the reductive erythrocyte environment and lacks O2/NO-linked allosteric function. The Journal of Biological Chemistry. 277 (31), 27818-27828 (2002).
- Feelisch, M., et al. and heme-nitros(yl)ation in biological tissues and fluids: implications for the fate of NO in vivo. The FASEB Journal. 16 (13), 1775-1785 (2002).
- Liu, T., et al. L-NAME releases nitric oxide and potentiates subsequent nitroglycerin-mediated vasodilation. Redox Biology. 26, 101238 (2019).
- Piknova, B., Park, J. W., Cassel, K. S., Gilliard, C. N., Schechter, A. N. Measuring nitrite and nitrate, metabolites in the nitric oxide pathway, in biological materials using the chemiluminescence method. Journal of Visualized Experiments: JoVE. (118), e54879 (2016).
- Keefer, L. K., Nims, R. W., Davies, K. M., Wink, D. A. 34;NONOates" (1-substituted diazen-1-ium-1,2-diolates) as nitric oxide donors: Convenient nitric oxide dosage forms. Methods in Enzymology. , 281-293 (1996).
- Nagababu, E., Rifkind, J. M. Measurement of plasma nitrite by chemiluminescence without interference of S-, N-nitroso and nitrated species. Free Radical Biology and Medicine. 42 (8), 1146-1154 (2007).
- Doctor, A., et al. Hemoglobin conformation couples erythrocyte S-nitrosothiol content to O2 gradients. Proceedings of the National Academy of Sciences of the United States of America. 102 (16), 5709-5714 (2005).
- Zhang, Y., Keszler, A., Broniowska, K. A., Hogg, N. Characterization and application of the biotin-switch assay for the identification of S-nitrosated proteins. Free Radical Biology and Medicine. 38 (7), 874-881 (2005).
- Davies, I. R., Zhang, X., Poole, R. K. Nitric Oxide Selective Electrodes. Methods in enzymology. , 63-95 (2008).
- Saito, J., et al. Comparison of fractional exhaled nitric oxide levels measured by different analyzers produced by different manufacturers. Journal of Asthma. 57 (11), 1216-1226 (2020).

