Chemiluminescensbaserede assays til påvisning af nitrogenoxid og derivater heraf fra autoxidation og nitroserede forbindelser
Summary
Her præsenterer vi protokoller til påvisning af nitrogenoxid og dets biologisk relevante derivater ved hjælp af kemiluminescensbaserede assays med høj følsomhed.
Abstract
Nitrogenoxid (NO) aktivitet in vivo er de kombinerede resultater af dets direkte virkninger, virkningen af dets derivater genereret af NO autoxidation og virkningerne af nitroserede forbindelser. Måling af NO-metabolitter er afgørende for at studere NO-aktivitet både på vaskulære niveauer og i andre væv, især i de eksperimentelle indstillinger, hvor eksogen NO administreres. Ozonbaserede kemiluminescensassays muliggør præcise målinger af NO- og NO-metabolitter i både væsker (herunder plasma, vævshomogenater, cellekulturer) og gasblandinger (f.eks. Udåndingsåndedræt). NO reagerer med ozon for at generere nitrogendioxid i en ophidset tilstand. Den deraf følgende lysemission tillader fotosektion og generering af et elektrisk signal, der afspejler NO-indholdet i prøven. Aliquots fra den samme prøve kan bruges til at måle specifikke NO-metabolitter, såsom nitrat, nitrit, S-nitrosothioler og jern-nitrosylkomplekser. Derudover kvantificeres NO forbruges af cellefrit hæmoglobin også med kemiluminescensanalyse. En illustration af alle disse teknikker er tilvejebragt.
Introduction
Siden Salvador Moncada og nobelpristagerne Robert Furchgott, Louis Ignarro og Ferid Murad identificerede nitrogenoxid (NO) som den tidligere kendte endotelafledte afslapningsfaktor (EDRF), er NO’s centrale rolle blevet etableret i flere nøglemekanismer, der spænder over vaskulær biologi, neurovidenskab, metabolisme og værtsrespons 1,2,3,4,5,6,7 . Eksogen administration af NO-gas er blevet en etableret behandling for respirationssvigt på grund af pulmonal hypertension hos den nyfødte8. Nitrogenoxidgas er også blevet undersøgt til behandling af respiratorisk syncytialvirus (RSV) infektion, malaria og andre infektionssygdomme, iskæmi-reperfusionsskade og til forebyggelse af akut nyreskade hos patienter, der gennemgår hjertekirurgi 9,10,11,12. Behovet for præcise måleteknikker til vurdering af niveauerne af NO, dets metabolitter og niveauerne af dets målproteiner og forbindelser stammer fra både mekanistiske og interventionelle undersøgelser.
På grund af sin høje reaktivitet kan NO gennemgå forskellige reaktioner afhængigt af den biologiske matrix, hvori den produceres og/eller frigives. I mangel af hæmoglobin (Hb) eller andre oxy-hæmoproteiner oxideres NO næsten fuldstændigt til nitrit (NO2–).
2NO + O2 → 2NO2
NO2 + NO → N2O3
N2O3 +H20→ NO2– + H+
NO gennemgår først autoxidation med molekylært oxygen (O2) for at give nitrogendioxid (NO2) og reagerer medNO2 selv for at generere dinitrogentrioxid (N203). Et molekyleN203reagerer med vand (H20) for at danne to molekyler afNO2– og en proton (H +)13. Inden for fuldblodomdannes 14,15, NO og NO2– hurtigt til nitrat (NO3–), da disse molekyler reagerer ivrigt med de oxiderede hæmgrupper af Hb [Hb-Fe2+–O2 eller oxyhemoglobin (oxyHb)] for at give NO3–. Denne reaktion er kombineret med overgangen af hæmgruppen til jerntilstanden [Hb-Fe3+ eller methemoglobin (metHb)]:
Hb-Fe2+-O2 + NO → Hb-Fe3+ + NO3–
Barrieren for røde blodlegemer (RBC) og rummet umiddelbart ved siden af endotelet er de vigtigste faktorer, der begrænser denne reaktion og tillader en lille del af NO frigivet af endotelet at fungere som EDRF16,17. Faktisk er cellefri Hb i cirkulationen kendt for at forstyrre vasodilatation i eksperimentelle og kliniske indstillinger17,18. Inden for RBC, afhængigt af iltning ogNO2-koncentration, reagerer en del af NO med deoxyhemoglobin (Hb-Fe2+) for at danne jern-nitrosyl Hb (Hb-Fe2+-NO eller HbNO):
Hb-Fe2+ + INGEN → Hb-Fe2+-NO
I RBC15,17 kan NO2– danne Hb-Fe3+ ved at reducere Hb-Fe2+, hvilket fører til frigivelse af NO, hvilket igen binder Hb-Fe2+–O2 (fortrinsvis) eller Hb-Fe2+.
Generering af NO-derivater bør ikke betragtes som strengt ensrettet, da NO kan regenereres fra NO2– og NO3– i forskellige væv og af forskellige enzymer (f.eks. af tarmbakterier eller i mitokondrier, især under hypoxiske tilstande)19,20.
En variabel mængde NO produceret (eller administreret) fører til downstream-generering af S-nitrosothioler, hovedsagelig ved thioltransnitrosation fraN203i nærvær af en nukleofil, der skaber et NO+ -donormellemprodukt (Nuc-NO+–NO2–):
N2O3 + RS– → RS-NO + NO2–
En anden mulighed for generering af S-nitrosothioler er nitrosylering af oxiderede thioler (NO reagerer med en oxideret thiol):
RS• + INGEN → RS-NO
Denne mekanisme og direkte thioloxidation ved NO2 kan kun være mulig under meget specifikke forhold, som er beskrevet andetsteds21. S-nitrosothioler spænder fra lette molekyler som S-nitrosoglutathion til store thiolholdige proteiner. S-nitrosohemoglobin (S-NO-Hb) dannes ved nitrosering af en thiolgruppe af en konserveret cysteinrest i β(β93C)22.
Generering og metabolisme af S-nitrosothioler er en del af vigtige reguleringsmekanismer. Eksempler indbefatter regulering af glutathion, caspaser, N-methyl-D-aspartat (NMDA) og ryanodinreceptorer 23,24,25,26,27,28. Nitroseret albumin (S-nitroso-albumin), der tidligere blev betragtet som en vigtig formidler af NO-biologi in vivo, synes at være en NO/NO+-transportør uden nogen specifik yderligere biologisk aktivitet29.
Ved måling af koncentrationen af NO og dets derivater fra en specifik biologisk prøve inden for en biologisk matrix er det vigtigt at overveje egenskaber som surhedsgrad, iltning, temperatur og tilstedeværelsen af reagenser. Eksempler indbefatter administrerede eksogene NO-donorer og, i forbindelse med akut inflammation, hydrogenperoxid (H202), der reagerer medNO2, hvilket fører til generering af supernormal koncentration af frie radikaler som peroxynitrit (ONOO–)21. Ud over den anvendte analysemetode er den præanalytiske fase af prøveforberedelse og opbevaring grundlæggende. Downstreamreaktioner, der ikke repræsenterer in vivo NO-aktiviteten, skal forudsiges, overvejes og blokeres. Et gyldigt eksempel er ustabiliteten af S-NO-Hb, der kræver en dedikeret behandling af blodprøver, når den er målrettet til måling22.
Chemiluminescensbaserede assays er guldstandarden til påvisning af niveauerne af NO og dets vigtigste metabolitter [NO2–, NO3–, S-NO- og jern-nitrosylkomplekser (Fe-NO)] i enhver biologisk væske, herunder vævshomogenater30,31. Disse metoder er afhængige af kemiluminescensdetektoren (CLD), en enhed, der huser reaktionen af NO med ozon (O3), hvilket genererer NO2 i en ophidset tilstand (NO2•). Afslapning af NO2• forårsager emission af en foton af lys, der detekteres af et fotomultiplikatorrør, hvilket genererer et elektrisk signal, der er direkte proportionalt med NO-indholdet i den samplede gasblanding32. En forenklet skematisk oversigt over CLD er repræsenteret.
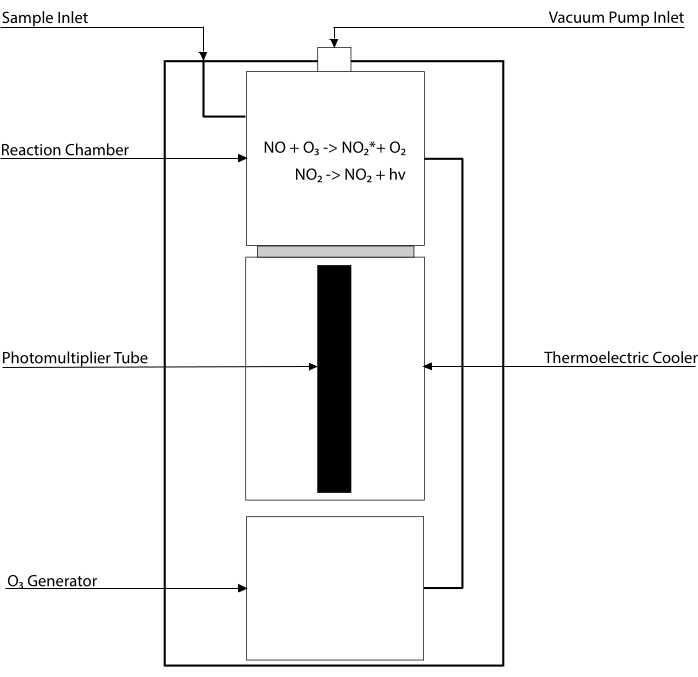
Figur 1: Forenklet skematisk for en kemiluminescensdetektor for nitrogenoxidgas. Kemiluminescensbaseret detektion af nitrogenoxid (NO) er den støkiometriske generering af en foton pr. NO-gasmolekyle, der indføres i kemiluminescensdetektoren (CLD). Kemiluminescensreaktionen opnås i et udpeget kammer forsynet med ozon (O3) fra en intern generator, som holdes ved undertryk ved forbindelse med en ekstern pumpe, hvilket muliggør kontinuerlig og konstant tilstrømning af prøvegas. Genereringen afO3 kræver diatomisk ilt (O2), der leveres af en dedikeretO2-tank , der er forbundet med CLD (andre producenter leverer CLD’er, der opererer med omgivende luft). Inden for reaktionskammeret reagerer hvert molekyle af NO-gas indeholdt i den samplede gas med ilt for at give et molekyle nitrogendioxid i aktiveret tilstand (NO2 *). Ved at vende tilbage til sin grundtilstand udsender hvert NO2 * molekyle en foton, der detekteres af et fotomultiplikatorrør (PMT) placeret ved siden af reaktionskammeret. PMT med den tilhørende forstærker og centrale behandlingsenhed producerer et signal, der er proportionalt med fotontællingen og antallet af NO-molekyler i reaktionskammeret. Klik her for at se en større version af denne figur.
Prøveindslysningen af CLD kan tilsluttes et glasvaresystem, der indeholder et reaktionskammer til flydende prøver. Systemet renses kontinuerligt med en inert gas, såsom nitrogen, helium eller argon, der overfører NO fra reaktionskammeret til CLD. Væskefaseprøver injiceres gennem en dedikeret membran i udrensningsbeholderen.
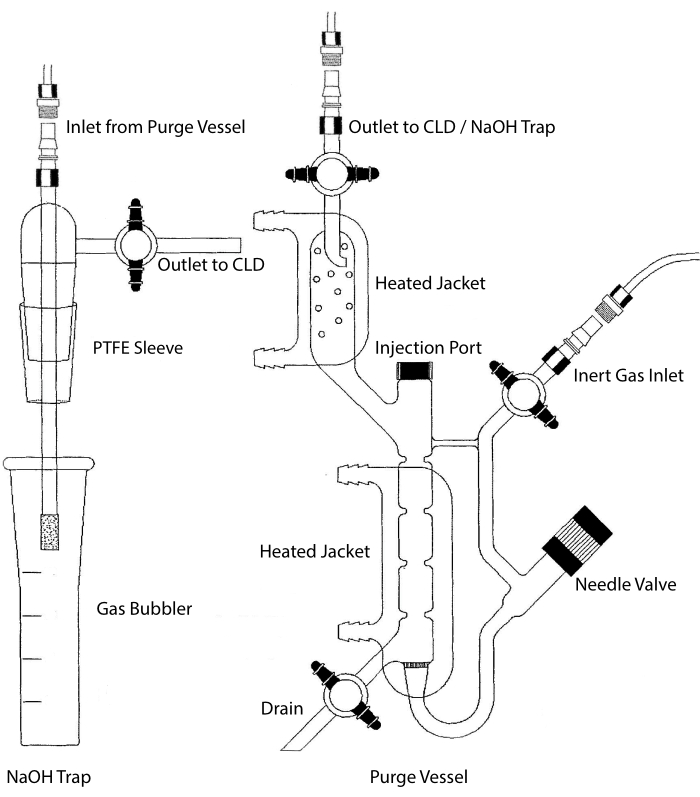
Figur 2: Struktur af et udrensningsfartøj til kemiluminescensbaseret detektion af nitrogenoxidgas Udrensningsbeholderen (til højre) gør det muligt at detektere nitrogenoxid (NO) gas eller enhver anden forbindelse, der let kan omdannes til INGEN gas, når den frigives fra et flydende fasereagens. Det inerte gasindgang er forbundet med en kilde (tank) af en inert gas, såsom Argon, Xeon eller diatomisk nitrogen (N2). Nåleventilen (åbner til venstre) bruges til trykregulering i udrensningsbeholderen og kan fjernes fuldstændigt for at rengøre beholderen. Injektionsporten er dækket af en hætte med en membranseptum til prøveinjektion. Membranen skal udskiftes ofte. En opvarmet jakke omgiver reaktionskammeret og er forbundet til et varmtvandsbad for at udføre VCl3 i HCL-assay. Udrensningsbeholderudløbet er forbundet til kemiluminescensdetektoren (CLD) eller til NaOH-fælden (kræves til VCl3 i HCl-assays). For at dræne reaktionskammerets indhold skal du først lukke stophanerne ved det inerte gasindløb og udrensningsbeholderens udløb, lukke nåleventilen, fjerne hætten ved injektionsporten og til sidst åbne stophanen ved afløbet. NaOH-fælden (til venstre) skal placeres inline mellem udrensningsbeholderen og CLD’en, hvis VCl3 i HCl-assay udføres på grund af HCI’s ætsning. Forbindelsen til CLD kræver altid, at der placeres et intenst felt dielektrisk filter (IFD) mellem CLD og udgangen fra udrensningsbeholderen (eller NaOH-fælden, hvis den anvendes). IFD-filteret fjerner luftbårne partikler og forhindrer væske i at passere gennem udrensningsbeholderen. PTFE = polytetrafluorethylen. Klik her for at se en større version af denne figur.
Som følge heraf kan enhver forbindelse, der kan omdannes til NO gennem en specifik og kontrolleret kemisk reaktion, påvises med høj følsomhed i enhver biologisk væske og vævshomogenat24. Direkte måling af gasfase NO gennem kemiluminescens udføres i både eksperimentelle og kliniske omgivelser. Disse teknikker er udførligt beskrevet andetsteds 33,34,35. Måling af NO2–, S-nitrosothioler, S-nitrositrerede proteiner og Fe-NO’er kan udføres ved at tilsætte prøver i en reaktionsblanding med triiodid (I3–), som støkiometrisk frigiver INGEN gas fra alle disse forbindelser:
I3– → I2 + I–
2NO2− +2I− +4H+ → 2NO + I2 +2H2O
I3− + 2RS-NO → 3I− + RSSR + 2NO+
2NO+ + 2I− → 2NO + I2
mens jeg3– ikke reagerer med NO 3-15. Præcise målinger af hver forbindelse er muliggjort ved forbehandling af prøveallikvoter med syrnet sulfanilamid (AS) med eller uden mercuricchlorid (HgCl2). Konkret fjerner forbehandling med AS alt NO 2-indhold. Som følge heraf afspejler NO-indholdet målt ved CLD kun summen af S-NOs og Fe-NOs koncentration. Injektion af HgCl2 i en prøveallikvote før AS-injektion medfører, at NO2– frigives af S-NO. Behandling med AS (hvilket fører til NO 2-fjernelse) sikrer, at det målte NO-indhold kun afspejler koncentrationen af Fe-NO’er. En række subtraktioner mellem vurderingerne gør det muligt at beregne den nøjagtige koncentration af de tre NO-derivater22.
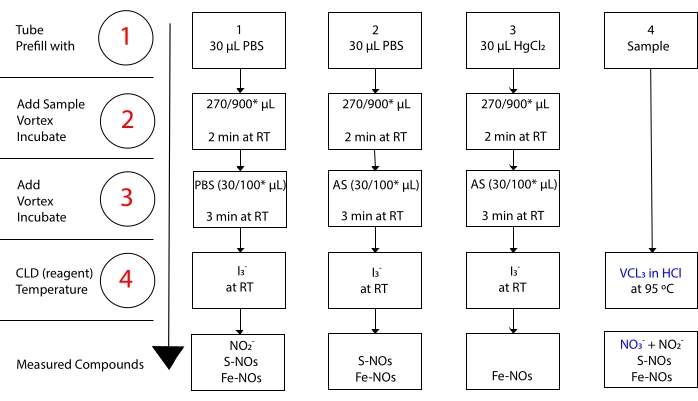
Figur 3: Trin i prøveforberedelse tilI3– i eddikesyre chemiluminescensassay. De sekventielle trin til fremstilling afI3– i eddikesyre chemiluminescensassay er illustreret. Brug af lysbeskyttede centrifugerør er påkrævet. Rør 1, 2 og 3 er dem, der bruges til at forberede sig på analysen. En anden prøve aliquot (rør 4) er nødvendig for VCl3 i HCI-assay, hvis måling af nitrat (NO3–) er påkrævet. Trin er angivet med tal med rødt. Forfyld (trin 1) som angivet med fosfatbuffer saltvand (PBS) ellerHgCl2, inden prøvevolumenet tilsættes. Tilsæt prøvevolumen (2) som angivet, hvirvel, og inkuber i 2 minutter ved stuetemperatur (RT). Tilsæt (3) PBS eller syrnet sulfanilamid (AS) som angivet, hvirvel, og inkuber i 3 minutter ved RT. Koncentrationen målt ved assay er summen af koncentrationen af de forbindelser, der er rapporteret under hvert rør. Rør nummer 1 vil tillade målinger af nitrit (NO2–), S-nitrosothioler (S-NO) og jern-nitrosylkomplekser (Fe-NO’er) som et enkelt signal. Ved måling af nitrat (NO3-) skal der udtages prøver med bådeI3– i eddikesyre ogVCl3 i HCl-assays, og værdien fra rør 1 skal trækkes fra den, der er opnået fra rør 4. *foreslåede mængder, der skal anvendes til Hb-analyse til bestemmelse af resterende NO2–, S-nitrosohemoglobin og jern-nitrosyl-hæmoglobin. Klik her for at se en større version af denne figur.
Ved MÅLING NR. 3– anvendes vanadiumchlorid (III)chlorid (VCl3) i saltsyre (HCI) til omdannelse afNO3– til NO i udrensningsbeholderen med henblik på at måle NO3– støkiometrisk med CLD:
2 NO3–+ 3V+3 + 2H20 → 2NO+ 3VO2+ + 4H+
For at opnå en tilstrækkelig hurtig omdannelse skal reaktionen udføres ved 90-95 °C. Reduktion fra NO3– til NO2– er kombineret med reduktion af NO2– til NO med HCl. Vanadiummetal reducerer også S-NO’er, der frigør deres NO-moiety22,36. Den endelige koncentration opnået ved CLD medVCl3 i HCl afspejler den samlede koncentration afNO3–,NO2 og andre nitroserede forbindelser. Subtraktion af sidstnævnte værdi fra koncentrationen opnået med CLD med I3– gør det muligt at beregne NO 3-koncentration 36,37 (figur 3).
I NO-forbrugsassayet genererer den kontinuerlige frigivelse af NO i udrensningsbeholderen af NO-donorer som (Z)-1-[2-(2-aminoethyl)-N-(2-ammonioethyl)amino]diazen-1-ium-1,2-diolat (DETA-NONOate) et stabilt signal, der gør det muligt at kvantificere cellefri oxyHb i de injicerede prøver. Mængden af NO, der forbruges i udrensningsbeholderen, er i et støkiometrisk forhold til mængden af oxyHb i prøven38.
Protokoller til måling af NO2–, NO3–, S-nitrosothioler, jern-nitrosylkomplekser og INTET forbrug af cellefri Hb i plasmaprøver er illustreret. Undersøgelser af NO i RBC-miljøet kræver specifik prøvebehandling efterfulgt af udelukkelseskromatografi for at måle ekstremt skrøbelig S-NO-Hb og Hb-NO kombineret med bestemmelse af total Hb-koncentration15,22. Prøveforberedelse er medvirkende til at korrigere målingen. Præ-eksistens af NO2– iH20og frigivelse afNO2– under analysen kan føre til måling af kunstigt højere koncentrationer af NO-derivater såsom S-NO-Hb14,39. Vigtige aspekter af prøveforberedelse præsenteres også.
Protocol
Representative Results
Discussion
På grund af den høje følsomhed har kemiluminescensbaserede assays til bestemmelse af NO og beslægtede forbindelser en høj risiko for NO 2-kontaminering. Hvert reagens (isærNO2-blokerende opløsning) og fortyndingsmiddel (herunder ddH2O), der anvendes i forsøget, bør testes for dets NO 2-indhold for at korrigere for baggrundssignal. Nitrit er ekstremt reaktivt med en halveringstid i fuldblod omkring 10 min og genererer hurtigt NO3</s…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Protokollerne rapporteret i dette manuskript blev muliggjort af de akkumulerede bidrag fra tidligere stipendiater fra Dr. Warren Zapols laboratorium for anæstesiforskning i kritisk pleje, Anæstesiafdelingen på Massachusetts General Hospital. Vi anerkender bidraget fra Dr. Akito Nakagawa, Francesco Zadek, Emanuele Vassena, Chong Lei, Yasuko Nagasaka, Ester Spagnolli og Emanuele Rezoagli.
Materials
| Acetic Acid | Sigma | 45754 | 500 mL – liquid |
| Antifoam B Emulsion | Sigma | A5757 | 250 mL – liquid |
| DETA NONOate | Cayman | 82120 | 10 mg |
| Gibco DPBS (1x) no calcium, no magnesium | ThermoFisher | 14190144 | 500 mL |
| Hydroochloric Acid 37% (1 M) | Sigma | 258148 | 500 mL – liquid |
| Iodine | SAFC | 207772 | 100 g – solid |
| Kimwipes | Kimtech | 34155 | |
| Mercury (II) Chloride ACS reagent> 99.5% | Sigma | 215465 | 100 g – solid (dissolve in water) |
| Mili-Q Water Purification System | Millipore | ||
| Model 705 RN 50 μL syringe | Hamilton | 80530 | Microliter syringe |
| Model 802 N 25 μL Syringe | Hamilton | 84854 | Microliter syringe |
| N-ethylmaleimide | Sigma | 4260 | 25 g – crystalline |
| Nitric Oxide Analyzer + Bundle Software – Purge Vessel | Zysense | NOA 280i | Chemiluminescence Detector |
| Nonidet p-40 (NP-40) | ThermoFisher | 85125 | 10% – 500 mL |
| Potassium hexacyanoferrate (III) ACS reagent≥ 99% | Sigma | 244023 | 100 g – powder |
| Potassium Iodide ACS reagent> 99% | Sigma | 221945 | 100 g – solid |
| Potassium Nitrite cryst. For analysis EMSURE ACS | Supelco | 105067 | 250 g – crystalline |
| PowerGen 125 | Fisher Scientific | 14-359-251 | Mechanic Homogenizer |
| RV3 Two Stage Rotary Vane Pump | Edwards | A65201906 | Vacuum Pump – Bundled with analyzer |
| Sodium Heparin – BD Hemogard Clo | BD Biosciences | BD367871 | 75 USP Units |
| Sodium hydroxide anhydrous ACS reagent ≥ 97% | Sigma | 795429 | 1 kg – pelletts |
| Sodium Nitrate ACS reagent ≥ 99% | Sigma | 221341 | 500 g – powder |
| Sodium nitrite ≥ 99% | Sigma | S2252 | 500 g – crystalline |
| Sulfanilamide ≥ 98% | Sigma | S9251 | 100 g – solid |
| Vanadium (III) Chloride | Sigma | 112393 | 25 g – solid – Caution (exothermic) |
| Whatman 1 Filter Paper | Sigma | WHA10010155 |
Riferimenti
- Palmer, R. M. J., Ferrige, A. G., Moncada, S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature. 327 (6122), 524-526 (1987).
- Furchgott, R. F. The discovery of endothelium-derived relaxing factor and its importance in the identification of nitric oxide. JAMA: The Journal of the American Medical Association. 276 (14), 1186 (1996).
- Ignarro, L. J., Buga, G. M., Byrns, R. E., Wood, K. S., Chaudhuri, G. Endothelium-derived relaxing factor and nitric oxide possess identical pharmacologic properties as relaxants of bovine arterial and venous smooth muscle. The Journal of Pharmacology and Experimental Therapeutics. 246 (1), 218-226 (1998).
- Arnold, W. P., Mittal, C. K., Katsuki, S., Murad, F. Nitric oxide activates guanylate cyclase and increases guanosine 3′:5′-cyclic monophosphate levels in various tissue preparations. Proceedings of the National Academy of Sciences of the United States of America. 74 (8), 3203-3207 (1977).
- Hayashida, K., et al. Depletion of vascular nitric oxide contributes to poor outcomes after cardiac arrest. American Journal of Respiratory and Critical Care Medicine. 199 (10), 1288-1290 (2019).
- Ignarro, L. J. Inhaled NO and COVID-19. British Journal of Pharmacology. 177 (16), 3848-3849 (2020).
- Gantner, B. N., LaFond, K. M., Bonini, M. G. Nitric oxide in cellular adaptation and disease. Redox Biology. 34, 101550 (2020).
- Clark, R. H., et al. Low-dose nitric oxide therapy for persistent pulmonary hypertension of the newborn. New England Journal of Medicine. 342 (7), 469-474 (2000).
- Goldbart, A., et al. Inhaled nitric oxide therapy in acute bronchiolitis: A multicenter randomized clinical trial. Scientific Reports. 10 (1), (2020).
- Bangirana, P., et al. Inhaled nitric oxide and cognition in pediatric severe malaria: A randomized double-blind placebo controlled trial. PloS One. 13 (1), 0191550 (2018).
- Jiang, S., Dandu, C., Geng, X. Clinical application of nitric oxide in ischemia and reperfusion injury: A literature review. Brain Circulation. 6 (4), 248-253 (2020).
- Lei, C., et al. Nitric oxide decreases acute kidney injury and stage 3 chronic kidney disease after cardiac surgery. American Journal of Respiratory and Critical Care Medicine. 198 (10), 1279-1287 (2018).
- Kelm, M. Nitric oxide metabolism and breakdown. Biochimica et Biophysica Acta. 1411 (2-3), 273-289 (1999).
- Bryan, N. S., Grisham, M. B. Methods to detect nitric oxide and its metabolites in biological samples. Free Radical Biology and Medicine. 43 (5), 645-657 (2007).
- Macarthur, P. H., Shiva, S., Gladwin, M. T. Measurement of circulating nitrite and S-nitrosothiols by reductive chemiluminescence. Journal of Chromatography B. 851 (1-2), 93-105 (2007).
- Helms, C., Kim-Shapiro, D. B. Hemoglobin-mediated nitric oxide signaling. Free Radical Biology and Medicine. 61, 464-472 (2013).
- Kim-Shapiro, D. B., Schechter, A. N., Gladwin, M. T. Unraveling the reactions of nitric oxide, nitrite, and hemoglobin in physiology and therapeutics. Arteriosclerosis, Thrombosis, and Vascular Biology. 26 (4), 697-705 (2006).
- Rezoagli, E., et al. Pulmonary and systemic vascular resistances after cardiopulmonary bypass: role of hemolysis. Journal of Cardiothoracic and Vascular Anesthesia. 31 (2), 505-515 (2017).
- Shiva, S. Nitrite: A physiological store of nitric oxide and modulator of mitochondrial function. Redox Biology. 1 (1), 40-44 (2013).
- Lundberg, J. O., Weitzberg, E., Gladwin, M. T. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nature Reviews Drug Discovery. 7 (2), 156-167 (2008).
- Heinrich, T. A., Da Silva, R. S., Miranda, K. M., Switzer, C. H., Wink, D. A., Fukuto, J. M. Biological nitric oxide signalling: chemistry and terminology. British Journal of Pharmacology. 169 (7), 1417-1429 (2013).
- Yang, B. K., Vivas, E. X., Reiter, C. D., Gladwin, M. T. Methodologies for the sensitive and specific measurement of s -nitrosothiols, iron-nitrosyls, and nitrite in biological samples. Free Radical Research. 37 (1), 1-10 (2003).
- Hayashida, K., et al. Improvement in outcomes after cardiac arrest and resuscitation by inhibition of s-nitrosoglutathione reductase. Circulation. 139 (6), 815-827 (2019).
- Rodríguez-Ortigosa, C. M., et al. Biliary secretion of S-nitrosoglutathione is involved in the hypercholeresis induced by ursodeoxycholic acid in the normal rat. Hepatology. 52 (2), 667-677 (2010).
- Mitchell, D. A., Marletta, M. A. Thioredoxin catalyzes the S-nitrosation of the caspase-3 active site cysteine. Nature Chemical Biology. 1 (3), 154-158 (2005).
- Mannick, J. B., et al. Fas-induced caspase denitrosylation. Science. 284 (5414), 651-654 (1999).
- Choi, Y. -. B., et al. Molecular basis of NMDA receptor-coupled ion channel modulation by S-nitrosylation. Nature Neuroscience. 3 (1), 15-21 (2000).
- Eu, J. P., Sun, J., Xu, L., Stamler, J. S., Meissner, G. The skeletal muscle calcium release channel: Coupled O2 sensor and NO signaling functions. Cell. 102 (4), 499-509 (2000).
- Stamler, J. S., et al. Nitric oxide circulates in mammalian plasma primarily as an S-nitroso adduct of serum albumin. Proceedings of the National Academy of Sciences of the United States of America. 89 (16), 7674-7677 (1992).
- Dunham, A. J., Barkley, R. M., Sievers, R. E. Aqueous nitrite ion determination by selective reduction and gas phase nitric oxide chemiluminescence. Analytical Chemistry. 67 (1), 220-224 (1995).
- Hogg, N., Zielonka, J., Kalyanaraman, B., Ignarro, L. J., Freeman, B. A. Detection of Nitric Oxide and Peroxynitrite in Biological Systems: A State-of-the-Art Review. Nitric Oxide (Third Edition). , 23-44 (2017).
- Gudem, M., Hazra, A. Mechanism of the chemiluminescent reaction between nitric oxide and ozone. The Journal of Physical Chemistry A. 123 (4), 715-722 (2019).
- Ishibe, Y., Liu, R., Hirosawa, J., Kawamura, K., Yamasaki, K., Saito, N. Exhaled nitric oxide level decreases after cardiopulmonary bypass in adult patients. Critical Care Medicine. 28 (12), 3823-3827 (2000).
- American Thoracic Society, European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide, 2005. American Journal of Respiratory and Critical Care Medicine. 171 (8), 912-930 (2005).
- Cuthbertson, B. H., Stott, S. A., Webster, N. R. Exhaled nitric oxide as a marker of lung injury in coronary artery bypass surgery. British Journal of Anaesthesia. 89 (2), 247-250 (2002).
- Ewing, J. F., Janero, D. R. Specific S-nitrosothiol (thionitrite) quantification as solution nitrite after vanadium(III) reduction and ozone-chemiluminescent detection. Free Radical Biology and Medicine. 25 (4-5), 621-628 (1998).
- Braman, R. S., Hendrix, S. A. Nanogram nitrite and nitrate determination in environmental and biological materials by vanadium(III) reduction with chemiluminescence detection. Analytical Chemistry. 61 (24), 2715-2718 (1989).
- Wang, X., et al. Biological activity of nitric oxide in the plasmatic compartment. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11477-11482 (2004).
- Bryan, N. S., Rassaf, T., Rodriguez, J., Feelisch, M. Bound NO in human red blood cells: fact or artifact. Nitric Oxide. 10 (4), 221-228 (2004).
- Kida, K., Shirozu, K., Yu, B., Mandeville, J. B., Bloch, K. D., Ichinose, F. Beneficial effects of nitric oxide on outcomes after cardiac arrest and cardiopulmonary resuscitation in hypothermia-treated mice. Anesthesiology. 120 (4), 880-889 (2014).
- Gladwin, M. T., et al. S-Nitrosohemoglobin is unstable in the reductive erythrocyte environment and lacks O2/NO-linked allosteric function. The Journal of Biological Chemistry. 277 (31), 27818-27828 (2002).
- Feelisch, M., et al. and heme-nitros(yl)ation in biological tissues and fluids: implications for the fate of NO in vivo. The FASEB Journal. 16 (13), 1775-1785 (2002).
- Liu, T., et al. L-NAME releases nitric oxide and potentiates subsequent nitroglycerin-mediated vasodilation. Redox Biology. 26, 101238 (2019).
- Piknova, B., Park, J. W., Cassel, K. S., Gilliard, C. N., Schechter, A. N. Measuring nitrite and nitrate, metabolites in the nitric oxide pathway, in biological materials using the chemiluminescence method. Journal of Visualized Experiments: JoVE. (118), e54879 (2016).
- Keefer, L. K., Nims, R. W., Davies, K. M., Wink, D. A. 34;NONOates" (1-substituted diazen-1-ium-1,2-diolates) as nitric oxide donors: Convenient nitric oxide dosage forms. Methods in Enzymology. , 281-293 (1996).
- Nagababu, E., Rifkind, J. M. Measurement of plasma nitrite by chemiluminescence without interference of S-, N-nitroso and nitrated species. Free Radical Biology and Medicine. 42 (8), 1146-1154 (2007).
- Doctor, A., et al. Hemoglobin conformation couples erythrocyte S-nitrosothiol content to O2 gradients. Proceedings of the National Academy of Sciences of the United States of America. 102 (16), 5709-5714 (2005).
- Zhang, Y., Keszler, A., Broniowska, K. A., Hogg, N. Characterization and application of the biotin-switch assay for the identification of S-nitrosated proteins. Free Radical Biology and Medicine. 38 (7), 874-881 (2005).
- Davies, I. R., Zhang, X., Poole, R. K. Nitric Oxide Selective Electrodes. Methods in enzymology. , 63-95 (2008).
- Saito, J., et al. Comparison of fractional exhaled nitric oxide levels measured by different analyzers produced by different manufacturers. Journal of Asthma. 57 (11), 1216-1226 (2020).

