מבחנים מבוססי כימילומינסנציה לזיהוי תחמוצת החנקן ונגזרותיה מאוטוקידציה ותרכובות ניטרוסטיות
Summary
כאן אנו מציגים פרוטוקולים לאיתור תחמוצת החנקן ונגזרותיה הרלוונטיות מבחינה ביולוגית באמצעות מבחנים מבוססי כימילומינסנציה בעלי רגישות גבוהה.
Abstract
פעילות תחמוצת החנקן (NO) in vivo היא התוצאות המשולבות של השפעותיה הישירות, פעולת נגזרותיה הנוצרת מ- NO autoxidation, וההשפעות של תרכובות ניטרוסטיות. מדידת מטבוליטים ללא מטבוליטים חיונית לחקר פעילות NO הן ברמות כלי הדם והן ברקמות אחרות, במיוחד במסגרות הניסוי שבהן מנוהל NO אקסוגני. מבחני כימילומינסנציה מבוססי אוזון מאפשרים מדידות מדויקות של מטבוליטים NO ו-NO הן בנוזלים (כולל פלזמה, הומוגנטים של רקמות, תרביות תאים) והן בתערובות גזים (למשל, נשימה בנשיפה). NO מגיב עם אוזון כדי לייצר חנקן דו חמצני במצב נרגש. פליטת האור כתוצאה מכך מאפשרת פוטו-דטקציה ויצירת אות חשמלי המשקף את תוכן ה-NO של הדגימה. ניתן להשתמש באליקוטים מאותה דגימה כדי למדוד מטבוליטים ספציפיים של NO, כגון חנקה, ניטריט, S-nitrosothiols וקומפלקסים של ברזל-ניטרזיל. בנוסף, NO נצרך על ידי המוגלובין ללא תאים הוא גם כימות עם ניתוח chemiluminescence. המחשה של כל הטכניקות הללו מסופקת.
Introduction
מאז שסלבדור מונקדה וחתני פרס נובל רוברט פורצ’גוט, לואיס איגנארו ופריד מוראד זיהו את תחמוצת החנקן (NO) כגורם ההרפיה הנגזר מאנדותל הידוע בעבר (EDRF), התפקיד המרכזי של NO נקבע במספר מנגנונים מרכזיים המשתרעים לאורך ביולוגיה של כלי הדם, מדעי המוח, חילוף החומרים ותגובת המארח 1,2,3,4,4,5,6,7 . מתן אקסוגני של NO גז הפך לטיפול מבוסס לכשל נשימתי עקב יתר לחץ דם ריאתי בתינוק8. גז תחמוצת החנקן נחקר גם לטיפול בזיהום בנגיף סינסיטיאלי נשימתי (RSV), מלריה ומחלות זיהומיות אחרות, פגיעה באיסכמיה-רפרפוזיה, ולמניעת פגיעה חריפה בכליות בחולים שעברו ניתוח לב 9,10,11,12. הצורך בטכניקות מדידה מדויקות כדי להעריך את רמות ה-NO, המטבוליטים שלו ואלה של חלבוני המטרה והתרכובות שלו נובע ממחקרים מכניסטיים והתערבותיים כאחד.
בשל תגובתיותו הגבוהה, NO עשוי לעבור תגובות שונות בהתאם למטריצה הביולוגית שבה הוא מיוצר ו/או משתחרר. בהיעדר המוגלובין (Hb) או אוקסי-המפרוטאינים אחרים, NO מחומצן כמעט לחלוטין לניטריט (NO2–).
2NO + O2 → 2NO2
NO2 + NO → N2O3
N2O3 + H 2 O→NO2– + H+
NO עובר תחילה אוטוקסידיזציה עם חמצן מולקולרי (O2) כדי לייצר חנקן דו חמצני (NO2) ומגיב עם NO2 עצמו כדי לייצר טריאוקסיד דיניטרוגן (N2O3). מולקולה אחת של N2O3 מגיבה עם מים (H2O) ויוצרת שתי מולקולות של NO2– ופרוטון (H+)13. בתוך דם שלם14,15, NO ו-NO 2 – מומרים במהירות לחנקות (NO3–) מכיוון שמולקולות אלה מגיבות בהתלהבות עם קבוצות ההם המחומצנות של Hb [Hb-Fe2+-O2 או אוקסיהמוגלובין (oxyHb)] כדי להניב NO3–. תגובה זו משולבת עם המעבר של קבוצת heme למצב ברזלי [Hb-Fe3+ או methemoglobin (metHb)]:
Hb-Fe2+-O2 + NO → Hb-Fe3+ + NO3–
מחסום תאי הדם האדומים (RBC) והחלל הסמוך לאנדותל הם הגורמים העיקריים המגבילים תגובה זו ומאפשרים לחלק קטן מה-NO המשתחרר על ידי האנדותל לפעול כ-EDRF16,17. למעשה, ידוע כי Hb ללא תאים במחזור הדם משבש את הרחבת כלי הדם במסגרות ניסיוניות וקליניות17,18. בתוך ה-RBC, בהתאם לחמצון ולריכוז NO2, חלק מה-NO מגיב עם דאוקסיהמוגלובין (Hb-Fe2+) ליצירת ברזל-ניטרוזיל Hb (Hb-Fe2+-NO או HbNO):
Hb-Fe2+ + NO → Hb-Fe2+-NO
ב-RBC15,17, NO2– יכול ליצור Hb-Fe3+ על ידי הפחתת Hb-Fe2+ מה שמוביל לשחרור של NO, אשר בתורו קושר Hb-Fe2+-O 2 (באופן מועדף) או Hb-Fe2+.
אין להתייחס ליצירת נגזרות NO כאל חד-כיווניות לחלוטין, שכן NO יכול להתחדש מ-NO 2 ו-NO3 ברקמות שונות ועל ידי אנזימים שונים (למשל, על ידי חיידקי מעיים או בתוך המיטוכונדריה, במיוחד בתנאים היפוקסיים)19,20.
כמות משתנה של NO המיוצרת (או מנוהלת) מובילה לדור במורד הזרם של S-nitrosothiols, בעיקר על ידי טרנסניטרוזיה של תיול מ- N2O3 בנוכחות נוקליאופיל היוצר ביניים תורם NO+ (Nuc-NO+-NO2–):
N2O3 + RS– → RS-NO + NO2–
אפשרות נוספת ליצירת S-nitrosothiols היא ניטרוסילציה של תיולים מחומצנים (אין תגובה עם תיול מחומצן):
RS• + ללא → RS-NO
מנגנון זה וחמצון תיול ישיר על ידי NO2 עשויים להיות אפשריים רק בתנאים ספציפיים מאוד המתוארים במקום אחר21. S-nitrosothiols נעים בין מולקולות אור כמו S-nitrosoglutathione לחלבונים גדולים המכילים תיול. S-nitrosohemoglobin (S-NO-Hb) נוצר על ידי ניטרוסציה של קבוצת תיול של שאריות ציסטאין שמורות בשרשרת β (β93C)22.
הדור ומטבוליזם של S-nitrosothiols הם חלק ממנגנוני ויסות חשובים. דוגמאות לכך כוללות ויסות של גלוטתיון, קספאזות, N-מתיל-D-אספרטט (NMDA) וקולטני ריאנודין 23,24,25,26,27,28. אלבומין ניטרוס (S-nitroso-albumin), שנחשב בעבר כמתווך מרכזי של NO biology in vivo, נראה כמתווך מרכזי של NO/NO+ ללא כל פעילות ביולוגית נוספת ספציפית29.
כאשר מודדים את הריכוז של NO ונגזרותיו מדגימה ביולוגית ספציפית בתוך מטריצה ביולוגית, חשוב לשקול מאפיינים כגון חומציות, חמצון, טמפרטורה ונוכחות של ריאגנטים. דוגמאות לכך כוללות תורמי NO אקסוגניים מנוהלים, ובמסגרת של דלקת חריפה, מי חמצן (H2O2) המגיבים עם NO2 המובילים ליצירת ריכוז על-טבעי של רדיקלים חופשיים כמו פרוקסיניטריט (ONOO–)21. בנוסף לשיטה האנליטית שבה נעשה שימוש, השלב הפרה-אנליטי של הכנת הדגימה ואחסון הוא בסיסי. תגובות במורד הזרם שאינן מייצגות את פעילות in vivo NO יינבאו, יובאו בחשבון וייחסמו. דוגמה תקפה היא חוסר היציבות של S-NO-Hb, הדורש טיפול ייעודי בדגימות דם כאשר הוא מיועד למדידה22.
מבחנים מבוססי Chemiluminescence הם תקן הזהב לגילוי רמות ה-NO והמטבוליטים העיקריים שלו [NO2–, NO3-, S-NO וקומפלקסים של ברזל-ניטרוזיל (Fe-NO)] בכל נוזל ביולוגי, כולל הומוגנטיםשל רקמות 30,31. שיטות אלה מסתמכות על גלאי chemiluminescence (CLD), מכשיר המאחסן את התגובה של NO עם אוזון (O3), המייצר את NO2 במצב נרגש (NO2•). הרפיה של NO2• גורמת לפליטה של פוטון של אור שמתגלה על ידי שפופרת פוטומולטיפלייר, ומייצרת אות חשמלי שנמצא ביחס ישר לתכולת NO של תערובת הגז שנדגמה32. סכימה פשוטה של ה- CLD מיוצגת.
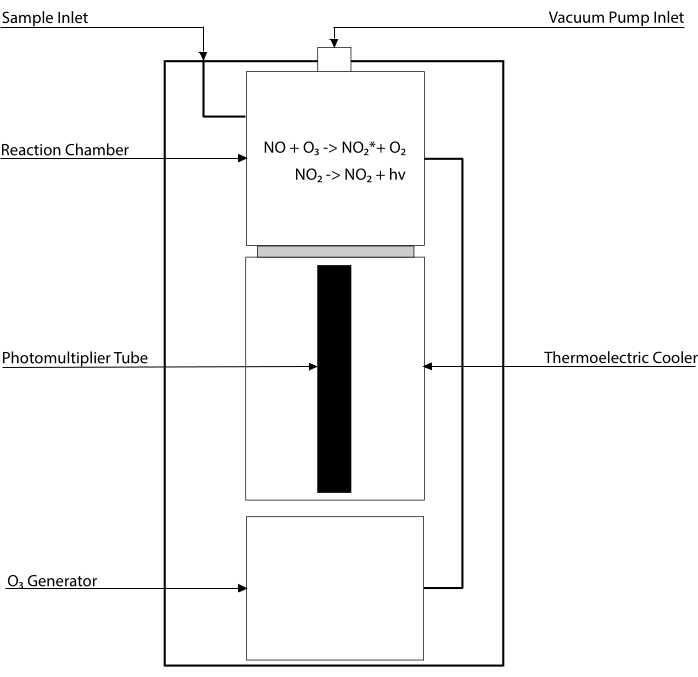
איור 1: סכמות פשוטות של גלאי כימילומינסנציה עבור גז תחמוצת החנקן. זיהוי מבוסס כימילומינסנציה של תחמוצת החנקן (NO) הוא הדור הסטויכיומטרי של פוטון אחד לכל מולקולת גז NO המוחדר בגלאי הכימילומינסנציה (CLD). תגובת הכימילומינסנציה מתקבלת בתא ייעודי המסופק עם אוזון (O3) מגנרטור פנימי, אשר נשמר בלחץ שלילי על ידי חיבור עם משאבה חיצונית, ומאפשר זרימה רציפה וקבועה של גז דגימה. הדור של O3 דורש חמצן דיאטומי (O2) המסופק על ידי מיכל O2 ייעודי המחובר ל- CLD (יצרנים אחרים מספקים CLDs הפועלים עם אוויר סביבה). בתוך תא התגובה, כל מולקולה של גז NO הכלולה בגז שנדגם מגיבה בחמצן כדי להניב מולקולה אחת של חנקן דו-חמצני במצב הפעיל (NO2*). על ידי חזרה למצב הקרקע שלה, כל מולקולת NO2* פולטת פוטון אחד שמתגלה על ידי צינור פוטומולטיפלייר (PMT) הממוקם בסמוך לתא התגובה. ה-PMT עם המגבר המשויך ויחידת העיבוד המרכזית מייצר אות פרופורציונלי לספירת הפוטונים ולמספר מולקולות ה-NO בתא התגובה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
ניתן לחבר את כניסת הדגימה של ה-CLD למערכת כלי זכוכית המכילה תא תגובה לדגימות נוזליות. המערכת מטוהרת באופן רציף עם גז אינרטי כגון חנקן, הליום או ארגון, ומעבירה NO מתא התגובה ל- CLD. דגימות בפאזה נוזלית מוזרקות דרך ממברנה ייעודית לתוך כלי הטיהור.
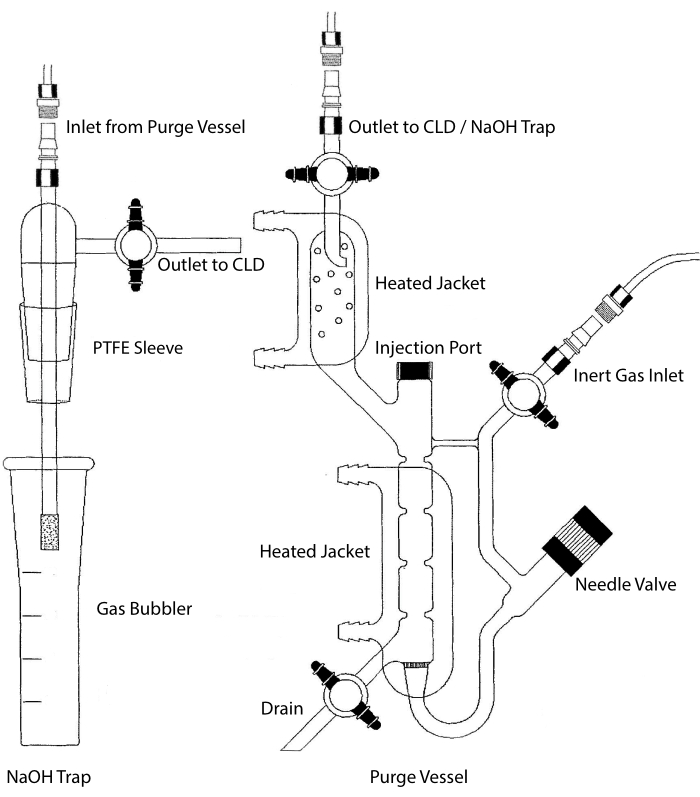
איור 2: מבנה של כלי טיהור לגילוי מבוסס כימילומינסנציה של גז תחמוצת החנקן כלי הטיהור (מימין) מאפשר זיהוי של גז תחמוצת החנקן (NO) או כל תרכובת אחרת שניתן להמיר בקלות לגז NO כאשר הוא משתחרר מריאגנט פאזה נוזלית. כניסת הגז האינרטית מחוברת למקור (מיכל) של גז אינרטי כגון ארגון, Xeon או חנקן דיאטומי (N2). שסתום המחט (נפתח שמאלה) משמש לבקרת לחץ בתוך כלי הטיהור וניתן להסירו לחלוטין כדי לנקות את הכלי. יציאת ההזרקה מכוסה בפקק עם מחיצת ממברנה להזרקת דגימה. יש להחליף את הממברנה לעתים קרובות. ז’קט מחומם מקיף את תא התגובה ומחובר לאמבטיית מים חמים כדי לבצע את בדיקת ה-VCl3 ב-HCl. שקע כלי הטיהור מחובר לגלאי chemiluminescence (CLD) או למלכודת NaOH (הנדרשת עבור VCl3 במבחני HCl). כדי לנקז את תכולת תא התגובה, סגרו תחילה את ה-stopcocks בפתח הגז האינרטי ובשקע כלי הטיהור, סגרו את שסתום המחט, הסירו את המכסה ביציאת ההזרקה ולבסוף פתחו את ה-stopcock בניקוז. מלכודת NaOH (משמאל) נדרשת להיות ממוקמת בשורה בין כלי הטיהור לבין ה-CLD אם בדיקת ה-VCl3 ב-HCl מבוצעת בגלל הקורוזיביות של HCl. החיבור ל-CLD דורש תמיד מסנן דיאלקטרי שדה אינטנסיבי (IFD) שיוצב בין ה-CLD לבין הפלט של כלי הטיהור (או מלכודת NaOH, אם נעשה בו שימוש). מסנן ה-IFD מסיר חלקיקים הנישאים באוויר ועוצר את מעבר הנוזלים דרך כלי הטיהור. PTFE = פוליטטרפלואורואתילן. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
כתוצאה מכך, כל תרכובת שניתן להמיר ל-NO באמצעות תגובה כימית ספציפית ומבוקרת יכולה להיות מזוהה ברגישות גבוהה בכל נוזל ביולוגי ורקמותהומוגנטיות 24. מדידה ישירה של פאזה גזית NO באמצעות chemiluminescence מבוצעת הן במסגרות ניסיוניות והן במסגרות קליניות. טכניקות אלה מתוארות בהרחבה במקומות אחרים 33,34,35. מדידה של NO2–, S-nitrosothiols, חלבונים S-nitrosated ו- Fe-NOs יכולה להתבצע על ידי הוספת דגימות בתערובת תגובה עם טריודייד (I3–), אשר משחררת באופן סטואיכיומטרי גז NO מכל התרכובות הבאות:
אני3– → אני2 + אני–
2NO2− +2I− +4H+ → 2NO + I2 +2H2O
אני3− + 2RS-NO → 3I− + RSSR + 2NO+
2NO+ + 2I− → 2NO + I2
בעוד שאני3 – לא מגיב עם NO 3-15. מדידות מדויקות של כל תרכובת מתאפשרות על ידי טיפול מקדים באליקוטים לדוגמה עם סולפנילמיד חומצי (AS) עם או בלי כלוריד כספית (HgCl2). באופן ספציפי, טיפול מקדים עם AS מסיר את כל התוכן NO 2. כתוצאה מכך, תוכן ה-NO שנמדד על ידי ה-CLD משקף רק את סכום ריכוז ה-S-NOs וה-Fe-NOs. הזרקה של HgCl2 במדגם aliquot לפני הזרקת AS גורמת ל- NO2 – להשתחרר על ידי S-NO. טיפול ב-AS (המוביל להסרת NO2) מבטיח שתוכן ה-NO הנמדד משקף רק את הריכוז של Fe-NOs. סדרה של חיסורים בין ההערכות מאפשרת לחשב את הריכוז המדויק של שלוש נגזרות NO22.
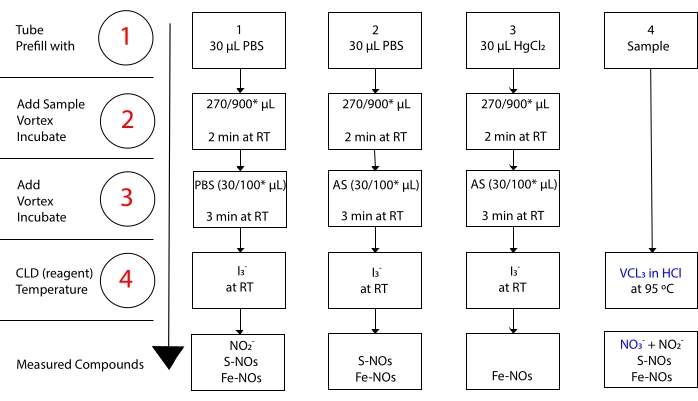
איור 3: שלבים בהכנת דגימה למבחן I3– בחומצה אצטית chemiluminescence. השלבים הרציפים להכנת הבדיקה I3– בחומצה אצטית chemiluminescence מודגמים. נדרש שימוש בצינורות צנטריפוגה מוגני אור. צינורות 1, 2 ו-3 הם אלה המשמשים להכנה לבדיקה. יש צורך בדגימה נוספת (צינור 4) לבדיקת VCl3 ב- HCl אם נדרשת מדידת חנקה (NO3–). השלבים מסומנים על ידי מספרים באדום. מילוי מראש (שלב 1) כפי שמצוין עם מלח מאגר פוספט (PBS) או HgCl2 לפני הוספת נפח הדגימה. הוסף את נפח הדגימה (2) כפי שצוין, מערבולת ודגירה למשך 2 דקות בטמפרטורת החדר (RT). הוסף (3) PBS או סולפנילמיד חומצי (AS) כפי שצוין, מערבולת, ודגירה במשך 3 דקות ב- RT. הפעל את הבדיקה (4). הריכוז הנמדד על ידי הבדיקה הוא סכום הריכוז של התרכובות המדווחות מתחת לכל צינור. צינור מספר 1 יאפשר מדידות של ניטריט (NO2–), S-nitrosothiols (S-NO) וקומפלקסים של ברזל-ניטרוזיל (Fe-NOs) כאות יחיד. עבור מדידת חנקה (NO3–), דגימות יופעלו הן עם I3– בחומצה אצטית והן עם VCl3 במבחני HCl, ויש להפחית את הערך המתקבל מצינור 1 מזה המתקבל מצינור 4. *הכמויות המוצעות שישמשו לניתוח Hb לקביעת שאריות NO2–, S-nitrosohemoglobin וברזל-ניטרוזיל-המוגלובין. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
למדידת NO3, ונדיום (III) כלוריד (VCl3) בחומצה הידרוכלורית (HCl) משמש להמרה של NO3– ל-NO בכלי הטיהור על מנת למדוד את NO3– באופן סטויכיומטרי עם CLD:
2 NO3–+ 3V+3 + 2H2O → 2NO + 3VO2+ + + 4H+
כדי להשיג המרה מהירה מספיק, התגובה צריכה להתבצע ב 90-95 מעלות צלזיוס. הפחתה מ- NO3 – ל- NO2 – מצטרפת להפחתה של NO2 – ל- NO על ידי HCl. מתכת ונדיום גם מפחיתה S-NOs המשחררת את ה- NO moiety22,36 שלהם. הריכוז הסופי המתקבל על ידי CLD עם VCl3 ב- HCl משקף את הריכוז המצטבר של NO3–, NO2 ותרכובות ניטרוס אחרות. חיסור הערך האחרון מהריכוז שהופק עם CLD עם I3– מאפשר חישוב של NO3– ריכוז36,37 (איור 3).
במבחן הצריכה NO, השחרור המתמשך של NO בכלי הטיהור על ידי תורמים ללא תורמים כמו (Z)-1-[2-(2-aminoethyl)-N-(2-אמוניואתיל)amino]diazen-1-ium-1,2-diolate (DETA-NONOate) יוצר אות יציב המאפשר כימות של oxyHb ללא תאים בדגימות המוזרקות. כמות ה- NO הנצרכת בכלי הטיהור נמצאת בקשר סטויכיומטרי עם כמות ה- oxyHb במדגם38.
פרוטוקולים למדידת NO2–, NO3–, S-nitrosothiols, קומפלקסים של ברזל-ניטרוזיל, ו-NO צריכה על ידי Hb ללא תאים בדגימות פלזמה מודגמים. מחקרים על NO בסביבת RBC דורשים טיפול מדגם ספציפי ואחריו כרומטוגרפיית הרחקה כדי למדוד S-NO-Hb ו-Hb-NO שבירים במיוחד יחד עם קביעת ריכוז ההמוגלובין הכולל של15,22. הכנת הדגימה תסייע בתיקון המדידה. קיום מקדים של NO2– ב-H 2O ושחרור של NO2– במהלך הבדיקה יכולים להוביל למדידה של ריכוזים גבוהים יותר באופן מלאכותי של נגזרות NO כגון S-NO-Hb14,39. כמו כן מוצגים היבטים חשובים של הכנת מדגם.
Protocol
Representative Results
Discussion
בשל הרגישות הגבוהה, בדיקות מבוססות כימילומינסנציה לקביעת NO ותרכובות קשורות יש סיכון גבוה לזיהום NO2. כל מגיב (במיוחדפתרון חסימת NO 2) ומדלל (כולל ddH2O) המשמשים בניסוי צריכים להיבדק לתוכן NO 2 – שלו כדי לתקן את אות הרקע. ניטריט הוא תגובתי ביותר עם זמן מחצית …
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
הפרוטוקולים המדווחים בכתב יד זה התאפשרו הודות לתרומתם המצטברת של עמיתים קודמים במעבדתו של ד”ר וורן זפול לחקר ההרדמה בטיפול קריטי, המחלקה להרדמה בבית החולים הכללי של מסצ’וסטס. אנו מכירים בתרומתם של ד”ר אקיטו נקגאווה, פרנצ’סקו זדק, עמנואלה ואסנה, צ’ונג ליי, יאסוקו נגאסאקה, אסתר ספאגנולי ועמנואלה רזואלי.
Materials
| Acetic Acid | Sigma | 45754 | 500 mL – liquid |
| Antifoam B Emulsion | Sigma | A5757 | 250 mL – liquid |
| DETA NONOate | Cayman | 82120 | 10 mg |
| Gibco DPBS (1x) no calcium, no magnesium | ThermoFisher | 14190144 | 500 mL |
| Hydroochloric Acid 37% (1 M) | Sigma | 258148 | 500 mL – liquid |
| Iodine | SAFC | 207772 | 100 g – solid |
| Kimwipes | Kimtech | 34155 | |
| Mercury (II) Chloride ACS reagent> 99.5% | Sigma | 215465 | 100 g – solid (dissolve in water) |
| Mili-Q Water Purification System | Millipore | ||
| Model 705 RN 50 μL syringe | Hamilton | 80530 | Microliter syringe |
| Model 802 N 25 μL Syringe | Hamilton | 84854 | Microliter syringe |
| N-ethylmaleimide | Sigma | 4260 | 25 g – crystalline |
| Nitric Oxide Analyzer + Bundle Software – Purge Vessel | Zysense | NOA 280i | Chemiluminescence Detector |
| Nonidet p-40 (NP-40) | ThermoFisher | 85125 | 10% – 500 mL |
| Potassium hexacyanoferrate (III) ACS reagent≥ 99% | Sigma | 244023 | 100 g – powder |
| Potassium Iodide ACS reagent> 99% | Sigma | 221945 | 100 g – solid |
| Potassium Nitrite cryst. For analysis EMSURE ACS | Supelco | 105067 | 250 g – crystalline |
| PowerGen 125 | Fisher Scientific | 14-359-251 | Mechanic Homogenizer |
| RV3 Two Stage Rotary Vane Pump | Edwards | A65201906 | Vacuum Pump – Bundled with analyzer |
| Sodium Heparin – BD Hemogard Clo | BD Biosciences | BD367871 | 75 USP Units |
| Sodium hydroxide anhydrous ACS reagent ≥ 97% | Sigma | 795429 | 1 kg – pelletts |
| Sodium Nitrate ACS reagent ≥ 99% | Sigma | 221341 | 500 g – powder |
| Sodium nitrite ≥ 99% | Sigma | S2252 | 500 g – crystalline |
| Sulfanilamide ≥ 98% | Sigma | S9251 | 100 g – solid |
| Vanadium (III) Chloride | Sigma | 112393 | 25 g – solid – Caution (exothermic) |
| Whatman 1 Filter Paper | Sigma | WHA10010155 |
Riferimenti
- Palmer, R. M. J., Ferrige, A. G., Moncada, S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature. 327 (6122), 524-526 (1987).
- Furchgott, R. F. The discovery of endothelium-derived relaxing factor and its importance in the identification of nitric oxide. JAMA: The Journal of the American Medical Association. 276 (14), 1186 (1996).
- Ignarro, L. J., Buga, G. M., Byrns, R. E., Wood, K. S., Chaudhuri, G. Endothelium-derived relaxing factor and nitric oxide possess identical pharmacologic properties as relaxants of bovine arterial and venous smooth muscle. The Journal of Pharmacology and Experimental Therapeutics. 246 (1), 218-226 (1998).
- Arnold, W. P., Mittal, C. K., Katsuki, S., Murad, F. Nitric oxide activates guanylate cyclase and increases guanosine 3′:5′-cyclic monophosphate levels in various tissue preparations. Proceedings of the National Academy of Sciences of the United States of America. 74 (8), 3203-3207 (1977).
- Hayashida, K., et al. Depletion of vascular nitric oxide contributes to poor outcomes after cardiac arrest. American Journal of Respiratory and Critical Care Medicine. 199 (10), 1288-1290 (2019).
- Ignarro, L. J. Inhaled NO and COVID-19. British Journal of Pharmacology. 177 (16), 3848-3849 (2020).
- Gantner, B. N., LaFond, K. M., Bonini, M. G. Nitric oxide in cellular adaptation and disease. Redox Biology. 34, 101550 (2020).
- Clark, R. H., et al. Low-dose nitric oxide therapy for persistent pulmonary hypertension of the newborn. New England Journal of Medicine. 342 (7), 469-474 (2000).
- Goldbart, A., et al. Inhaled nitric oxide therapy in acute bronchiolitis: A multicenter randomized clinical trial. Scientific Reports. 10 (1), (2020).
- Bangirana, P., et al. Inhaled nitric oxide and cognition in pediatric severe malaria: A randomized double-blind placebo controlled trial. PloS One. 13 (1), 0191550 (2018).
- Jiang, S., Dandu, C., Geng, X. Clinical application of nitric oxide in ischemia and reperfusion injury: A literature review. Brain Circulation. 6 (4), 248-253 (2020).
- Lei, C., et al. Nitric oxide decreases acute kidney injury and stage 3 chronic kidney disease after cardiac surgery. American Journal of Respiratory and Critical Care Medicine. 198 (10), 1279-1287 (2018).
- Kelm, M. Nitric oxide metabolism and breakdown. Biochimica et Biophysica Acta. 1411 (2-3), 273-289 (1999).
- Bryan, N. S., Grisham, M. B. Methods to detect nitric oxide and its metabolites in biological samples. Free Radical Biology and Medicine. 43 (5), 645-657 (2007).
- Macarthur, P. H., Shiva, S., Gladwin, M. T. Measurement of circulating nitrite and S-nitrosothiols by reductive chemiluminescence. Journal of Chromatography B. 851 (1-2), 93-105 (2007).
- Helms, C., Kim-Shapiro, D. B. Hemoglobin-mediated nitric oxide signaling. Free Radical Biology and Medicine. 61, 464-472 (2013).
- Kim-Shapiro, D. B., Schechter, A. N., Gladwin, M. T. Unraveling the reactions of nitric oxide, nitrite, and hemoglobin in physiology and therapeutics. Arteriosclerosis, Thrombosis, and Vascular Biology. 26 (4), 697-705 (2006).
- Rezoagli, E., et al. Pulmonary and systemic vascular resistances after cardiopulmonary bypass: role of hemolysis. Journal of Cardiothoracic and Vascular Anesthesia. 31 (2), 505-515 (2017).
- Shiva, S. Nitrite: A physiological store of nitric oxide and modulator of mitochondrial function. Redox Biology. 1 (1), 40-44 (2013).
- Lundberg, J. O., Weitzberg, E., Gladwin, M. T. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nature Reviews Drug Discovery. 7 (2), 156-167 (2008).
- Heinrich, T. A., Da Silva, R. S., Miranda, K. M., Switzer, C. H., Wink, D. A., Fukuto, J. M. Biological nitric oxide signalling: chemistry and terminology. British Journal of Pharmacology. 169 (7), 1417-1429 (2013).
- Yang, B. K., Vivas, E. X., Reiter, C. D., Gladwin, M. T. Methodologies for the sensitive and specific measurement of s -nitrosothiols, iron-nitrosyls, and nitrite in biological samples. Free Radical Research. 37 (1), 1-10 (2003).
- Hayashida, K., et al. Improvement in outcomes after cardiac arrest and resuscitation by inhibition of s-nitrosoglutathione reductase. Circulation. 139 (6), 815-827 (2019).
- Rodríguez-Ortigosa, C. M., et al. Biliary secretion of S-nitrosoglutathione is involved in the hypercholeresis induced by ursodeoxycholic acid in the normal rat. Hepatology. 52 (2), 667-677 (2010).
- Mitchell, D. A., Marletta, M. A. Thioredoxin catalyzes the S-nitrosation of the caspase-3 active site cysteine. Nature Chemical Biology. 1 (3), 154-158 (2005).
- Mannick, J. B., et al. Fas-induced caspase denitrosylation. Science. 284 (5414), 651-654 (1999).
- Choi, Y. -. B., et al. Molecular basis of NMDA receptor-coupled ion channel modulation by S-nitrosylation. Nature Neuroscience. 3 (1), 15-21 (2000).
- Eu, J. P., Sun, J., Xu, L., Stamler, J. S., Meissner, G. The skeletal muscle calcium release channel: Coupled O2 sensor and NO signaling functions. Cell. 102 (4), 499-509 (2000).
- Stamler, J. S., et al. Nitric oxide circulates in mammalian plasma primarily as an S-nitroso adduct of serum albumin. Proceedings of the National Academy of Sciences of the United States of America. 89 (16), 7674-7677 (1992).
- Dunham, A. J., Barkley, R. M., Sievers, R. E. Aqueous nitrite ion determination by selective reduction and gas phase nitric oxide chemiluminescence. Analytical Chemistry. 67 (1), 220-224 (1995).
- Hogg, N., Zielonka, J., Kalyanaraman, B., Ignarro, L. J., Freeman, B. A. Detection of Nitric Oxide and Peroxynitrite in Biological Systems: A State-of-the-Art Review. Nitric Oxide (Third Edition). , 23-44 (2017).
- Gudem, M., Hazra, A. Mechanism of the chemiluminescent reaction between nitric oxide and ozone. The Journal of Physical Chemistry A. 123 (4), 715-722 (2019).
- Ishibe, Y., Liu, R., Hirosawa, J., Kawamura, K., Yamasaki, K., Saito, N. Exhaled nitric oxide level decreases after cardiopulmonary bypass in adult patients. Critical Care Medicine. 28 (12), 3823-3827 (2000).
- American Thoracic Society, European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide, 2005. American Journal of Respiratory and Critical Care Medicine. 171 (8), 912-930 (2005).
- Cuthbertson, B. H., Stott, S. A., Webster, N. R. Exhaled nitric oxide as a marker of lung injury in coronary artery bypass surgery. British Journal of Anaesthesia. 89 (2), 247-250 (2002).
- Ewing, J. F., Janero, D. R. Specific S-nitrosothiol (thionitrite) quantification as solution nitrite after vanadium(III) reduction and ozone-chemiluminescent detection. Free Radical Biology and Medicine. 25 (4-5), 621-628 (1998).
- Braman, R. S., Hendrix, S. A. Nanogram nitrite and nitrate determination in environmental and biological materials by vanadium(III) reduction with chemiluminescence detection. Analytical Chemistry. 61 (24), 2715-2718 (1989).
- Wang, X., et al. Biological activity of nitric oxide in the plasmatic compartment. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11477-11482 (2004).
- Bryan, N. S., Rassaf, T., Rodriguez, J., Feelisch, M. Bound NO in human red blood cells: fact or artifact. Nitric Oxide. 10 (4), 221-228 (2004).
- Kida, K., Shirozu, K., Yu, B., Mandeville, J. B., Bloch, K. D., Ichinose, F. Beneficial effects of nitric oxide on outcomes after cardiac arrest and cardiopulmonary resuscitation in hypothermia-treated mice. Anesthesiology. 120 (4), 880-889 (2014).
- Gladwin, M. T., et al. S-Nitrosohemoglobin is unstable in the reductive erythrocyte environment and lacks O2/NO-linked allosteric function. The Journal of Biological Chemistry. 277 (31), 27818-27828 (2002).
- Feelisch, M., et al. and heme-nitros(yl)ation in biological tissues and fluids: implications for the fate of NO in vivo. The FASEB Journal. 16 (13), 1775-1785 (2002).
- Liu, T., et al. L-NAME releases nitric oxide and potentiates subsequent nitroglycerin-mediated vasodilation. Redox Biology. 26, 101238 (2019).
- Piknova, B., Park, J. W., Cassel, K. S., Gilliard, C. N., Schechter, A. N. Measuring nitrite and nitrate, metabolites in the nitric oxide pathway, in biological materials using the chemiluminescence method. Journal of Visualized Experiments: JoVE. (118), e54879 (2016).
- Keefer, L. K., Nims, R. W., Davies, K. M., Wink, D. A. 34;NONOates" (1-substituted diazen-1-ium-1,2-diolates) as nitric oxide donors: Convenient nitric oxide dosage forms. Methods in Enzymology. , 281-293 (1996).
- Nagababu, E., Rifkind, J. M. Measurement of plasma nitrite by chemiluminescence without interference of S-, N-nitroso and nitrated species. Free Radical Biology and Medicine. 42 (8), 1146-1154 (2007).
- Doctor, A., et al. Hemoglobin conformation couples erythrocyte S-nitrosothiol content to O2 gradients. Proceedings of the National Academy of Sciences of the United States of America. 102 (16), 5709-5714 (2005).
- Zhang, Y., Keszler, A., Broniowska, K. A., Hogg, N. Characterization and application of the biotin-switch assay for the identification of S-nitrosated proteins. Free Radical Biology and Medicine. 38 (7), 874-881 (2005).
- Davies, I. R., Zhang, X., Poole, R. K. Nitric Oxide Selective Electrodes. Methods in enzymology. , 63-95 (2008).
- Saito, J., et al. Comparison of fractional exhaled nitric oxide levels measured by different analyzers produced by different manufacturers. Journal of Asthma. 57 (11), 1216-1226 (2020).

