Saggi basati sulla chemiluminescenza per la rilevazione di ossido nitrico e suoi derivati da autoxidazione e composti nitrosi
Summary
Qui presentiamo protocolli per rilevare l’ossido nitrico e i suoi derivati biologicamente rilevanti utilizzando saggi basati sulla chemiluminescenza ad alta sensibilità.
Abstract
L’attività dell’ossido nitrico (NO) in vivo è il risultato combinato dei suoi effetti diretti, dell’azione dei suoi derivati generati dall’autossidazione dell’NO e degli effetti dei composti nitrosi. La misurazione dei metaboliti no è essenziale per studiare l’attività dell’NO sia a livello vascolare che in altri tessuti, specialmente nei contesti sperimentali in cui viene somministrato NO esogeno. I saggi di chemiluminescenza a base di ozono consentono misurazioni precise dei metaboliti NO e NO sia nei fluidi (inclusi plasma, omogeneizzati tissutali, colture cellulari) che nelle miscele di gas (ad esempio, respiro espirato). L’NO reagisce con l’ozono per generare biossido di azoto allo stato eccitato. La conseguente emissione luminosa permette il fotorilevamento e la generazione di un segnale elettrico che riflette il contenuto di NO del campione. Le aliquote dello stesso campione possono essere utilizzate per misurare specifici metaboliti NO, come nitrati, nitriti, S-nitrosotioli e complessi ferro-nitrosilici. Inoltre, l’NO consumato dall’emoglobina priva di cellule viene anche quantificato con l’analisi di chemiluminescenza. Viene fornita un’illustrazione di tutte queste tecniche.
Introduction
Da quando Salvador Moncada e i premi Nobel Robert Furchgott, Louis Ignarro e Ferid Murad hanno identificato l’ossido nitrico (NO) come il fattore di rilassamento derivato dall’endotelio (EDRF) precedentemente noto, il ruolo centrale dell’NO è stato stabilito in diversi meccanismi chiave che abbracciano la biologia vascolare, le neuroscienze, il metabolismo e la risposta dell’ospite 1,2,3,4,5,6,7 . La somministrazione esogena di gas NO è diventata un trattamento consolidato per l’insufficienza respiratoria dovuta all’ipertensione polmonare nel neonato8. Il gas di ossido nitrico è stato anche studiato per il trattamento dell’infezione da virus respiratorio sinciziale (RSV), della malaria e di altre malattie infettive, del danno da ischemia-riperfusione e per la prevenzione del danno renale acuto in pazienti sottoposti a cardiochirurgia 9,10,11,12. La necessità di tecniche di misurazione precise per valutare i livelli di NO, i suoi metaboliti e quelli delle sue proteine e composti bersaglio deriva da studi sia meccanicistici che interventistici.
A causa della sua elevata reattività, l’NO può subire reazioni diverse a seconda della matrice biologica in cui viene prodotto e/o rilasciato. In assenza di emoglobina (Hb) o altre ossi-emoproteine, l’NO viene ossidato quasi completamente a nitrito (NO2–).
2NO + O2 → 2NO2
NO2 + NO → N2O3
N2O3 + H2O → NO2– + H+
L’NO subisce prima l’autossidazione con ossigeno molecolare (O2) per produrre biossido di azoto (NO2) e reagisce con l’NO2 stesso per generare triossido di diazoto (N2O3). Una molecola di N2O3 reagisce con l’acqua (H2O) per formare due molecole di NO2– e un protone (H+)13. All’interno del sangue intero 14,15, NO e NO2– vengono rapidamente convertiti in nitrato (NO3–) poiché queste molecole reagiscono avidamente con i gruppi eme ossidati di Hb [Hb-Fe2+-O2 o ossiemoglobina (oxyHb)] per produrre NO3–. Questa reazione è accoppiata con la transizione del gruppo eme allo stato ferrico [Hb-Fe3+ o metaemoglobina (metHb)]:
Hb-Fe2+-O2 + NO → Hb-Fe3+ + NO3–
La barriera dei globuli rossi (RBC) e lo spazio immediatamente adiacente all’endotelio sono i principali fattori che limitano questa reazione e consentono a una piccola porzione di NO rilasciato dall’endotelio di agire come EDRF16,17. Infatti, l’Hb privo di cellule in circolazione è noto per interrompere la vasodilatazione in contesti sperimentali e clinici17,18. All’interno del RBC, a seconda dell’ossigenazione e della concentrazione di NO2–, una porzione di NO reagisce con la deossiemoglobina (Hb-Fe2+) per formare ferro-nitrosil Hb (Hb-Fe2+-NO o HbNO):
Hb-Fe2+ + NO → Hb-Fe2+-NO
Nell’RBC15,17, NO2– può formare Hb-Fe3+ riducendo Hb-Fe2+ portando al rilascio di NO, che a sua volta lega Hb-Fe2+-O 2 (preferenzialmente) o Hb-Fe2+.
La generazione di NO-derivati non deve essere considerata strettamente unidirezionale in quanto l’NO può essere rigenerato da NO2– e NO3– in vari tessuti e da diversi enzimi (ad esempio, da batteri intestinali o all’interno dei mitocondri, in particolare in condizioni ipossiche)19,20.
Una quantità variabile di NO prodotto (o somministrato) porta alla generazione a valle di S-nitrosotioli, principalmente mediante transnitrosazione tiolica da N2O3 in presenza di un nucleofilo che crea un intermedio donatore NO+ (Nuc-NO+-NO2–):
N2O3 + RS– → RS-NO + NO2–
Un’altra possibilità per la generazione di S-nitrosotioli è la nitrosilazione dei tioli ossidati (NO che reagisce con un tiolo ossidato):
RS• + NO → RS-NO
Questo meccanismo e l’ossidazione diretta del tiolo da parte di NO2 potrebbero essere possibili solo in condizioni molto specifiche descritte altrove21. Gli S-nitrosotioli vanno da molecole leggere come S-nitrosoglutatione a grandi proteine contenenti tiolo. La S-nitrosoemoglobina (S-NO-Hb) è formata dalla nitrosazione di un gruppo tiolo di un residuo di cisteina conservato nella catena β (β93C)22.
La generazione e il metabolismo degli S-nitrosotioli fanno parte di importanti meccanismi di regolazione. Gli esempi includono la regolazione di glutatione, caspasi, N-metil-D-aspartato (NMDA) e recettori della rianodina 23,24,25,26,27,28. Precedentemente considerata come uno dei principali mediatori della biologia dell’NO in vivo, l’albumina nitrosata (S-nitroso-albumina) sembra essere un trasportatore NO/NO+ senza alcuna specifica attività biologica aggiuntiva29.
Quando si misura la concentrazione di NO e dei suoi derivati da uno specifico campione biologico all’interno di una matrice biologica, è importante considerare caratteristiche come l’acidità, l’ossigenazione, la temperatura e la presenza di reagenti. Gli esempi includono donatori di NO esogeni somministrati e, nel contesto dell’infiammazione acuta, il perossido di idrogeno (H2O2) che reagisce con NO2 portando alla generazione di concentrazione supernormale di radicali liberi come il perossinitrito (ONOO–)21. Oltre al metodo analitico che viene impiegato, è fondamentale la fase preanalitica di preparazione e conservazione del campione. Le reazioni a valle che non rappresentano l’attività di NO in vivo devono essere previste, considerate e bloccate. Un esempio valido è l’instabilità di S-NO-Hb, che richiede un trattamento dedicato dei campioni di sangue quando è mirato per la misurazione22.
I saggi basati sulla chemiluminescenza sono il gold standard per rilevare i livelli di NO e dei suoi principali metaboliti [NO2–, NO3–, S-NO e complessi ferro-nitrosilici (Fe-NO)] in qualsiasi fluido biologico, compresi gli omogeneizzati tissutali30,31. Questi metodi si basano sul rivelatore di chemiluminescenza (CLD), un dispositivo che ospita la reazione di NO con l’ozono (O3), generando NO2 in uno stato eccitato (NO2•). Il rilassamento di NO2• provoca l’emissione di un fotone di luce che viene rilevato da un tubo fotomoltiplicatore, generando un segnale elettrico direttamente proporzionale al contenuto di NO della miscela di gas campionata32. È rappresentato uno schema semplificato del CLD.
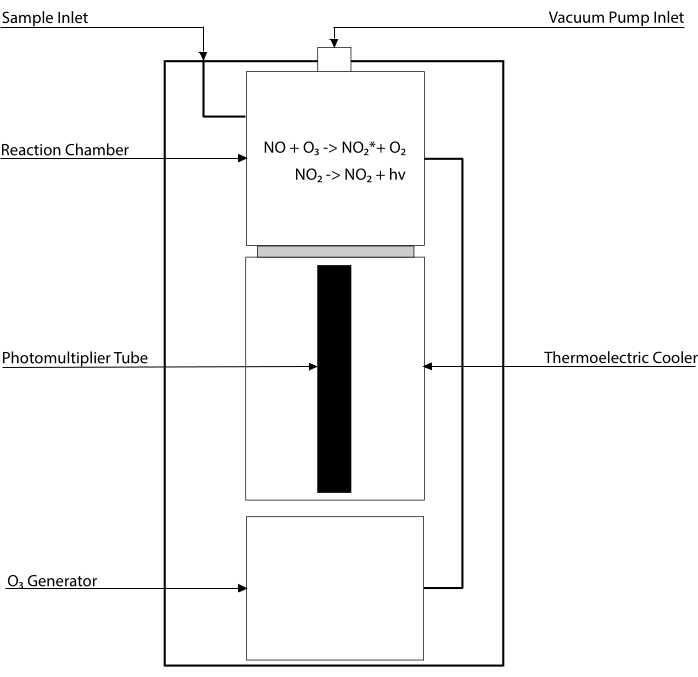
Figura 1: Schema semplificato di un rivelatore a chemiluminescenza per gas di ossido nitrico. Il rilevamento basato sulla chemiluminescenza dell’ossido nitrico (NO) è la generazione stechiometrica di un fotone per molecola di gas NO che viene introdotta nel rivelatore di chemiluminescenza (CLD). La reazione di chemiluminescenza è ottenuta in una camera designata alimentata con ozono (O3) da un generatore interno, che viene mantenuto a pressione negativa dal collegamento con una pompa esterna, consentendo un afflusso continuo e costante di gas campione. La generazione di O3 richiede ossigeno biatomico (O2) che viene fornito da un serbatoio O2 dedicato collegato al CLD (altri produttori forniscono CLD funzionanti con aria ambiente). All’interno della camera di reazione, ogni molecola di gas NO contenuta nel gas campionato reagisce con l’ossigeno per produrre una molecola di biossido di azoto allo stato attivato (NO2*). Tornando al suo stato fondamentale, ogni molecola di NO2* emette un fotone che viene rilevato da un tubo fotomoltiplicatore (PMT) situato adiacente alla camera di reazione. Il PMT con l’amplificatore associato e l’unità di elaborazione centrale produce un segnale proporzionale al conteggio dei fotoni e al numero di molecole di NO nella camera di reazione. Fare clic qui per visualizzare una versione più grande di questa figura.
L’ingresso del campione del CLD può essere collegato a un sistema di vetreria contenente una camera di reazione per campioni liquidi. Il sistema viene continuamente spurgato con un gas inerte come azoto, elio o argon, trasferendo NO dalla camera di reazione al CLD. I campioni in fase liquida vengono iniettati attraverso una membrana dedicata nel recipiente di spurgo.
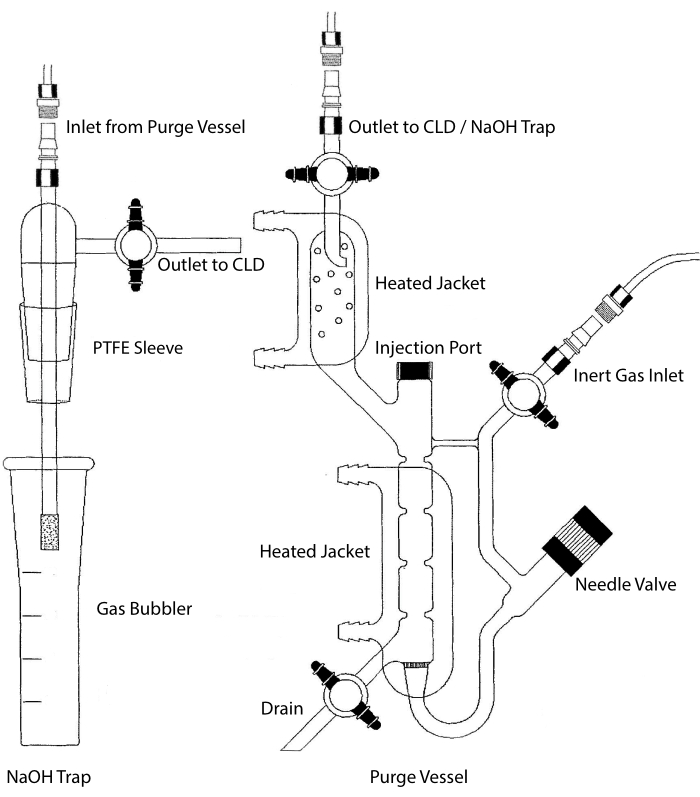
Figura 2: Struttura di un recipiente di spurgo per il rilevamento basato sulla chemiluminescenza del gas di ossido nitrico Il recipiente di spurgo (a destra) consente il rilevamento di gas di ossido nitrico (NO) o di qualsiasi altro composto che può essere facilmente convertito in gas NO quando rilasciato da un reagente in fase liquida. L’ingresso del gas inerte è collegato a una fonte (serbatoio) di un gas inerte come Argon, Xeon o azoto biatomico (N2). La valvola a spillo (si apre a sinistra) viene utilizzata per il controllo della pressione all’interno del recipiente di spurgo e può essere completamente rimossa per pulire la nave. La porta di iniezione è coperta da un cappuccio con un setto a membrana per l’iniezione del campione. La membrana deve essere sostituita spesso. Una camicia riscaldata circonda la camera di reazione ed è collegata a un bagno di acqua calda per eseguire il test VCl3 in HCl. L’uscita del recipiente di spurgo è collegata al rivelatore di chemiluminescenza (CLD) o alla trappola NaOH (necessaria per VCl3 nei saggi HCl). Per drenare il contenuto della camera di reazione, chiudere prima i rubinetti all’ingresso del gas inerte e all’uscita del recipiente di spurgo, chiudere la valvola a spillo, rimuovere il tappo alla porta di iniezione e infine aprire il rubinetto di arresto allo scarico. La trappola NaOH (a sinistra) deve essere posizionata in linea tra il recipiente di spurgo e il CLD se il VCl3 nel test HCl viene eseguito a causa della corrosività dell’HCl. Il collegamento al CLD richiede sempre un filtro dielettrico a campo intenso (IFD) da posizionare tra il CLD e l’uscita del recipiente di spurgo (o della trappola NaOH, se utilizzata). Il filtro IFD rimuove le particelle sospese nell’aria e impedisce al liquido di passare attraverso il recipiente di spurgo. PTFE = politetrafluoroetilene. Fare clic qui per visualizzare una versione più grande di questa figura.
Di conseguenza, qualsiasi composto che può essere convertito in NO attraverso una reazione chimica specifica e controllata può essere rilevato con elevata sensibilità in qualsiasi fluido biologico e omogeneizzato tissutale24. La misurazione diretta dell’NO in fase gassosa attraverso la chemiluminescenza viene eseguita sia in ambito sperimentale che clinico. Queste tecniche sono ampiamente descritte altrove 33,34,35. La misurazione di NO2–, S-nitrosotioli, proteine S-nitrosate e Fe-NO può essere eseguita aggiungendo campioni in una miscela di reazione con triioduro (I3–), che rilascia stechiometricamente gas NO da tutti questi composti:
I3– → I2 + I–
2NO2− +2I− +4H+ → 2NO + I2 +2H2O
I3− + 2RS-NO → 3I− + RSSR + 2NO+
2NO+ + 2I− → 2NO + I2
mentre I3– non reagisce con NO 3-15. Misurazioni precise di ciascun composto sono rese possibili dal pretrattamento di aliquote campione con sulfanilamide acidificata (AS) con o senza cloruro mercurico (HgCl2). In particolare, il pre-trattamento con AS rimuove tutto il contenuto di NO2. Di conseguenza, il contenuto di NO misurato dal CLD riflette solo la somma della concentrazione di S-NO e Fe-NOs. L’iniezione di HgCl2 in un’aliquota del campione prima dell’iniezione di AS provoca il rilascio di NO2– da parte di S-NO. Il trattamento con AS (che porta alla rimozione di NO2–) assicura che il contenuto di NO misurato rifletta solo la concentrazione di Fe-NO. Una serie di sottrazioni tra le valutazioni permettono di calcolare la concentrazione precisa dei tre derivati no22.
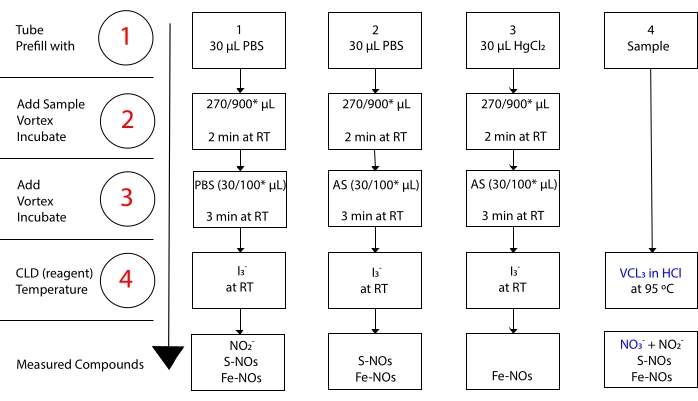
Figura 3: Fasi della preparazione del campione per il saggio di chemiluminescenza dell’acido acetico I3– in. Vengono illustrate le fasi sequenziali per la preparazione del saggio di chemiluminescenza dell’acido acetico I3– in acido acetico. È richiesto l’uso di tubi centrifughi protetti dalla luce. I tubi 1, 2 e 3 sono quelli utilizzati per preparare il test. Un’altra aliquota di campionamento (tubo 4) è necessaria per il VCl3 nel saggio HCl se è richiesta la misurazione del nitrato (NO3–). I passi sono indicati da numeri in rosso. Preriempire (Fase 1) come indicato con tampone fosfato salino (PBS) o HgCl2 prima di aggiungere il volume del campione. Aggiungere il volume del campione (2) come indicato, vortice e incubare per 2 minuti a temperatura ambiente (RT). Aggiungere (3) PBS o sulfanilamide acidificata (AS) come indicato, vortice e incubare per 3 minuti a RT. Eseguire il test (4). La concentrazione misurata dal saggio è la somma della concentrazione dei composti riportati sotto ciascun tubo. Il tubo numero 1 consentirà misurazioni di nitriti (NO2–), S-nitrosotioli (S-NO) e complessi ferro-nitrosilici (Fe-NO) come un singolo segnale. Per la misurazione dei nitrati (NO3–), i campioni devono essere eseguiti sia con I3– in acido acetico che con VCl3 nei saggi HCl, e il valore ottenuto dal tubo 1 deve essere sottratto da quello ottenuto dal tubo 4. *quantità suggerite da utilizzare per l’analisi dell’Hb per la determinazione dell’NO2 residuo, della S-nitrosoemoglobina e dell’emoglobina ferro-nitrosil-emoglobina. Fare clic qui per visualizzare una versione più grande di questa figura.
Per la misurazione dell’NO3– il cloruro di vanadio (III) (VCl3) in acido cloridrico (HCl) viene utilizzato per la conversione di NO3– in NO nel recipiente di spurgo al fine di misurare stechiometricamente l’NO3– con il CLD:
2 NO3–+ 3V+3 + 2H2O → 2NO + 3VO2+ + 4H+
Per ottenere una conversione sufficientemente veloce, la reazione deve essere eseguita a 90-95 °C. La riduzione da NO3– a NO2– è accoppiata con la riduzione di NO2– a NO da HCl. Il metallo vanadio riduce anche gli S-NO liberando la loro frazione di NO22,36. La concentrazione finale ottenuta da CLD con VCl3 in HCl riflette la concentrazione aggregata di NO3–, NO2 e altri composti nitrosi. La sottrazione di quest’ultimo valore dalla concentrazione prodotta con CLD con I3– consente il calcolo della concentrazione di NO3– 36,37 (Figura 3).
Nel test di consumo di NO, il rilascio continuo di NO nel vaso di spurgo da parte di donatori di NO come (Z)-1-[2-(2-amminoetil)-N-(2-ammonioetil)ammino]diazen-1-ium-1,2-diolato (DETA-NONOato) genera un segnale stabile che consente di quantificare l’ossiHb privo di cellule nei campioni iniettati. La quantità di NO consumata nel recipiente di spurgo è in una relazione stechiometrica con la quantità di oxyHb nel campione38.
Vengono illustrati i protocolli per la misurazione di NO2–, NO3-, S-nitrosotioli, complessi ferro-nitrosilici e consumo di NO da parte di Hb senza cellule in campioni di plasma. Gli studi sull’NO nell’ambiente RBC richiedono un trattamento specifico del campione seguito da cromatografia di esclusione per misurare S-NO-Hb e Hb-NO estremamente fragili accoppiati con la determinazione della concentrazione totale di Hb15,22. La preparazione del campione è strumentale alla correzione della misurazione. La preesistenza di NO2– in H2O e il rilascio di NO2– durante il test possono portare alla misurazione di concentrazioni artificialmente più elevate di derivati NO come S-NO-Hb14,39. Vengono inoltre presentati aspetti importanti della preparazione del campione.
Protocol
Representative Results
Discussion
A causa dell’elevata sensibilità, i saggi basati sulla chemiluminescenza per la determinazione dell’NO e dei composti correlati hanno un alto rischio di contaminazione da NO2-. Ogni reagente (in particolare la soluzione che blocca l’NO2) e il diluente (incluso il ddH2O) utilizzati nell’esperimento devono essere testati per il suo contenuto di NO2– per correggere il segnale di fondo. Il nitrito è estremamente reattivo con un’emivita nel sangue …
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
I protocolli riportati in questo manoscritto sono stati resi possibili dai contributi accumulati di precedenti borsisti del laboratorio di ricerca sull’anestesia in terapia intensiva del Dr. Warren Zapol, Dipartimento di Anestesia presso il Massachusetts General Hospital. Riconosciamo il contributo dei dottori Akito Nakagawa, Francesco Zadek, Emanuele Vassena, Chong Lei, Yasuko Nagasaka, Ester Spagnolli ed Emanuele Rezoagli.
Materials
| Acetic Acid | Sigma | 45754 | 500 mL – liquid |
| Antifoam B Emulsion | Sigma | A5757 | 250 mL – liquid |
| DETA NONOate | Cayman | 82120 | 10 mg |
| Gibco DPBS (1x) no calcium, no magnesium | ThermoFisher | 14190144 | 500 mL |
| Hydroochloric Acid 37% (1 M) | Sigma | 258148 | 500 mL – liquid |
| Iodine | SAFC | 207772 | 100 g – solid |
| Kimwipes | Kimtech | 34155 | |
| Mercury (II) Chloride ACS reagent> 99.5% | Sigma | 215465 | 100 g – solid (dissolve in water) |
| Mili-Q Water Purification System | Millipore | ||
| Model 705 RN 50 μL syringe | Hamilton | 80530 | Microliter syringe |
| Model 802 N 25 μL Syringe | Hamilton | 84854 | Microliter syringe |
| N-ethylmaleimide | Sigma | 4260 | 25 g – crystalline |
| Nitric Oxide Analyzer + Bundle Software – Purge Vessel | Zysense | NOA 280i | Chemiluminescence Detector |
| Nonidet p-40 (NP-40) | ThermoFisher | 85125 | 10% – 500 mL |
| Potassium hexacyanoferrate (III) ACS reagent≥ 99% | Sigma | 244023 | 100 g – powder |
| Potassium Iodide ACS reagent> 99% | Sigma | 221945 | 100 g – solid |
| Potassium Nitrite cryst. For analysis EMSURE ACS | Supelco | 105067 | 250 g – crystalline |
| PowerGen 125 | Fisher Scientific | 14-359-251 | Mechanic Homogenizer |
| RV3 Two Stage Rotary Vane Pump | Edwards | A65201906 | Vacuum Pump – Bundled with analyzer |
| Sodium Heparin – BD Hemogard Clo | BD Biosciences | BD367871 | 75 USP Units |
| Sodium hydroxide anhydrous ACS reagent ≥ 97% | Sigma | 795429 | 1 kg – pelletts |
| Sodium Nitrate ACS reagent ≥ 99% | Sigma | 221341 | 500 g – powder |
| Sodium nitrite ≥ 99% | Sigma | S2252 | 500 g – crystalline |
| Sulfanilamide ≥ 98% | Sigma | S9251 | 100 g – solid |
| Vanadium (III) Chloride | Sigma | 112393 | 25 g – solid – Caution (exothermic) |
| Whatman 1 Filter Paper | Sigma | WHA10010155 |
Riferimenti
- Palmer, R. M. J., Ferrige, A. G., Moncada, S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature. 327 (6122), 524-526 (1987).
- Furchgott, R. F. The discovery of endothelium-derived relaxing factor and its importance in the identification of nitric oxide. JAMA: The Journal of the American Medical Association. 276 (14), 1186 (1996).
- Ignarro, L. J., Buga, G. M., Byrns, R. E., Wood, K. S., Chaudhuri, G. Endothelium-derived relaxing factor and nitric oxide possess identical pharmacologic properties as relaxants of bovine arterial and venous smooth muscle. The Journal of Pharmacology and Experimental Therapeutics. 246 (1), 218-226 (1998).
- Arnold, W. P., Mittal, C. K., Katsuki, S., Murad, F. Nitric oxide activates guanylate cyclase and increases guanosine 3′:5′-cyclic monophosphate levels in various tissue preparations. Proceedings of the National Academy of Sciences of the United States of America. 74 (8), 3203-3207 (1977).
- Hayashida, K., et al. Depletion of vascular nitric oxide contributes to poor outcomes after cardiac arrest. American Journal of Respiratory and Critical Care Medicine. 199 (10), 1288-1290 (2019).
- Ignarro, L. J. Inhaled NO and COVID-19. British Journal of Pharmacology. 177 (16), 3848-3849 (2020).
- Gantner, B. N., LaFond, K. M., Bonini, M. G. Nitric oxide in cellular adaptation and disease. Redox Biology. 34, 101550 (2020).
- Clark, R. H., et al. Low-dose nitric oxide therapy for persistent pulmonary hypertension of the newborn. New England Journal of Medicine. 342 (7), 469-474 (2000).
- Goldbart, A., et al. Inhaled nitric oxide therapy in acute bronchiolitis: A multicenter randomized clinical trial. Scientific Reports. 10 (1), (2020).
- Bangirana, P., et al. Inhaled nitric oxide and cognition in pediatric severe malaria: A randomized double-blind placebo controlled trial. PloS One. 13 (1), 0191550 (2018).
- Jiang, S., Dandu, C., Geng, X. Clinical application of nitric oxide in ischemia and reperfusion injury: A literature review. Brain Circulation. 6 (4), 248-253 (2020).
- Lei, C., et al. Nitric oxide decreases acute kidney injury and stage 3 chronic kidney disease after cardiac surgery. American Journal of Respiratory and Critical Care Medicine. 198 (10), 1279-1287 (2018).
- Kelm, M. Nitric oxide metabolism and breakdown. Biochimica et Biophysica Acta. 1411 (2-3), 273-289 (1999).
- Bryan, N. S., Grisham, M. B. Methods to detect nitric oxide and its metabolites in biological samples. Free Radical Biology and Medicine. 43 (5), 645-657 (2007).
- Macarthur, P. H., Shiva, S., Gladwin, M. T. Measurement of circulating nitrite and S-nitrosothiols by reductive chemiluminescence. Journal of Chromatography B. 851 (1-2), 93-105 (2007).
- Helms, C., Kim-Shapiro, D. B. Hemoglobin-mediated nitric oxide signaling. Free Radical Biology and Medicine. 61, 464-472 (2013).
- Kim-Shapiro, D. B., Schechter, A. N., Gladwin, M. T. Unraveling the reactions of nitric oxide, nitrite, and hemoglobin in physiology and therapeutics. Arteriosclerosis, Thrombosis, and Vascular Biology. 26 (4), 697-705 (2006).
- Rezoagli, E., et al. Pulmonary and systemic vascular resistances after cardiopulmonary bypass: role of hemolysis. Journal of Cardiothoracic and Vascular Anesthesia. 31 (2), 505-515 (2017).
- Shiva, S. Nitrite: A physiological store of nitric oxide and modulator of mitochondrial function. Redox Biology. 1 (1), 40-44 (2013).
- Lundberg, J. O., Weitzberg, E., Gladwin, M. T. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nature Reviews Drug Discovery. 7 (2), 156-167 (2008).
- Heinrich, T. A., Da Silva, R. S., Miranda, K. M., Switzer, C. H., Wink, D. A., Fukuto, J. M. Biological nitric oxide signalling: chemistry and terminology. British Journal of Pharmacology. 169 (7), 1417-1429 (2013).
- Yang, B. K., Vivas, E. X., Reiter, C. D., Gladwin, M. T. Methodologies for the sensitive and specific measurement of s -nitrosothiols, iron-nitrosyls, and nitrite in biological samples. Free Radical Research. 37 (1), 1-10 (2003).
- Hayashida, K., et al. Improvement in outcomes after cardiac arrest and resuscitation by inhibition of s-nitrosoglutathione reductase. Circulation. 139 (6), 815-827 (2019).
- Rodríguez-Ortigosa, C. M., et al. Biliary secretion of S-nitrosoglutathione is involved in the hypercholeresis induced by ursodeoxycholic acid in the normal rat. Hepatology. 52 (2), 667-677 (2010).
- Mitchell, D. A., Marletta, M. A. Thioredoxin catalyzes the S-nitrosation of the caspase-3 active site cysteine. Nature Chemical Biology. 1 (3), 154-158 (2005).
- Mannick, J. B., et al. Fas-induced caspase denitrosylation. Science. 284 (5414), 651-654 (1999).
- Choi, Y. -. B., et al. Molecular basis of NMDA receptor-coupled ion channel modulation by S-nitrosylation. Nature Neuroscience. 3 (1), 15-21 (2000).
- Eu, J. P., Sun, J., Xu, L., Stamler, J. S., Meissner, G. The skeletal muscle calcium release channel: Coupled O2 sensor and NO signaling functions. Cell. 102 (4), 499-509 (2000).
- Stamler, J. S., et al. Nitric oxide circulates in mammalian plasma primarily as an S-nitroso adduct of serum albumin. Proceedings of the National Academy of Sciences of the United States of America. 89 (16), 7674-7677 (1992).
- Dunham, A. J., Barkley, R. M., Sievers, R. E. Aqueous nitrite ion determination by selective reduction and gas phase nitric oxide chemiluminescence. Analytical Chemistry. 67 (1), 220-224 (1995).
- Hogg, N., Zielonka, J., Kalyanaraman, B., Ignarro, L. J., Freeman, B. A. Detection of Nitric Oxide and Peroxynitrite in Biological Systems: A State-of-the-Art Review. Nitric Oxide (Third Edition). , 23-44 (2017).
- Gudem, M., Hazra, A. Mechanism of the chemiluminescent reaction between nitric oxide and ozone. The Journal of Physical Chemistry A. 123 (4), 715-722 (2019).
- Ishibe, Y., Liu, R., Hirosawa, J., Kawamura, K., Yamasaki, K., Saito, N. Exhaled nitric oxide level decreases after cardiopulmonary bypass in adult patients. Critical Care Medicine. 28 (12), 3823-3827 (2000).
- American Thoracic Society, European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide, 2005. American Journal of Respiratory and Critical Care Medicine. 171 (8), 912-930 (2005).
- Cuthbertson, B. H., Stott, S. A., Webster, N. R. Exhaled nitric oxide as a marker of lung injury in coronary artery bypass surgery. British Journal of Anaesthesia. 89 (2), 247-250 (2002).
- Ewing, J. F., Janero, D. R. Specific S-nitrosothiol (thionitrite) quantification as solution nitrite after vanadium(III) reduction and ozone-chemiluminescent detection. Free Radical Biology and Medicine. 25 (4-5), 621-628 (1998).
- Braman, R. S., Hendrix, S. A. Nanogram nitrite and nitrate determination in environmental and biological materials by vanadium(III) reduction with chemiluminescence detection. Analytical Chemistry. 61 (24), 2715-2718 (1989).
- Wang, X., et al. Biological activity of nitric oxide in the plasmatic compartment. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11477-11482 (2004).
- Bryan, N. S., Rassaf, T., Rodriguez, J., Feelisch, M. Bound NO in human red blood cells: fact or artifact. Nitric Oxide. 10 (4), 221-228 (2004).
- Kida, K., Shirozu, K., Yu, B., Mandeville, J. B., Bloch, K. D., Ichinose, F. Beneficial effects of nitric oxide on outcomes after cardiac arrest and cardiopulmonary resuscitation in hypothermia-treated mice. Anesthesiology. 120 (4), 880-889 (2014).
- Gladwin, M. T., et al. S-Nitrosohemoglobin is unstable in the reductive erythrocyte environment and lacks O2/NO-linked allosteric function. The Journal of Biological Chemistry. 277 (31), 27818-27828 (2002).
- Feelisch, M., et al. and heme-nitros(yl)ation in biological tissues and fluids: implications for the fate of NO in vivo. The FASEB Journal. 16 (13), 1775-1785 (2002).
- Liu, T., et al. L-NAME releases nitric oxide and potentiates subsequent nitroglycerin-mediated vasodilation. Redox Biology. 26, 101238 (2019).
- Piknova, B., Park, J. W., Cassel, K. S., Gilliard, C. N., Schechter, A. N. Measuring nitrite and nitrate, metabolites in the nitric oxide pathway, in biological materials using the chemiluminescence method. Journal of Visualized Experiments: JoVE. (118), e54879 (2016).
- Keefer, L. K., Nims, R. W., Davies, K. M., Wink, D. A. 34;NONOates" (1-substituted diazen-1-ium-1,2-diolates) as nitric oxide donors: Convenient nitric oxide dosage forms. Methods in Enzymology. , 281-293 (1996).
- Nagababu, E., Rifkind, J. M. Measurement of plasma nitrite by chemiluminescence without interference of S-, N-nitroso and nitrated species. Free Radical Biology and Medicine. 42 (8), 1146-1154 (2007).
- Doctor, A., et al. Hemoglobin conformation couples erythrocyte S-nitrosothiol content to O2 gradients. Proceedings of the National Academy of Sciences of the United States of America. 102 (16), 5709-5714 (2005).
- Zhang, Y., Keszler, A., Broniowska, K. A., Hogg, N. Characterization and application of the biotin-switch assay for the identification of S-nitrosated proteins. Free Radical Biology and Medicine. 38 (7), 874-881 (2005).
- Davies, I. R., Zhang, X., Poole, R. K. Nitric Oxide Selective Electrodes. Methods in enzymology. , 63-95 (2008).
- Saito, J., et al. Comparison of fractional exhaled nitric oxide levels measured by different analyzers produced by different manufacturers. Journal of Asthma. 57 (11), 1216-1226 (2020).

