Chemiluminescence-baserte analyser for påvisning av nitrogenoksid og dets derivater fra autoxidasjon og nitroserte forbindelser
Summary
Her presenterer vi protokoller for å oppdage nitrogenoksid og dets biologisk relevante derivater ved hjelp av chemiluminescensbaserte analyser med høy følsomhet.
Abstract
Nitrogenoksid (NO) aktivitet in vivo er de kombinerte resultatene av sine direkte effekter, virkningen av dets derivater generert fra INGEN autoxidasjon, og effekten av nitroserte forbindelser. Måling av NO metabolitter er avgjørende for å studere INGEN aktivitet både på vaskulære nivåer og i andre vev, spesielt i eksperimentelle omgivelser der eksogen NO administreres. Ozonbaserte chemiluminescensanalyser tillater presise målinger av NO- og NO-metabolitter i begge væsker (inkludert plasma, vevshomogenater, cellekulturer) og gassblandinger (f.eks. utåndet pust). NO reagerer med ozon for å generere nitrogendioksid i en opphisset tilstand. Det påfølgende lysutslippet tillater fotodeteksjon og generering av et elektrisk signal som reflekterer NO-innholdet i prøven. Aliquots fra samme prøve kan brukes til å måle spesifikke NO metabolitter, for eksempel nitrat, nitritt, S-nitrosothioler og jern-nitrosylkomplekser. I tillegg er NO konsumert av cellefritt hemoglobin også kvantifisert med chemiluminescensanalyse. En illustrasjon av alle disse teknikkene er gitt.
Introduction
Siden Salvador Moncada og nobelprisvinnerne Robert Furchgott, Louis Ignarro og Ferid Murad identifiserte nitrogenoksid (NO) som den tidligere kjente endotel-avledede avslapningsfaktoren (EDRF), har den sentrale rollen til NO blitt etablert i flere viktige mekanismer som spenner over vaskulær biologi, nevrovitenskap, metabolisme og vertsrespons 1,2,3,4,5,6,7 . Eksogen administrering av NO-gass har blitt en etablert behandling for respirasjonssvikt på grunn av pulmonal hypertensjon hos nyfødte8. Nitrogenoksidgass har også blitt undersøkt for behandling av respiratorisk synytialvirusinfeksjon (RSV), malaria og andre infeksjonssykdommer, iskemi-reperfusjonsskade, og for forebygging av akutt nyreskade hos pasienter som gjennomgår hjertekirurgi 9,10,11,12. Behovet for presise måleteknikker for å vurdere nivåene av NO, dets metabolitter, og de av målproteiner og forbindelser oppstår fra både mekanistiske og intervensjonelle studier.
På grunn av sin høye reaktivitet kan NO gjennomgå forskjellige reaksjoner avhengig av den biologiske matrisen den produseres og/eller frigjøres i. I fravær av hemoglobin (Hb) eller andre oksy-hemoproteiner oksideres NO nesten helt til nitritt (NO2–).
2NO + O2 → 2NO2
NO2 + NO → N2O3
N2O3 + H2O → NR2– + H+
NO gjennomgår først autoxidasjon med molekylært oksygen (O2) for å gi nitrogendioksid (NO2) og reagerer med NO2 selv for å generere dinitrogentrioksid (N2O3). Ett molekyl av N2O3 reagerer med vann (H2O) for å danne to molekyler av NO2– og en proton (H+)13. Innen fullblods14,15, NEI og NO2– konverteres raskt til nitrat (NO3–) da disse molekylene reagerer ivrig med de oksiderte hemegruppene hb [Hb-Fe2 +-O2 eller oksyhemoglobin (oksyHb)] for å gi NO3–. Denne reaksjonen er kombinert med overgangen av heme-gruppen til ferric-tilstanden [Hb-Fe3+ eller methemoglobin (metHb)]:
Hb-Fe2+-O2 + NO → Hb-Fe3+ + NO3–
Den røde blodlegemer (RBC) barrieren og rommet rett ved siden av endotelet er de viktigste faktorene som begrenser denne reaksjonen og tillater en liten del av NO frigjort av endotelet å fungere som EDRF16,17. Faktisk er cellefri Hb i sirkulasjonen kjent for å forstyrre vasodilatasjon i eksperimentelle og kliniske omgivelser17,18. Innenfor RBC, avhengig av oksygenering og NO 2-konsentrasjon, reagerer en del av NO med deoksyhemoglobin (Hb-Fe2+) for å danne jern-nitrosyl Hb (Hb-Fe2+-NO eller HbNO):
Hb-Fe2+ + NO → Hb-Fe2+-NO
I RBC15,17 kan NO2– danne Hb-Fe3+ ved å redusere Hb-Fe2+ som fører til utgivelsen av NO, som igjen binder Hb-Fe2 +-O2 (fortrinnsvis) eller Hb-Fe2+.
Genereringen av NO-derivater bør ikke betraktes som strengt enveis, da NO kan regenereres fra NO2– og NO3– i ulike vev og av forskjellige enzymer (f.eks. ved tarmbakterier eller innen mitokondrier, spesielt under hypoksiske forhold)19,20.
En variabel mengde NO produsert (eller administrert) fører til nedstrøms generering av S-nitrosothioler, hovedsakelig ved tioltransnitrosasjon fra N2O3 i nærvær av en nukleofil som skaper en NO + donor mellomliggende (Nuc-NO + -NO2–):
N2O3 + RS– → RS-NO + NO2–
En annen mulighet for S-nitrosothiols generasjon er nitrosylering av oksiderte tioler (INGEN reagerer med en oksidert tiol):
RS• + NO → RS-NO
Denne mekanismen og direkte tioloksidasjon ved NO2 kan bare være mulig under svært spesifikke forhold som er beskrevet andre steder21. S-nitrosothioler spenner fra lette molekyler som S-nitrosoglutathione til store tiolholdige proteiner. S-nitrosohemoglobin (S-NO-Hb) dannes ved nitrosasjon av en tiolgruppe av en konservert cysteinrester i β-kjeden (β93C)22.
Generering og metabolisme av S-nitrosothioler er en del av viktige regulatoriske mekanismer. Eksempler er regulering av glutathione, caspaser, N-metyl-D-Aspartat (NMDA) og ryanodinreseptorer 23,24,25,26,27,28. Tidligere ansett som en stor formidler av NO biologi in vivo, nitrosated albumin (S-nitroso-albumin) synes å være en NO / NO + transportør uten noen spesifikk ekstra biologisk aktivitet29.
Ved måling av konsentrasjonen av NO og dets derivater fra en bestemt biologisk prøve i en biologisk matrise, er det viktig å vurdere egenskaper som surhet, oksygenering, temperatur og tilstedeværelse av reagenser. Eksempler er administrerte eksogene NO-donorer, og i innstillingen av akutt betennelse reagerer hydrogenperoksid (H2O2) med NO2 som fører til generering av supernormal konsentrasjon av frie radikaler som peroksynitritt (ONOO–)21. I tillegg til den analytiske metoden som brukes, er den preanalytiske fasen av prøvepreparering og lagring grunnleggende. Nedstrømsreaksjoner som ikke representerer in vivo NO-aktiviteten skal forutsies, vurderes og blokkeres. Et gyldig eksempel er ustabiliteten til S-NO-Hb, som krever en dedikert behandling av blodprøver når den er rettet mot måling22.
Chemiluminescence-baserte analyser er gullstandarden for å oppdage nivåene av NO og dens viktigste metabolitter [NO2–, NO3–, S-NO og iron-nitrosylkomplekser (Fe-NO)] i enhver biologisk væske, inkludert vev homogenater30,31. Disse metodene er avhengige av chemiluminescence detector (CLD), en enhet som huser reaksjonen av NO med ozon (O3), og genererer NO2 i en spent tilstand (NO2•). Avslapping av NO2• forårsaker utslipp av en foton av lys som oppdages av et fotomultiplierrør, og genererer et elektrisk signal som er direkte proporsjonalt med NO-innholdet i den prøvede gassblandingen32. Et forenklet skjema av CLD er representert.
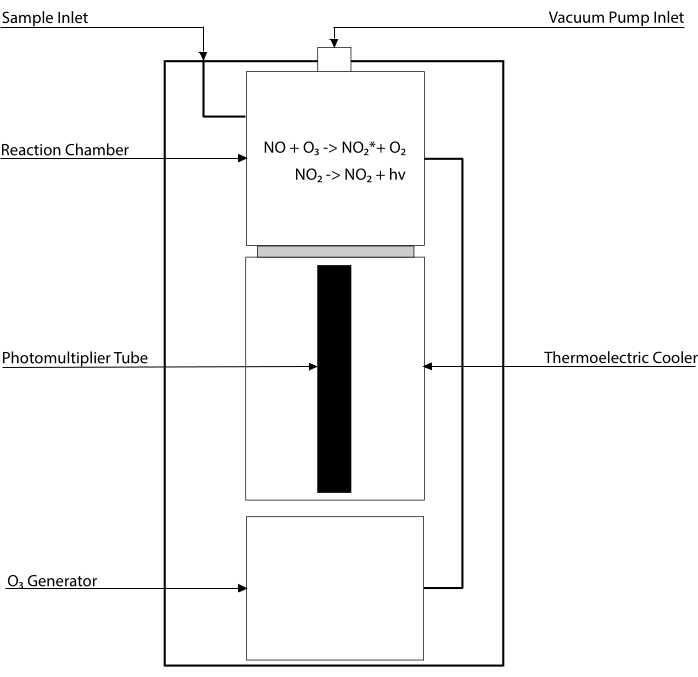
Figur 1: Forenklet skjematisk for en chemiluminescensdetektor for nitrogenoksidgass. Chemiluminescence-basert deteksjon av nitrogenoksid (NO) er den stoichiometriske generasjonen av ett foton per NO gassmolekyl som introduseres i chemiluminescence detector (CLD). Chemiluminescensreaksjonen oppnås i et utpekt kammer som leveres med ozon (O3) fra en intern generator, som holdes ved negativt trykk ved forbindelse med en ekstern pumpe, noe som tillater kontinuerlig og konstant tilstrømning av prøvegass. Genereringen av O3 krever diatomisk oksygen (O2) som leveres av en dedikert O2-tank koblet til CLD (andre produsenter gir CLDer som opererer med omgivelsesluft). Innenfor reaksjonskammeret reagerer hvert molekyl av INGEN gass i prøvegassen med oksygen for å gi ett molekyl nitrogendioksid i aktivert tilstand (NO2*). Ved å gå tilbake til sin bakketilstand avgir hvert NO2* molekyl en foton som oppdages av et fotomultiplierrør (PMT) som ligger ved siden av reaksjonskammeret. PMT med tilhørende forsterker og sentral prosesseringsenhet produserer et signal proporsjonalt med fotontallet og antall NO-molekyler i reaksjonskammeret. Klikk her for å se en større versjon av denne figuren.
Prøveinntaket til CLD kan kobles til et glassrørsystem som inneholder et reaksjonskammer for væskeprøver. Systemet renses kontinuerlig med en inert gass som nitrogen, helium eller argon, og overfører NEI fra reaksjonskammeret til CLD. Væskefaseprøver injiseres gjennom en dedikert membran inn i rensebeholderen.
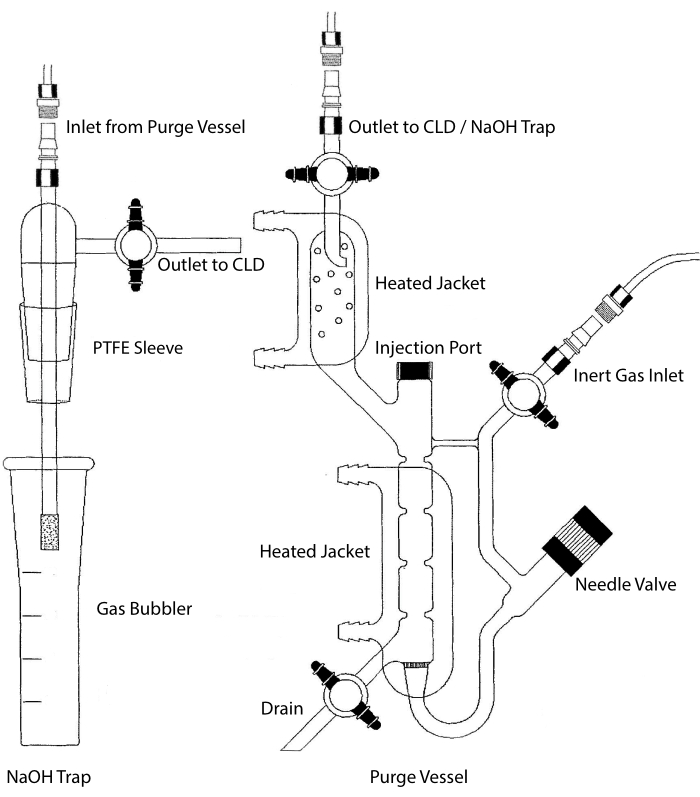
Figur 2: Struktur av et rensekar for chemiluminescensbasert påvisning av nitrogenoksidgass Rensebeholderen (høyre) gjør det mulig å påvise nitrogenoksid (NO) gass eller annen forbindelse som lett kan omdannes til INGEN gass når den slippes ut fra et flytende fasereagens. Det inert gassinntaket er koblet til en kilde (tank) av en inert gass som Argon, Xeon eller diatomisk nitrogen (N2). Nåleventilen (åpnes til venstre) brukes til trykkregulering i rensebeholderen og kan fjernes helt for å rengjøre fartøyet. Injeksjonsporten er dekket av en hette med en membran septum for prøveinjeksjon. Membranen bør byttes ofte ut. En oppvarmet jakke omgir reaksjonskammeret og er koblet til et varmtvannsbad for å utføre VCl3 i HCl-analysen. Utløpet av rensebeholderen er koblet til chemiluminescensdetektoren (CLD) eller naoh-fellen (kreves for VCl3 i HCl-analyser). For å tømme innholdet i reaksjonskammeret må du først lukke stoppekranene ved det inerte gassinntaket og rensekarutløpet, lukke nåleventilen, fjerne hetten ved injeksjonsporten og til slutt åpne stoppekranen ved avløpet. NaOH-fellen (til venstre) må plasseres linjebundet mellom rensebeholderen og CLD hvis VCl3 i HCl-analysen utføres på grunn av korrosjonen til HCl. Forbindelsen til CLD krever alltid at et intenst felt dielektrisk (IFD) filter skal plasseres mellom CLD og utgangen av rensebeholderen (eller NaOH-fellen, hvis det brukes). IFD-filteret fjerner luftbårne partikler og stopper væske fra å passere gjennom rensebeholderen. PTFE = polytetrafluoretylen. Klikk her for å se en større versjon av denne figuren.
Som en konsekvens kan enhver forbindelse som kan konverteres til NEI gjennom en bestemt og kontrollert kjemisk reaksjon oppdages med høy følsomhet i enhver biologisk væske og vev homogenat24. Direkte måling av gassfase NO gjennom chemiluminescens utføres i både eksperimentelle og kliniske omgivelser. Disse teknikkene er omfattende beskrevet andre steder 33,34,35. Måling av NO2–, S-nitrosothiols, S-nitroserte proteiner og Fe-NOs kan utføres ved å legge til prøver i en reaksjonsblanding med triiodid (I3–), som stoichiometisk frigjør INGEN gass fra alle disse forbindelsene:
Jeg3– → jeg2 + jeg–
2NO2− +2I− +4H+ → 2NO + I2 +2H2O
I3− + 2RS-NO → 3I− + RSSR + 2NO+
2NO+ + 2I− → 2NO + I2
mens jeg3– reagerer ikke med NO 3-15. Nøyaktige målinger av hver forbindelse er muliggjort ved forbehandling av prøve aliquots med surgjort sulfanilamid (AS) med eller uten mercuric klorid (HgCl2). Spesielt fjerner forbehandling med AS alt NO 2-innhold. Som en konsekvens av dette gjenspeiler NO-innholdet målt ved CLD bare summen av S-NOer og Fe-NOs konsentrasjon. Injeksjon av HgCl2 i en prøve aliquot før AS injeksjon fører til at NO2– frigjøres av S-NO. Behandling med AS (som fører til NO2– fjerning) sikrer at det målte NO-innholdet bare gjenspeiler konsentrasjonen av Fe-NOer. En rekke subtraksjoner mellom vurderingene gjør det mulig å beregne den nøyaktige konsentrasjonen av de tre NO-derivatene22.
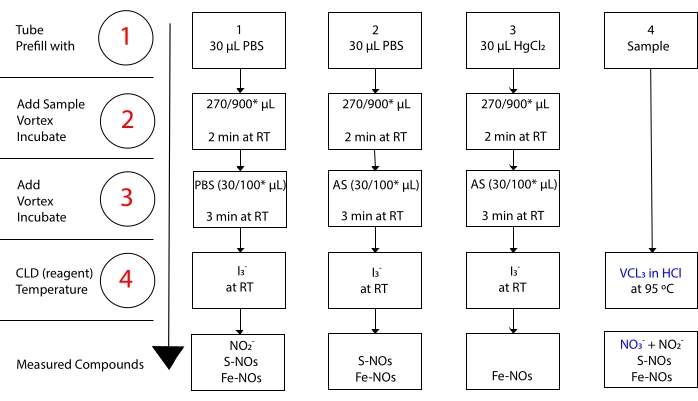
Figur 3: Trinn i prøvepreparering for I 3-i-eddiksyre chemiluminescence-analysen. De sekvensielle trinnene for fremstilling av I 3-i eddiksyre chemiluminescence-analysen er illustrert. Bruk av lysbeskyttede sentrifugerør er nødvendig. Rør 1, 2 og 3 er de som brukes til å forberede seg på analysen. En annen prøve aliquot (rør 4) er nødvendig for VCl3 i HCl-analysen hvis måling av nitrat (NO3–) er nødvendig. Trinnene angis med tall i rødt. Forhåndsutfylling (trinn 1) som indikert med fosfatbuffersark (PBS) eller HgCl2 før prøvevolumet tilsettes. Tilsett prøvevolumet (2) som angitt, virvel og inkuber i 2 minutter ved romtemperatur (RT). Tilsett (3) PBS eller surgjort sulfanilamid (AS) som indikert, virvel og inkuber i 3 min ved RT. Kjør analysen (4). Konsentrasjonen målt ved analysen er summen av konsentrasjonen av forbindelsene som rapporteres under hvert rør. Rør nummer 1 vil tillate målinger av nitritt (NO2–), S-nitrosothiols (S-NO) og jern-nitrosylkomplekser (Fe-NOs) som et enkelt signal. For nitratmåling (NO3-) skal prøver kjøres med både I3– i eddiksyre og VCl3 i HCl-analyser, og verdien oppnådd fra rør 1 skal trekkes fra den som er oppnådd fra rør 4. *foreslåtte mengder som skal brukes til Hb-analyse for bestemmelse av rest no2–, S-nitrosohemoglobin og jern-nitrosyl-hemoglobin. Klikk her for å se en større versjon av denne figuren.
For NO 3-måling brukes Vanadium (III) klorid (VCl3) i saltsyre (HCl) til konvertering av NO3– til NO i rensebeholderen for å måle NO 3-stoichiometrisk med CLD:
2 NO3–+ 3V+3 + 2H2O → 2NO + 3VO2+ + 4H+
For å oppnå en tilstrekkelig rask konvertering må reaksjonen utføres ved 90-95 °C. Reduksjon fra NO3– til NO2– kombineres med reduksjon av NO2– til NO av HCl. Vanadium metall reduserer også S-NOs frigjøre sin NO moiety22,36. Den endelige konsentrasjonen oppnådd av CLD med VCl3 i HCl gjenspeiler den samlede konsentrasjonen av NO3–, NO2 og andre nitroserte forbindelser. Subtraksjon av sistnevnte verdi fra konsentrasjonen gitt med CLD med I3– tillater beregning av NO 3-konsentrasjon 36,37 (figur 3).
I NO-forbruksanalysen genererer den kontinuerlige frigjøringen av NO i rensefartøyet av NO-givere som (Z)-1-[2-(2-aminoethyl)-N-(2-ammonioethyl)amino]diazen-1-ium-1,2-diolat (DETA-NONOate) et stabilt signal som tillater kvantifisering av cellefri oksyHb i de injiserte prøvene. Mengden NO som forbrukes i rensebeholderen er i et stoichiometrisk forhold til mengden oksyHb iprøven 38.
Protokoller for måling av NO2–, NO3–, S-nitrosothiols, jern-nitrosylkomplekser og INGEN forbruk ved cellefri Hb i plasmaprøver er illustrert. Studier på NO i RBC-miljøet krever spesifikk prøvebehandling etterfulgt av eksklusjonskromatografi for å måle ekstremt skjøre S-NO-Hb og Hb-NO kombinert med bestemmelse av total Hb-konsentrasjon15,22. Prøvepreparering er medvirkende til å korrigere måling. Pre-eksistens av NO2– i H2O og frigjøring av NO2– under analysen kan føre til måling av kunstig høyere konsentrasjoner av NO derivater som S-NO-Hb14,39. Viktige aspekter ved prøveforberedelse presenteres også.
Protocol
Representative Results
Discussion
På grunn av den høye følsomheten har chemiluminescensbaserte analyser for bestemmelse av NO og relaterte forbindelser en høy risiko for NO 2-forurensning. Hvert reagens (spesielt NO 2-blokkerende løsning) og fortynningsmiddel (inkludert ddH2O) som brukes i eksperimentet, bør testes for no 2-innhold for å korrigere for bakgrunnssignal. Nitritt er ekstremt reaktiv med en halveringstid i fullblod rundt 10 min og genererer raskt NO3</sub…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Protokollene som ble rapportert i dette manuskriptet ble muliggjort av de akkumulerte bidragene fra tidligere stipendiater ved Dr. Warren Zapols laboratorium for anestesiforskning i kritisk omsorg, Anestesidepartementet ved Massachusetts General Hospital. Vi anerkjenner bidraget fra Dr. Akito Nakagawa, Francesco Zadek, Emanuele Vassena, Chong Lei, Yasuko Nagasaka, Ester Spagnolli og Emanuele Rezoagli.
Materials
| Acetic Acid | Sigma | 45754 | 500 mL – liquid |
| Antifoam B Emulsion | Sigma | A5757 | 250 mL – liquid |
| DETA NONOate | Cayman | 82120 | 10 mg |
| Gibco DPBS (1x) no calcium, no magnesium | ThermoFisher | 14190144 | 500 mL |
| Hydroochloric Acid 37% (1 M) | Sigma | 258148 | 500 mL – liquid |
| Iodine | SAFC | 207772 | 100 g – solid |
| Kimwipes | Kimtech | 34155 | |
| Mercury (II) Chloride ACS reagent> 99.5% | Sigma | 215465 | 100 g – solid (dissolve in water) |
| Mili-Q Water Purification System | Millipore | ||
| Model 705 RN 50 μL syringe | Hamilton | 80530 | Microliter syringe |
| Model 802 N 25 μL Syringe | Hamilton | 84854 | Microliter syringe |
| N-ethylmaleimide | Sigma | 4260 | 25 g – crystalline |
| Nitric Oxide Analyzer + Bundle Software – Purge Vessel | Zysense | NOA 280i | Chemiluminescence Detector |
| Nonidet p-40 (NP-40) | ThermoFisher | 85125 | 10% – 500 mL |
| Potassium hexacyanoferrate (III) ACS reagent≥ 99% | Sigma | 244023 | 100 g – powder |
| Potassium Iodide ACS reagent> 99% | Sigma | 221945 | 100 g – solid |
| Potassium Nitrite cryst. For analysis EMSURE ACS | Supelco | 105067 | 250 g – crystalline |
| PowerGen 125 | Fisher Scientific | 14-359-251 | Mechanic Homogenizer |
| RV3 Two Stage Rotary Vane Pump | Edwards | A65201906 | Vacuum Pump – Bundled with analyzer |
| Sodium Heparin – BD Hemogard Clo | BD Biosciences | BD367871 | 75 USP Units |
| Sodium hydroxide anhydrous ACS reagent ≥ 97% | Sigma | 795429 | 1 kg – pelletts |
| Sodium Nitrate ACS reagent ≥ 99% | Sigma | 221341 | 500 g – powder |
| Sodium nitrite ≥ 99% | Sigma | S2252 | 500 g – crystalline |
| Sulfanilamide ≥ 98% | Sigma | S9251 | 100 g – solid |
| Vanadium (III) Chloride | Sigma | 112393 | 25 g – solid – Caution (exothermic) |
| Whatman 1 Filter Paper | Sigma | WHA10010155 |
Riferimenti
- Palmer, R. M. J., Ferrige, A. G., Moncada, S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature. 327 (6122), 524-526 (1987).
- Furchgott, R. F. The discovery of endothelium-derived relaxing factor and its importance in the identification of nitric oxide. JAMA: The Journal of the American Medical Association. 276 (14), 1186 (1996).
- Ignarro, L. J., Buga, G. M., Byrns, R. E., Wood, K. S., Chaudhuri, G. Endothelium-derived relaxing factor and nitric oxide possess identical pharmacologic properties as relaxants of bovine arterial and venous smooth muscle. The Journal of Pharmacology and Experimental Therapeutics. 246 (1), 218-226 (1998).
- Arnold, W. P., Mittal, C. K., Katsuki, S., Murad, F. Nitric oxide activates guanylate cyclase and increases guanosine 3′:5′-cyclic monophosphate levels in various tissue preparations. Proceedings of the National Academy of Sciences of the United States of America. 74 (8), 3203-3207 (1977).
- Hayashida, K., et al. Depletion of vascular nitric oxide contributes to poor outcomes after cardiac arrest. American Journal of Respiratory and Critical Care Medicine. 199 (10), 1288-1290 (2019).
- Ignarro, L. J. Inhaled NO and COVID-19. British Journal of Pharmacology. 177 (16), 3848-3849 (2020).
- Gantner, B. N., LaFond, K. M., Bonini, M. G. Nitric oxide in cellular adaptation and disease. Redox Biology. 34, 101550 (2020).
- Clark, R. H., et al. Low-dose nitric oxide therapy for persistent pulmonary hypertension of the newborn. New England Journal of Medicine. 342 (7), 469-474 (2000).
- Goldbart, A., et al. Inhaled nitric oxide therapy in acute bronchiolitis: A multicenter randomized clinical trial. Scientific Reports. 10 (1), (2020).
- Bangirana, P., et al. Inhaled nitric oxide and cognition in pediatric severe malaria: A randomized double-blind placebo controlled trial. PloS One. 13 (1), 0191550 (2018).
- Jiang, S., Dandu, C., Geng, X. Clinical application of nitric oxide in ischemia and reperfusion injury: A literature review. Brain Circulation. 6 (4), 248-253 (2020).
- Lei, C., et al. Nitric oxide decreases acute kidney injury and stage 3 chronic kidney disease after cardiac surgery. American Journal of Respiratory and Critical Care Medicine. 198 (10), 1279-1287 (2018).
- Kelm, M. Nitric oxide metabolism and breakdown. Biochimica et Biophysica Acta. 1411 (2-3), 273-289 (1999).
- Bryan, N. S., Grisham, M. B. Methods to detect nitric oxide and its metabolites in biological samples. Free Radical Biology and Medicine. 43 (5), 645-657 (2007).
- Macarthur, P. H., Shiva, S., Gladwin, M. T. Measurement of circulating nitrite and S-nitrosothiols by reductive chemiluminescence. Journal of Chromatography B. 851 (1-2), 93-105 (2007).
- Helms, C., Kim-Shapiro, D. B. Hemoglobin-mediated nitric oxide signaling. Free Radical Biology and Medicine. 61, 464-472 (2013).
- Kim-Shapiro, D. B., Schechter, A. N., Gladwin, M. T. Unraveling the reactions of nitric oxide, nitrite, and hemoglobin in physiology and therapeutics. Arteriosclerosis, Thrombosis, and Vascular Biology. 26 (4), 697-705 (2006).
- Rezoagli, E., et al. Pulmonary and systemic vascular resistances after cardiopulmonary bypass: role of hemolysis. Journal of Cardiothoracic and Vascular Anesthesia. 31 (2), 505-515 (2017).
- Shiva, S. Nitrite: A physiological store of nitric oxide and modulator of mitochondrial function. Redox Biology. 1 (1), 40-44 (2013).
- Lundberg, J. O., Weitzberg, E., Gladwin, M. T. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nature Reviews Drug Discovery. 7 (2), 156-167 (2008).
- Heinrich, T. A., Da Silva, R. S., Miranda, K. M., Switzer, C. H., Wink, D. A., Fukuto, J. M. Biological nitric oxide signalling: chemistry and terminology. British Journal of Pharmacology. 169 (7), 1417-1429 (2013).
- Yang, B. K., Vivas, E. X., Reiter, C. D., Gladwin, M. T. Methodologies for the sensitive and specific measurement of s -nitrosothiols, iron-nitrosyls, and nitrite in biological samples. Free Radical Research. 37 (1), 1-10 (2003).
- Hayashida, K., et al. Improvement in outcomes after cardiac arrest and resuscitation by inhibition of s-nitrosoglutathione reductase. Circulation. 139 (6), 815-827 (2019).
- Rodríguez-Ortigosa, C. M., et al. Biliary secretion of S-nitrosoglutathione is involved in the hypercholeresis induced by ursodeoxycholic acid in the normal rat. Hepatology. 52 (2), 667-677 (2010).
- Mitchell, D. A., Marletta, M. A. Thioredoxin catalyzes the S-nitrosation of the caspase-3 active site cysteine. Nature Chemical Biology. 1 (3), 154-158 (2005).
- Mannick, J. B., et al. Fas-induced caspase denitrosylation. Science. 284 (5414), 651-654 (1999).
- Choi, Y. -. B., et al. Molecular basis of NMDA receptor-coupled ion channel modulation by S-nitrosylation. Nature Neuroscience. 3 (1), 15-21 (2000).
- Eu, J. P., Sun, J., Xu, L., Stamler, J. S., Meissner, G. The skeletal muscle calcium release channel: Coupled O2 sensor and NO signaling functions. Cell. 102 (4), 499-509 (2000).
- Stamler, J. S., et al. Nitric oxide circulates in mammalian plasma primarily as an S-nitroso adduct of serum albumin. Proceedings of the National Academy of Sciences of the United States of America. 89 (16), 7674-7677 (1992).
- Dunham, A. J., Barkley, R. M., Sievers, R. E. Aqueous nitrite ion determination by selective reduction and gas phase nitric oxide chemiluminescence. Analytical Chemistry. 67 (1), 220-224 (1995).
- Hogg, N., Zielonka, J., Kalyanaraman, B., Ignarro, L. J., Freeman, B. A. Detection of Nitric Oxide and Peroxynitrite in Biological Systems: A State-of-the-Art Review. Nitric Oxide (Third Edition). , 23-44 (2017).
- Gudem, M., Hazra, A. Mechanism of the chemiluminescent reaction between nitric oxide and ozone. The Journal of Physical Chemistry A. 123 (4), 715-722 (2019).
- Ishibe, Y., Liu, R., Hirosawa, J., Kawamura, K., Yamasaki, K., Saito, N. Exhaled nitric oxide level decreases after cardiopulmonary bypass in adult patients. Critical Care Medicine. 28 (12), 3823-3827 (2000).
- American Thoracic Society, European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide, 2005. American Journal of Respiratory and Critical Care Medicine. 171 (8), 912-930 (2005).
- Cuthbertson, B. H., Stott, S. A., Webster, N. R. Exhaled nitric oxide as a marker of lung injury in coronary artery bypass surgery. British Journal of Anaesthesia. 89 (2), 247-250 (2002).
- Ewing, J. F., Janero, D. R. Specific S-nitrosothiol (thionitrite) quantification as solution nitrite after vanadium(III) reduction and ozone-chemiluminescent detection. Free Radical Biology and Medicine. 25 (4-5), 621-628 (1998).
- Braman, R. S., Hendrix, S. A. Nanogram nitrite and nitrate determination in environmental and biological materials by vanadium(III) reduction with chemiluminescence detection. Analytical Chemistry. 61 (24), 2715-2718 (1989).
- Wang, X., et al. Biological activity of nitric oxide in the plasmatic compartment. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11477-11482 (2004).
- Bryan, N. S., Rassaf, T., Rodriguez, J., Feelisch, M. Bound NO in human red blood cells: fact or artifact. Nitric Oxide. 10 (4), 221-228 (2004).
- Kida, K., Shirozu, K., Yu, B., Mandeville, J. B., Bloch, K. D., Ichinose, F. Beneficial effects of nitric oxide on outcomes after cardiac arrest and cardiopulmonary resuscitation in hypothermia-treated mice. Anesthesiology. 120 (4), 880-889 (2014).
- Gladwin, M. T., et al. S-Nitrosohemoglobin is unstable in the reductive erythrocyte environment and lacks O2/NO-linked allosteric function. The Journal of Biological Chemistry. 277 (31), 27818-27828 (2002).
- Feelisch, M., et al. and heme-nitros(yl)ation in biological tissues and fluids: implications for the fate of NO in vivo. The FASEB Journal. 16 (13), 1775-1785 (2002).
- Liu, T., et al. L-NAME releases nitric oxide and potentiates subsequent nitroglycerin-mediated vasodilation. Redox Biology. 26, 101238 (2019).
- Piknova, B., Park, J. W., Cassel, K. S., Gilliard, C. N., Schechter, A. N. Measuring nitrite and nitrate, metabolites in the nitric oxide pathway, in biological materials using the chemiluminescence method. Journal of Visualized Experiments: JoVE. (118), e54879 (2016).
- Keefer, L. K., Nims, R. W., Davies, K. M., Wink, D. A. 34;NONOates" (1-substituted diazen-1-ium-1,2-diolates) as nitric oxide donors: Convenient nitric oxide dosage forms. Methods in Enzymology. , 281-293 (1996).
- Nagababu, E., Rifkind, J. M. Measurement of plasma nitrite by chemiluminescence without interference of S-, N-nitroso and nitrated species. Free Radical Biology and Medicine. 42 (8), 1146-1154 (2007).
- Doctor, A., et al. Hemoglobin conformation couples erythrocyte S-nitrosothiol content to O2 gradients. Proceedings of the National Academy of Sciences of the United States of America. 102 (16), 5709-5714 (2005).
- Zhang, Y., Keszler, A., Broniowska, K. A., Hogg, N. Characterization and application of the biotin-switch assay for the identification of S-nitrosated proteins. Free Radical Biology and Medicine. 38 (7), 874-881 (2005).
- Davies, I. R., Zhang, X., Poole, R. K. Nitric Oxide Selective Electrodes. Methods in enzymology. , 63-95 (2008).
- Saito, J., et al. Comparison of fractional exhaled nitric oxide levels measured by different analyzers produced by different manufacturers. Journal of Asthma. 57 (11), 1216-1226 (2020).

