Ensaios baseados em chemiluminescência para detecção de óxido nítrico e seus derivados de Autoxidação e Compostos Nitrosated
Summary
Aqui, apresentamos protocolos para detectar óxido nítrico e seus derivados biologicamente relevantes usando ensaios baseados em chemiluminescência com alta sensibilidade.
Abstract
A atividade de óxido nítrico (NO) in vivo é o resultado combinado de seus efeitos diretos, a ação de seus derivados gerados a partir da autoxidação no no, e os efeitos dos compostos nitrosos. Medir metabólitos NO é essencial para estudar nenhuma atividade tanto em níveis vasculares quanto em outros tecidos, especialmente nos ambientes experimentais onde o NO exógeno é administrado. Os ensaios de chemiluminescência à base de ozônio permitem medições precisas de metabólitos NO e NO em ambos os fluidos (incluindo plasma, homogeneizadores de tecido, culturas celulares) e misturas de gás (por exemplo, respiração exalada). NÃO reage com ozônio para gerar dióxido de nitrogênio em um estado animado. A consequente emissão de luz permite a fotodetecção e a geração de um sinal elétrico refletindo o teor NO da amostra. Alíquotas da mesma amostra podem ser usadas para medir metabólitos não específicos, como nitrato, nitrito, S-nitrosothiols e complexos ferro-nitrosilo. Além disso, o NO consumido pela hemoglobina livre de células também é quantificado com a análise de quimiluminescência. Uma ilustração de todas essas técnicas é fornecida.
Introduction
Desde que Os ganhadores do Salvador Moncada e do Nobel Robert Furchgott, Louis Ignarro e Ferid Murad identificaram o óxido nítrico (NO) como o anteriormente conhecido fator de relaxamento derivado da endotelia (EDRF), o papel central do NO foi estabelecido em vários mecanismos-chave que abrangem toda a biologia vascular, neurociências, metabolismo e resposta ao hospedeiro 1,2,3,4,5,6,7 . A administração exógena do GÁS NO tornou-se um tratamento estabelecido para insuficiência respiratória devido à hipertensão pulmonar no recém-nascido8. O gás óxido nítrico também tem sido investigado para o tratamento da infecção pelo vírus sincicial respiratório (RSV), malária e outras doenças infecciosas, lesão de isquemia-reperfusão e para prevenção de lesão renal aguda em pacientes submetidos à cirurgia cardíaca 9,10,11,12. A necessidade de técnicas precisas de medição para avaliar os níveis de NO, seus metabólitos e os de suas proteínas e compostos-alvo surge tanto de estudos mecanicistas quanto intervencionistas.
Devido à sua alta reatividade, a NO pode sofrer reações diferentes dependendo da matriz biológica em que é produzida e/ou liberada. Na ausência de hemoglobina (Hb) ou outras hemoproteínas de oxi, a NO é oxidada quase completamente ao nitrito (NO2–).
2NO + O2 → 2NO2
NO2 + NO → N2O3
N2O3 + H2O → NO2– + H+
O NO primeiro sofre autoxidação com oxigênio molecular (O2) para produzir dióxido de nitrogênio (NO2) e reage com o próprio NO2 para gerar trióxido de dinitrogen (N2O3). Uma molécula de N2O3 reage com água (H2O) para formar duas moléculas de NO2– e um próton (H+)13. Dentro de sangue inteiro14,15, NO e NO2– são rapidamente convertidos em nitrato (NO3–) como essas moléculas reagem avidamente com os grupos de heme oxidado de Hb [Hb-Fe2+-O2 ou oximosoglobina (oxicodona)] para produzir NO3–. Esta reação é associada à transição do grupo heme para o estado férrico [Hb-Fe3+ ou methemoglobina (metHb)]:
HB-Fe2+-O2 + NO → Hb-Fe3+ + NO3–
A barreira das células vermelhas do sangue (RBC) e o espaço imediatamente adjacente ao endotélio são os principais fatores que limitam essa reação e permitem que uma pequena porção do NO liberada pelo endotélio atue como EDRF16,17. Na verdade, o Hb livre de células na circulação é conhecido por interromper a vasodilatação em ambientes experimentais e clínicos17,18. Dentro da RBC, dependendo da oxigenação e da concentração NO2, uma porção de NO reage com desoxihemoglobina (Hb-Fe2+) para formar ferro-nitrosol Hb (Hb-Fe2+-NO ou HbNO):
HB-Fe2+ + NO → Hb-Fe2+-NO
Na RBC15,17, o NO2– pode formar o Hb-Fe3+ reduzindo o Hb-Fe2+ levando ao lançamento do NO, que por sua vez liga o Hb-Fe2+-O2 (preferencialmente) ou o Hb-Fe2+.
A geração de no-derivados não deve ser considerada estritamente unidirecional, pois o NO pode ser regenerado a partir de NO2– e NO3– em vários tecidos e por diferentes enzimas (por exemplo, por bactérias intestinais ou dentro das mitocôndrias, particularmente sob condições hipoxicas)19,20.
Uma quantidade variável de NO produzido (ou administrado) leva à geração a jusante de S-nitrosothiols, principalmente por transinrose de thiol a partir de N2O3 na presença de um nucleófilo criando um intermediário doador NO+ (Nuc-NO+-NO2–):
N2O3 + RS– → RS-NO + NO2–
Outra possibilidade para a geração de S-nitrosothiols é a nitrosiagem de tiais oxidados (NÃO reage com um tiol oxidado):
RS• + NO → RS-NO
Este mecanismo e oxidação direta de thiol pelo NO2 só podem ser possíveis em condições muito específicas que são descritas em outros lugares21. Os s-nitrosothiols variam de moléculas leves como S-nitrosoglutathione a grandes proteínas que contêm tiol. A s-nitrosohemoglobina (S-NO-Hb) é formada por nitrosão de um grupo de tiol de um resíduo de cisteína conservado na cadeia de β (β93C)22.
A geração e o metabolismo dos S-nitrosothiols fazem parte de importantes mecanismos regulatórios. Exemplos incluem regulação de glutathione, caspases, N-metil-D-Aspartato (NMDA) e receptores de ryanodo 23,24,25,26,27,28. Anteriormente considerado como um grande mediador da NO biology in vivo, a albumina nitrosa (S-nitroso-albumina) parece ser um transportador NO/NO+ sem qualquer atividade biológica adicional específica29.
Ao medir a concentração de NO e seus derivados de uma amostra biológica específica dentro de uma matriz biológica, é importante considerar características como acidez, oxigenação, temperatura e presença de reagentes. Exemplos incluem doadores exógenos administrados NO e, no cenário de inflamação aguda, peróxido de hidrogênio (H2O2) reagindo com o NO2 levando à geração de concentração supernormal de radicais livres como a peroxitorita (ONOO–)21. Além do método analítico que é empregado, a fase pré-analítica da preparação e armazenamento da amostra é fundamental. Reações a jusante que não representam a atividade in vivo NO devem ser previstas, consideradas e bloqueadas. Um exemplo válido é a instabilidade do S-NO-Hb, que exige um tratamento dedicado de amostras de sangue quando é direcionado para a medição22.
Ensaios baseados em chemiluminescência são o padrão-ouro para detectar os níveis de NO e seus principais metabólitos [NO2–, NO3–, S-NO e complexos ferro-nitrosol (Fe-NO)] em qualquer fluido biológico, incluindo homogeneiza tecidos30,31. Esses métodos dependem do detector de chemiluminescência (CLD), um dispositivo que abriga a reação de NO com ozônio (O3), gerando o Nº2 em estado animado (NO2•). Relaxamento do NO2• causa emissão de um fóton de luz detectado por um tubo fotomultiplier, gerando um sinal elétrico diretamente proporcional ao teor NO da mistura de gás amostrado32. Um esquema simplificado do CLD está representado.
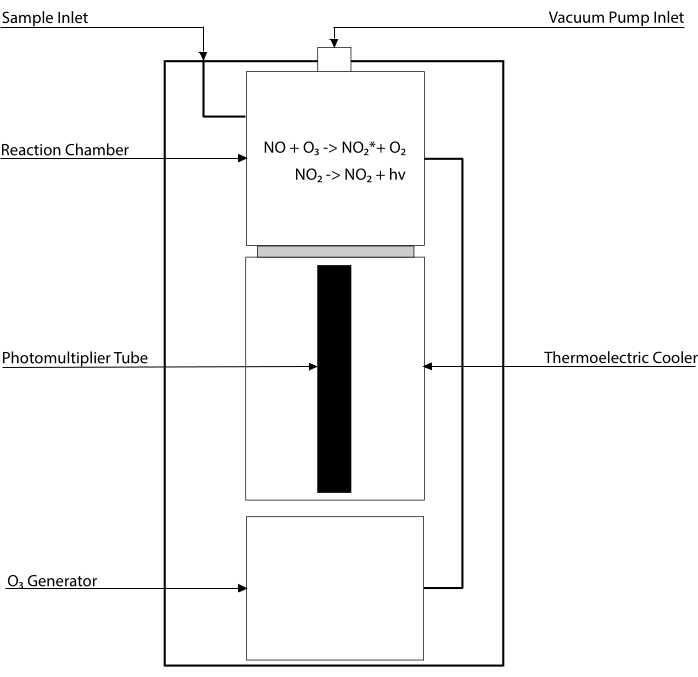
Figura 1: Esquema simplificado de um detector de quimiluminescência para gás óxido nítrico. A detecção baseada em óxido nítrico (NO) é a geração estequiométrica de uma molécula de gás NO que é introduzida no detector de quimiominascência (CID). A reação de chemiluminescência é obtida em uma câmara designada fornecida com ozônio (O3) de um gerador interno, que é mantida em pressão negativa por conexão com uma bomba externa, permitindo entrada contínua e constante de gás amostral. A geração de O3 requer oxigênio diatômico (O2) que é fornecido por um tanque O2 dedicado conectado com o CLD (outros fabricantes fornecem CLDs operando com ar ambiente). Dentro da câmara de reação, cada molécula de gás NO contido no gás amostrado reage com oxigênio para produzir uma molécula de dióxido de nitrogênio no estado ativado (NO2*). Ao retornar ao seu estado terrestre, cada molécula NO2* emite um fóton que é detectado por um tubo fotomultiplier (PMT) localizado ao lado da câmara de reação. O TPM com o amplificador associado e unidade de processamento central produz um sinal proporcional à contagem de fótons e ao número de nenhuma molécula na câmara de reação. Clique aqui para ver uma versão maior desta figura.
A entrada amostral do CLD pode ser conectada a um sistema de vidro contendo uma câmara de reação para amostras líquidas. O sistema é continuamente purgado com um gás inerte como nitrogênio, hélio ou argônio, transferindo NÃO da câmara de reação para o CLD. Amostras de fase líquida são injetadas através de uma membrana dedicada no vaso de purga.
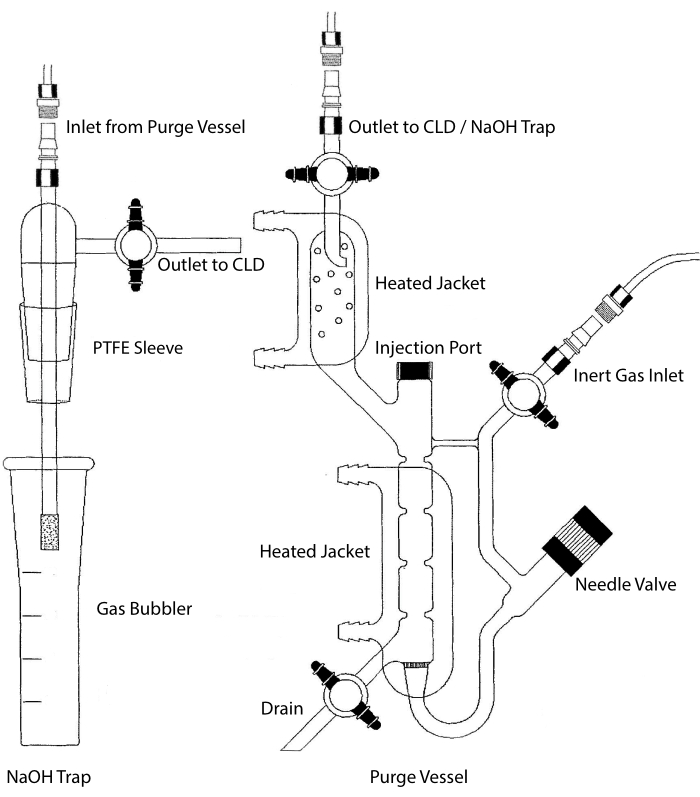
Figura 2: Estrutura de um vaso de purga para detecção baseada em óxido nítrico à base de quimiotrica O vaso de purga (à direita) permite a detecção de gás óxido nítrico (NO) ou qualquer outro composto que possa ser facilmente convertido em nenhum gás quando liberado de um reagente de fase líquida. A entrada de gás inerte está conectada a uma fonte (tanque) de um gás inerte como Argon, Xeon ou nitrogênio diatômico (N2). A válvula da agulha (abre à esquerda) é usada para controle de pressão dentro do vaso de purga e pode ser completamente removida para limpar o vaso. A porta de injeção é coberta por uma tampa com um septo de membrana para injeção de amostra. A membrana deve ser substituída com frequência. Uma jaqueta aquecida envolve a câmara de reação e é conectada a um banho de água quente para realizar o teste VCl3 em HCl. A saída do vaso de purgação está conectada ao detector de quimiominascência (CLD) ou à armadilha NaOH (necessária para vcl3 em ensaios HCl). Para drenar o conteúdo da câmara de reação, primeiro feche as torneiras na entrada de gás inerte e a saída do vaso de purga, feche a válvula da agulha, remova a tampa no porta de injeção e, finalmente, abra a torneira no ralo. A armadilha NaOH (esquerda) é necessária para ser colocada em linha entre o vaso de purga e o CLD se o ensaio VCl3 em HCl for realizado devido à corrosão do HCL. A conexão com o CLD sempre requer um filtro de campo intenso (IFD) a ser colocado entre o CLD e a saída do vaso de purga (ou a armadilha NaOH, se usado). O filtro IFD remove partículas aéreas e impede que o líquido passe pelo vaso de purga. PTFE = politetrafluoroetileno. Clique aqui para ver uma versão maior desta figura.
Como consequência, qualquer composto que possa ser convertido em NÃO através de uma reação química específica e controlada pode ser detectado com alta sensibilidade em qualquer fluido biológico e homogeneizar tecido24. A medição direta da fase de gás NO através da chemiluminescência é realizada tanto em ambientes experimentais quanto clínicos. Essas técnicas são amplamente descritas em outros lugares 33,34,35. A medição de NO2–, S-nitrosothiols, proteínas S-nitrosated e Fe-NOs pode ser realizada adicionando amostras em uma mistura de reação com triiodeto (I3–), que não libera gás estelioetricamente de todos esses compostos:
I3– → I2 + I–
2NO2− +2I− +4H+ → 2NO + I2 +2H2O
I3− + 2RS-NO → 3I− + RSSR + 2NO+
2NO+ + 2I− → 2NO + I2
enquanto eu3– não reage com o NO 3-15. Medições precisas de cada composto são possíveis pelo pré-tratamento de alíquotas amostrais com sulfanilamida acidificada (AS) com ou sem cloreto mercúrico (HgCl2). Especificamente, o pré-tratamento com AS remove todo o conteúdo NO 2. Como consequência, o conteúdo NO medido pelo CLD reflete apenas a soma da concentração de S-NOs e Fe-NOs. A injeção de HgCl2 em uma alíquota de amostra antes da injeção de AS faz com que o NO2– seja liberado pelo S-NO. O tratamento com AS (levando à remoção nº2) garante que o teor de NÃO medido só reflete a concentração de Fe-NOs. Uma série de subtrações entre as avaliações permitem calcular a concentração precisa dos três derivados NO22.
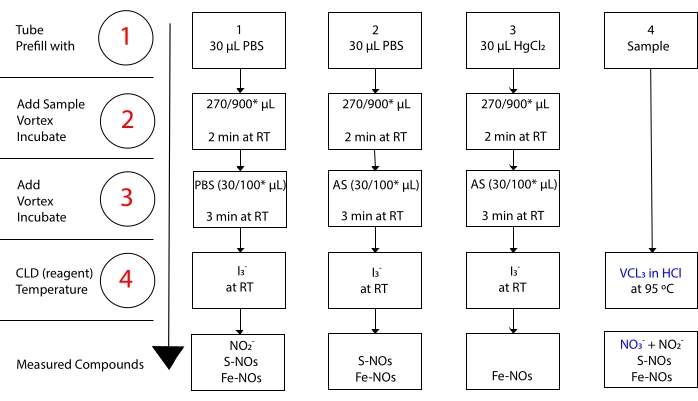
Figura 3: Etapas na preparação da amostra para o ensaio i3– em ácido acético quemiluminescence. Os passos sequenciais para a preparação do ensaio i3– em ácido acético chemiluminescence são ilustrados. É necessário o uso de tubos de centrífuga protegidos pela luz. Os tubos 1, 2 e 3 são os usados para se preparar para o ensaio. Outra alíquota de amostra (tubo 4) é necessária para o ensaio VCl3 em HCl se for necessária a medição do nitrato (NO3–). As etapas são indicadas por números em vermelho. Pré-preenchimento (Passo 1) conforme indicado com soro fisiológico tampão de fosfato (PBS) ou HgCl2 antes de adicionar o volume amostral. Adicione o volume amostral (2) conforme indicado, vórtice e incubar por 2 minutos à temperatura ambiente (RT). Adicionar (3) PBS ou sulfanilamida acidificada (AS) conforme indicado,vórtice e incubar por 3 min no RT. Execute o ensaio (4). A concentração medida pelo ensaio é a soma da concentração dos compostos relatados sob cada tubo. O tubo número 1 permitirá medições de nitrito (NO2–), S-nitrosothiols (S-NO) e complexos ferro-nitrosilo (Fe-NOs) como um único sinal. Para a medição do nitrato (NO3–), as amostras devem ser executadas com i3– em ácido acético e VCl3 em ensaios de HCl, e o valor obtido a partir do tubo 1 deve ser subtraído do obtido do tubo 4. *Quantidades sugeridas a serem utilizadas para análise de Hb para determinação de resíduos NO2–, S-nitrosohemoglobina e ferro-nitrosibina-hemoglobina. Clique aqui para ver uma versão maior desta figura.
Para a medição Nº3, o cloreto de vanádio (III) (VCl3) em ácido clorídrico (HCl) é usado para conversão de NO3– a NO no vaso de purga, a fim de medir o nº3– estequiometricalmente com o CLD:
2 NO3–+ 3V+3 + 2H2O → 2NO + 3VO2+ + 4H+
Para conseguir uma conversão suficientemente rápida, a reação precisa ser realizada a 90-95 °C. A redução de NO3– para NO2– é associada à redução de NO2– para NO por HCl. O metal vanadium também reduz os S-NOs liberando seu NO moiety22,36. A concentração final obtida pelo CLD com VCl3 em HCl reflete a concentração agregada de NO3–, NO2 e outros compostos nitrosados. A subtração do último valor da concentração rendeda com CLD com I3– permite o cálculo de Nº3– concentração36,37 (Figura 3).
No ensaio de consumo NO, a liberação contínua de NÃO no recipiente de purga por NENHUM doador como (Z)-1-[2-(2-aminoetil)-N-(2-ammonioethyl)amino]diazen-1-ium-1,2-diolato (DETA-NONOato) gera um sinal estável permitindo quantificar oxiHb sem células nas amostras injetadas. A quantidade de NÃO consumida no vaso de purga está em uma relação estequiométrica com a quantidade de oxicodona na amostra38.
Protocolos para medição de NO2–, NO3–, S-nitrosothiols, complexos ferro-nitrosilo e NO consumo por Hb livre de células em amostras de plasma são ilustrados. Estudos sobre NÃO no ambiente RBC requerem tratamento amostral específico seguido de cromatografia de exclusão para medir s-no-hb e hb-no extremamente frágeis, juntamente com a determinação da concentração total de Hb15,22. A preparação da amostra é fundamental na correção da medição. A pré-existência do NO2– em H2O e liberação do Nº2– durante o ensaio pode levar à medição de concentrações artificialmente maiores de nenhum derivado, como o S-NO-Hb14,39. Aspectos importantes da preparação da amostra também são apresentados.
Protocol
Representative Results
Discussion
Devido à alta sensibilidade, ensaios baseados em chemiluminescência para a determinação de NO e compostos relacionados têm alto risco de contaminação nº2. Cada reagente (especialmente a solução de bloqueio NO 2) e dilutante (incluindo ddH2O) usado no experimento devem ser testados para seu conteúdo NO 2 para corrigir o sinal de fundo. O nitrito é extremamente reativo com meia-vida em sangue inteiro em torno de 10 minutos e rapidament…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Os protocolos relatados neste manuscrito foram possíveis pelas contribuições acumuladas de bolsistas anteriores do laboratório de Pesquisa de Anestesia em Cuidados Críticos do Dr. Warren Zapol. Reconhecemos a contribuição dos Drs. Akito Nakagawa, Francesco Zadek, Emanuele Vassena, Chong Lei, Yasuko Nagasaka, Ester Spagnolli e Emanuele Rezoagli.
Materials
| Acetic Acid | Sigma | 45754 | 500 mL – liquid |
| Antifoam B Emulsion | Sigma | A5757 | 250 mL – liquid |
| DETA NONOate | Cayman | 82120 | 10 mg |
| Gibco DPBS (1x) no calcium, no magnesium | ThermoFisher | 14190144 | 500 mL |
| Hydroochloric Acid 37% (1 M) | Sigma | 258148 | 500 mL – liquid |
| Iodine | SAFC | 207772 | 100 g – solid |
| Kimwipes | Kimtech | 34155 | |
| Mercury (II) Chloride ACS reagent> 99.5% | Sigma | 215465 | 100 g – solid (dissolve in water) |
| Mili-Q Water Purification System | Millipore | ||
| Model 705 RN 50 μL syringe | Hamilton | 80530 | Microliter syringe |
| Model 802 N 25 μL Syringe | Hamilton | 84854 | Microliter syringe |
| N-ethylmaleimide | Sigma | 4260 | 25 g – crystalline |
| Nitric Oxide Analyzer + Bundle Software – Purge Vessel | Zysense | NOA 280i | Chemiluminescence Detector |
| Nonidet p-40 (NP-40) | ThermoFisher | 85125 | 10% – 500 mL |
| Potassium hexacyanoferrate (III) ACS reagent≥ 99% | Sigma | 244023 | 100 g – powder |
| Potassium Iodide ACS reagent> 99% | Sigma | 221945 | 100 g – solid |
| Potassium Nitrite cryst. For analysis EMSURE ACS | Supelco | 105067 | 250 g – crystalline |
| PowerGen 125 | Fisher Scientific | 14-359-251 | Mechanic Homogenizer |
| RV3 Two Stage Rotary Vane Pump | Edwards | A65201906 | Vacuum Pump – Bundled with analyzer |
| Sodium Heparin – BD Hemogard Clo | BD Biosciences | BD367871 | 75 USP Units |
| Sodium hydroxide anhydrous ACS reagent ≥ 97% | Sigma | 795429 | 1 kg – pelletts |
| Sodium Nitrate ACS reagent ≥ 99% | Sigma | 221341 | 500 g – powder |
| Sodium nitrite ≥ 99% | Sigma | S2252 | 500 g – crystalline |
| Sulfanilamide ≥ 98% | Sigma | S9251 | 100 g – solid |
| Vanadium (III) Chloride | Sigma | 112393 | 25 g – solid – Caution (exothermic) |
| Whatman 1 Filter Paper | Sigma | WHA10010155 |
Riferimenti
- Palmer, R. M. J., Ferrige, A. G., Moncada, S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature. 327 (6122), 524-526 (1987).
- Furchgott, R. F. The discovery of endothelium-derived relaxing factor and its importance in the identification of nitric oxide. JAMA: The Journal of the American Medical Association. 276 (14), 1186 (1996).
- Ignarro, L. J., Buga, G. M., Byrns, R. E., Wood, K. S., Chaudhuri, G. Endothelium-derived relaxing factor and nitric oxide possess identical pharmacologic properties as relaxants of bovine arterial and venous smooth muscle. The Journal of Pharmacology and Experimental Therapeutics. 246 (1), 218-226 (1998).
- Arnold, W. P., Mittal, C. K., Katsuki, S., Murad, F. Nitric oxide activates guanylate cyclase and increases guanosine 3′:5′-cyclic monophosphate levels in various tissue preparations. Proceedings of the National Academy of Sciences of the United States of America. 74 (8), 3203-3207 (1977).
- Hayashida, K., et al. Depletion of vascular nitric oxide contributes to poor outcomes after cardiac arrest. American Journal of Respiratory and Critical Care Medicine. 199 (10), 1288-1290 (2019).
- Ignarro, L. J. Inhaled NO and COVID-19. British Journal of Pharmacology. 177 (16), 3848-3849 (2020).
- Gantner, B. N., LaFond, K. M., Bonini, M. G. Nitric oxide in cellular adaptation and disease. Redox Biology. 34, 101550 (2020).
- Clark, R. H., et al. Low-dose nitric oxide therapy for persistent pulmonary hypertension of the newborn. New England Journal of Medicine. 342 (7), 469-474 (2000).
- Goldbart, A., et al. Inhaled nitric oxide therapy in acute bronchiolitis: A multicenter randomized clinical trial. Scientific Reports. 10 (1), (2020).
- Bangirana, P., et al. Inhaled nitric oxide and cognition in pediatric severe malaria: A randomized double-blind placebo controlled trial. PloS One. 13 (1), 0191550 (2018).
- Jiang, S., Dandu, C., Geng, X. Clinical application of nitric oxide in ischemia and reperfusion injury: A literature review. Brain Circulation. 6 (4), 248-253 (2020).
- Lei, C., et al. Nitric oxide decreases acute kidney injury and stage 3 chronic kidney disease after cardiac surgery. American Journal of Respiratory and Critical Care Medicine. 198 (10), 1279-1287 (2018).
- Kelm, M. Nitric oxide metabolism and breakdown. Biochimica et Biophysica Acta. 1411 (2-3), 273-289 (1999).
- Bryan, N. S., Grisham, M. B. Methods to detect nitric oxide and its metabolites in biological samples. Free Radical Biology and Medicine. 43 (5), 645-657 (2007).
- Macarthur, P. H., Shiva, S., Gladwin, M. T. Measurement of circulating nitrite and S-nitrosothiols by reductive chemiluminescence. Journal of Chromatography B. 851 (1-2), 93-105 (2007).
- Helms, C., Kim-Shapiro, D. B. Hemoglobin-mediated nitric oxide signaling. Free Radical Biology and Medicine. 61, 464-472 (2013).
- Kim-Shapiro, D. B., Schechter, A. N., Gladwin, M. T. Unraveling the reactions of nitric oxide, nitrite, and hemoglobin in physiology and therapeutics. Arteriosclerosis, Thrombosis, and Vascular Biology. 26 (4), 697-705 (2006).
- Rezoagli, E., et al. Pulmonary and systemic vascular resistances after cardiopulmonary bypass: role of hemolysis. Journal of Cardiothoracic and Vascular Anesthesia. 31 (2), 505-515 (2017).
- Shiva, S. Nitrite: A physiological store of nitric oxide and modulator of mitochondrial function. Redox Biology. 1 (1), 40-44 (2013).
- Lundberg, J. O., Weitzberg, E., Gladwin, M. T. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nature Reviews Drug Discovery. 7 (2), 156-167 (2008).
- Heinrich, T. A., Da Silva, R. S., Miranda, K. M., Switzer, C. H., Wink, D. A., Fukuto, J. M. Biological nitric oxide signalling: chemistry and terminology. British Journal of Pharmacology. 169 (7), 1417-1429 (2013).
- Yang, B. K., Vivas, E. X., Reiter, C. D., Gladwin, M. T. Methodologies for the sensitive and specific measurement of s -nitrosothiols, iron-nitrosyls, and nitrite in biological samples. Free Radical Research. 37 (1), 1-10 (2003).
- Hayashida, K., et al. Improvement in outcomes after cardiac arrest and resuscitation by inhibition of s-nitrosoglutathione reductase. Circulation. 139 (6), 815-827 (2019).
- Rodríguez-Ortigosa, C. M., et al. Biliary secretion of S-nitrosoglutathione is involved in the hypercholeresis induced by ursodeoxycholic acid in the normal rat. Hepatology. 52 (2), 667-677 (2010).
- Mitchell, D. A., Marletta, M. A. Thioredoxin catalyzes the S-nitrosation of the caspase-3 active site cysteine. Nature Chemical Biology. 1 (3), 154-158 (2005).
- Mannick, J. B., et al. Fas-induced caspase denitrosylation. Science. 284 (5414), 651-654 (1999).
- Choi, Y. -. B., et al. Molecular basis of NMDA receptor-coupled ion channel modulation by S-nitrosylation. Nature Neuroscience. 3 (1), 15-21 (2000).
- Eu, J. P., Sun, J., Xu, L., Stamler, J. S., Meissner, G. The skeletal muscle calcium release channel: Coupled O2 sensor and NO signaling functions. Cell. 102 (4), 499-509 (2000).
- Stamler, J. S., et al. Nitric oxide circulates in mammalian plasma primarily as an S-nitroso adduct of serum albumin. Proceedings of the National Academy of Sciences of the United States of America. 89 (16), 7674-7677 (1992).
- Dunham, A. J., Barkley, R. M., Sievers, R. E. Aqueous nitrite ion determination by selective reduction and gas phase nitric oxide chemiluminescence. Analytical Chemistry. 67 (1), 220-224 (1995).
- Hogg, N., Zielonka, J., Kalyanaraman, B., Ignarro, L. J., Freeman, B. A. Detection of Nitric Oxide and Peroxynitrite in Biological Systems: A State-of-the-Art Review. Nitric Oxide (Third Edition). , 23-44 (2017).
- Gudem, M., Hazra, A. Mechanism of the chemiluminescent reaction between nitric oxide and ozone. The Journal of Physical Chemistry A. 123 (4), 715-722 (2019).
- Ishibe, Y., Liu, R., Hirosawa, J., Kawamura, K., Yamasaki, K., Saito, N. Exhaled nitric oxide level decreases after cardiopulmonary bypass in adult patients. Critical Care Medicine. 28 (12), 3823-3827 (2000).
- American Thoracic Society, European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide, 2005. American Journal of Respiratory and Critical Care Medicine. 171 (8), 912-930 (2005).
- Cuthbertson, B. H., Stott, S. A., Webster, N. R. Exhaled nitric oxide as a marker of lung injury in coronary artery bypass surgery. British Journal of Anaesthesia. 89 (2), 247-250 (2002).
- Ewing, J. F., Janero, D. R. Specific S-nitrosothiol (thionitrite) quantification as solution nitrite after vanadium(III) reduction and ozone-chemiluminescent detection. Free Radical Biology and Medicine. 25 (4-5), 621-628 (1998).
- Braman, R. S., Hendrix, S. A. Nanogram nitrite and nitrate determination in environmental and biological materials by vanadium(III) reduction with chemiluminescence detection. Analytical Chemistry. 61 (24), 2715-2718 (1989).
- Wang, X., et al. Biological activity of nitric oxide in the plasmatic compartment. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11477-11482 (2004).
- Bryan, N. S., Rassaf, T., Rodriguez, J., Feelisch, M. Bound NO in human red blood cells: fact or artifact. Nitric Oxide. 10 (4), 221-228 (2004).
- Kida, K., Shirozu, K., Yu, B., Mandeville, J. B., Bloch, K. D., Ichinose, F. Beneficial effects of nitric oxide on outcomes after cardiac arrest and cardiopulmonary resuscitation in hypothermia-treated mice. Anesthesiology. 120 (4), 880-889 (2014).
- Gladwin, M. T., et al. S-Nitrosohemoglobin is unstable in the reductive erythrocyte environment and lacks O2/NO-linked allosteric function. The Journal of Biological Chemistry. 277 (31), 27818-27828 (2002).
- Feelisch, M., et al. and heme-nitros(yl)ation in biological tissues and fluids: implications for the fate of NO in vivo. The FASEB Journal. 16 (13), 1775-1785 (2002).
- Liu, T., et al. L-NAME releases nitric oxide and potentiates subsequent nitroglycerin-mediated vasodilation. Redox Biology. 26, 101238 (2019).
- Piknova, B., Park, J. W., Cassel, K. S., Gilliard, C. N., Schechter, A. N. Measuring nitrite and nitrate, metabolites in the nitric oxide pathway, in biological materials using the chemiluminescence method. Journal of Visualized Experiments: JoVE. (118), e54879 (2016).
- Keefer, L. K., Nims, R. W., Davies, K. M., Wink, D. A. 34;NONOates" (1-substituted diazen-1-ium-1,2-diolates) as nitric oxide donors: Convenient nitric oxide dosage forms. Methods in Enzymology. , 281-293 (1996).
- Nagababu, E., Rifkind, J. M. Measurement of plasma nitrite by chemiluminescence without interference of S-, N-nitroso and nitrated species. Free Radical Biology and Medicine. 42 (8), 1146-1154 (2007).
- Doctor, A., et al. Hemoglobin conformation couples erythrocyte S-nitrosothiol content to O2 gradients. Proceedings of the National Academy of Sciences of the United States of America. 102 (16), 5709-5714 (2005).
- Zhang, Y., Keszler, A., Broniowska, K. A., Hogg, N. Characterization and application of the biotin-switch assay for the identification of S-nitrosated proteins. Free Radical Biology and Medicine. 38 (7), 874-881 (2005).
- Davies, I. R., Zhang, X., Poole, R. K. Nitric Oxide Selective Electrodes. Methods in enzymology. , 63-95 (2008).
- Saito, J., et al. Comparison of fractional exhaled nitric oxide levels measured by different analyzers produced by different manufacturers. Journal of Asthma. 57 (11), 1216-1226 (2020).

