Ensayos basados en quimioluminiscencia para la detección de óxido nítrico y sus derivados de la autoxidación y compuestos nitrosados
Summary
Aquí, presentamos protocolos para detectar el óxido nítrico y sus derivados biológicamente relevantes utilizando ensayos basados en quimioluminiscencia con alta sensibilidad.
Abstract
La actividad del óxido nítrico (NO) in vivo es el resultado combinado de sus efectos directos, la acción de sus derivados generados a partir de la autoxidación del NO y los efectos de los compuestos nitrosados. La medición de los metabolitos de NO es esencial para estudiar la actividad del NO tanto a nivel vascular como en otros tejidos, especialmente en los entornos experimentales donde se administra NO exógeno. Los ensayos de quimioluminiscencia a base de ozono permiten mediciones precisas de metabolitos de NO y NO tanto en fluidos (incluidos plasma, homogeneizados de tejidos, cultivos celulares) como en mezclas de gases (por ejemplo, aliento exhalado). El NO reacciona con el ozono para generar dióxido de nitrógeno en un estado excitado. La consiguiente emisión de luz permite la fotodetección y la generación de una señal eléctrica que refleje el contenido de NO de la muestra. Las alícuotas de la misma muestra se pueden usar para medir metabolitos específicos de NO, como nitrato, nitrito, S-nitrosotioles y complejos hierro-nitrosil. Además, el NO consumido por la hemoglobina libre de células también se cuantifica con el análisis de quimioluminiscencia. Se proporciona una ilustración de todas estas técnicas.
Introduction
Desde que Salvador Moncada y los premios Nobel Robert Furchgott, Louis Ignarro y Ferid Murad identificaron el óxido nítrico (NO) como el factor de relajación derivado del endotelial (EDRF) previamente conocido, el papel central del NO se ha establecido en varios mecanismos clave que abarcan toda la biología vascular, las neurociencias, el metabolismo y la respuesta del huésped 1,2,3,4,5,6,7 . La administración exógena de NO gas se ha convertido en un tratamiento establecido para la insuficiencia respiratoria por hipertensión pulmonar en el recién nacido8. El gas óxido nítrico también se ha investigado para el tratamiento de la infección por virus sincitial respiratorio (VSR), la malaria y otras enfermedades infecciosas, la lesión por isquemia-reperfusión y para la prevención de la lesión renal aguda en pacientes sometidos a cirugía cardíaca 9,10,11,12. La necesidad de técnicas de medición precisas para evaluar los niveles de NO, sus metabolitos y los de sus proteínas y compuestos objetivo surge de estudios mecanicistas e intervencionistas.
Debido a su alta reactividad, el NO puede sufrir diferentes reacciones dependiendo de la matriz biológica en la que se produzca y/o libere. En ausencia de hemoglobina (Hb) u otras oxihemoproteínas, el NO se oxida casi por completo a nitrito (NO2–).
2NO + O2 → 2NO2
NO2 + NO → N2O3
N2O3 + H2O → NO2– + H+
El NO primero se somete a la autoxidación con oxígeno molecular (O2) para producir dióxido de nitrógeno (NO2) y reacciona con el propio NO2 para generar trióxido de dinitrógeno (N2O3). Una molécula de N2O3 reacciona con el agua (H2O) para formar dos moléculas de NO2– y un protón (H+)13. Dentro de la sangre total, 14,15, NO y NO 2- se convierten rápidamente en nitrato (NO 3–) ya que estas moléculas reaccionan ávidamente con los grupos hemo oxidados de Hb [Hb-Fe2+-O2 u oxihemoglobina (oxyHb)] para producir NO3–. Esta reacción se combina con la transición del grupo hemo al estado férrico [Hb-Fe3+ o metahemoglobina (metHb)]:
Hb-Fe2+-O2 + NO → Hb-Fe3+ + NO3–
La barrera de glóbulos rojos (RBC) y el espacio inmediatamente adyacente al endotelio son los principales factores que limitan esta reacción y permiten que una pequeña porción del NO liberado por el endotelio actúe como EDRF16,17. De hecho, se sabe que la Hb libre de células en la circulación interrumpe la vasodilatación en entornos experimentales y clínicos17,18. Dentro del RBC, dependiendo de la oxigenación y la concentración de NO2–, una porción de NO reacciona con la desoxihemoglobina (Hb-Fe2+) para formar hierro-nitrosil Hb (Hb-Fe2+-NO o HbNO):
Hb-Fe2+ + NO → Hb-Fe2+-NO
En el RBC15,17, NO2– puede formar Hb-Fe3+ reduciendo Hb-Fe2+ dando lugar a la liberación de NO, que a su vez se une a Hb-Fe2+-O 2 (preferentemente) o Hb-Fe2+.
La generación de derivados del NO no debe considerarse estrictamente unidireccional, ya que el NO puede regenerarse a partir de NO2 y NO 3 en diversos tejidos y por diferentes enzimas (por ejemplo, por bacterias intestinales o dentro de las mitocondrias, particularmente en condiciones hipóxicas)19,20.
Una cantidad variable de NO producido (o administrado) conduce a la generación aguas abajo de S-nitrosotioles, principalmente por transnitrosación de tiol de N2O3 en presencia de un nucleófilo creando un intermediario donante de NO+ (Nuc-NO+-NO2–):
N2O3 + RS– → RS-NO + NO2–
Otra posibilidad para la generación de S-nitrosotioles es la nitrosilación de tioles oxidados (NO reaccionando con un tiol oxidado):
RS• + NO → RS-NO
Este mecanismo y la oxidación directa del tiol por NO2 podrían ser posibles sólo en condiciones muy específicas que se describen en otra parte21. Los S-nitrosotioles van desde moléculas ligeras como S-nitrosoglutatión hasta proteínas grandes que contienen tiol. La S-nitrosohemoglobina (S-NO-Hb) se forma por nitrosación de un grupo tiol de un residuo de cisteína conservado en la cadena β (β93C)22.
La generación y el metabolismo de los S-nitrosotioles forman parte de importantes mecanismos reguladores. Los ejemplos incluyen la regulación del glutatión, las caspasas, el N-metil-D-aspartato (NMDA) y los receptores de rianodina 23,24,25,26,27,28. Anteriormente considerada como un mediador importante de la biología del NO in vivo, la albúmina nitrosada (S-nitroso-albúmina) parece ser un transportador de NO/NO+ sin ninguna actividad biológica adicional específica29.
Al medir la concentración de NO y sus derivados de una muestra biológica específica dentro de una matriz biológica, es importante considerar características como la acidez, la oxigenación, la temperatura y la presencia de reactivos. Los ejemplos incluyen donantes de NO exógenos administrados y, en el contexto de la inflamación aguda, peróxido de hidrógeno (H2O2) que reacciona con NO2 que conduce a la generación de concentración sobrenormal de radicales libres como el peroxinitrito (ONOO–)21. Además del método analítico que se emplea, la fase preanalítica de preparación y almacenamiento de muestras es fundamental. Las reacciones posteriores que no representen la actividad de NO in vivo se predecirán, considerarán y bloquearán. Un ejemplo válido es la inestabilidad de S-NO-Hb, que requiere un tratamiento dedicado de muestras de sangre cuando se dirige a la medición22.
Los ensayos basados en quimioluminiscencia son el estándar de oro para detectar los niveles de NO y sus principales metabolitos [NO2–, NO3–, S-NO y complejos hierro-nitrosil (Fe-NO)] en cualquier fluido biológico, incluidos los homogeneizados tisulares30,31. Estos métodos se basan en el detector de quimioluminiscencia (CLD), un dispositivo que alberga la reacción de NO con ozono (O3), generando NO2 en un estado excitado (NO2•). La relajación del NO2• provoca la emisión de un fotón de luz que es detectado por un tubo fotomultiplicador, generando una señal eléctrica que es directamente proporcional al contenido de NO de la mezcla de gases muestreada32. Se representa un esquema simplificado de la CLD.
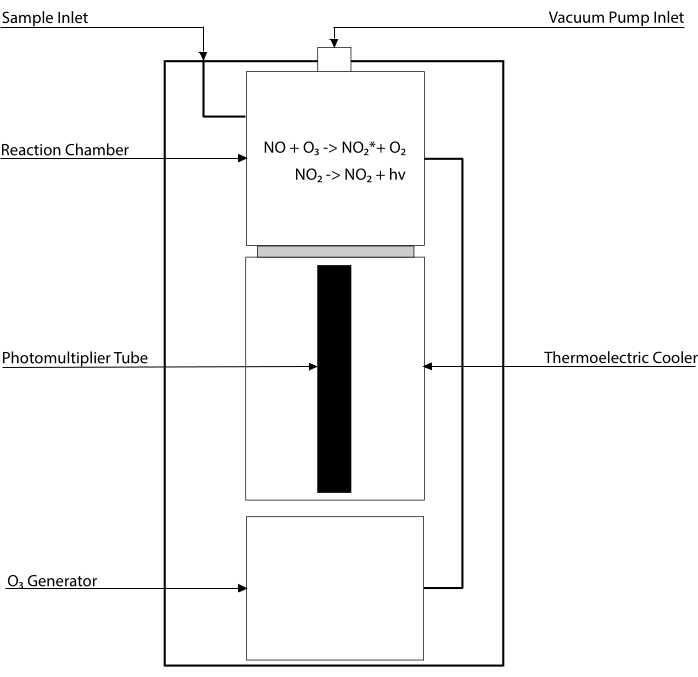
Figura 1: Esquema simplificado de un detector de quimioluminiscencia para gas de óxido nítrico. La detección basada en quimioluminiscencia de óxido nítrico (NO) es la generación estequiométrica de un fotón por molécula de gas NO que se introduce en el detector de quimioluminiscencia (CLD). La reacción de quimioluminiscencia se obtiene en una cámara designada suministrada con ozono (O3) de un generador interno, que se mantiene a presión negativa mediante conexión con una bomba externa, lo que permite la entrada continua y constante de gas de muestra. La generación de O3 requiere oxígeno diatómico (O2) que es suministrado por un tanque de O2 dedicado conectado con el CLD (otros fabricantes proporcionan CLD que funcionan con aire ambiente). Dentro de la cámara de reacción, cada molécula de gas NO contenida en el gas muestreado reacciona con el oxígeno para producir una molécula de dióxido de nitrógeno en el estado activado (NO2*). Al volver a su estado fundamental, cada molécula de NO2* emite un fotón que es detectado por un tubo fotomultiplicador (PMT) ubicado adyacente a la cámara de reacción. El PMT con el amplificador asociado y la unidad central de procesamiento produce una señal proporcional al recuento de fotones y al número de moléculas de NO en la cámara de reacción. Haga clic aquí para ver una versión más grande de esta figura.
La entrada de muestra del CLD se puede conectar a un sistema de cristalería que contiene una cámara de reacción para muestras líquidas. El sistema se purga continuamente con un gas inerte como nitrógeno, helio o argón, transfiriendo NO de la cámara de reacción a la CLD. Las muestras en fase líquida se inyectan a través de una membrana dedicada en el recipiente de purga.
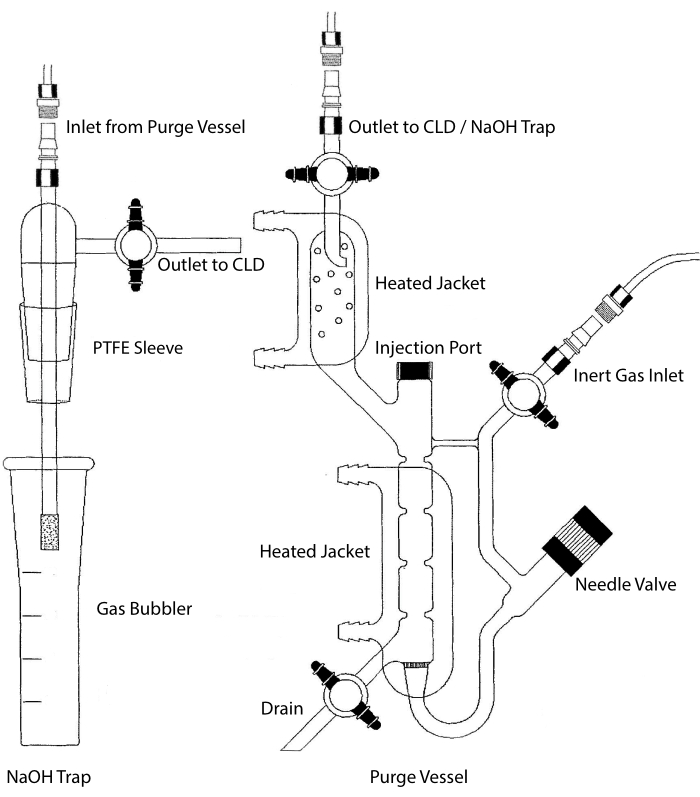
Figura 2: Estructura de un recipiente de purga para la detección basada en quimioluminiscencia de gas de óxido nítrico El recipiente de purga (derecha) permite la detección de gas de óxido nítrico (NO) o cualquier otro compuesto que se pueda convertir fácilmente en gas NO cuando se libera de un reactivo en fase líquida. La entrada de gas inerte está conectada a una fuente (tanque) de un gas inerte como Argón, Xeon o nitrógeno diatómico (N2). La válvula de la aguja (se abre a la izquierda) se utiliza para el control de la presión dentro del recipiente de purga y se puede quitar completamente para limpiar el recipiente. El puerto de inyección está cubierto por una tapa con un tabique de membrana para la inyección de muestra. La membrana debe reemplazarse con frecuencia. Una camisa calentada rodea la cámara de reacción y se conecta a un baño de agua caliente para realizar el ensayo VCl3 en HCl. La salida del vaso de purga está conectada al detector de quimioluminiscencia (CLD) o a la trampa de NaOH (requerida para VCl3 en ensayos de HCl). Para drenar el contenido de la cámara de reacción, primero cierre las llaves de paso en la entrada de gas inerte y la salida del recipiente de purga, cierre la válvula de la aguja, retire la tapa en el puerto de inyección y finalmente abra la llave de paso en el drenaje. Se requiere que la trampa de NaOH (izquierda) se coloque en línea entre el recipiente de purga y el CLD si se realiza el ensayo VCl3 en HCl debido a la corrosividad del HCl. La conexión al CLD siempre requiere que se coloque un filtro dieléctrico de campo intenso (IFD) entre el CLD y la salida del recipiente de purga (o la trampa de NaOH, si se usa). El filtro IFD elimina las partículas en el aire y evita que el líquido pase a través del recipiente de purga. PTFE = politetrafluoroetileno. Haga clic aquí para ver una versión más grande de esta figura.
Como consecuencia, cualquier compuesto que pueda convertirse en NO a través de una reacción química específica y controlada puede ser detectado con alta sensibilidad en cualquier fluido biológico y homogeneizado tisular24. La medición directa del NO en fase gaseosa a través de la quimioluminiscencia se realiza tanto en entornos experimentales como clínicos. Estas técnicas se describen ampliamente en otra parte 33,34,35. La medición de NO2–, S-nitrosotioles, proteínas S-nitrosatadas y Fe-NOs se puede realizar agregando muestras en una mezcla de reacción con triyoduro (I3–), que libera estequiométricamente gas NO de todos estos compuestos:
I3– → I2 + I–
2NO2− +2I− +4H+ → 2NO + I2 +2H2O
I3− + 2RS-NO → 3I− + RSSR + 2NO+
2NO+ + 2I− → 2NO + I2
mientras que I3– no reacciona con NO 3-15. Las mediciones precisas de cada compuesto son posibles mediante el tratamiento previo de las alícuotas de muestra con sulfanilamida acidificada (AS) con o sin cloruro mercúrico (HgCl2). Específicamente, el pretratamiento con AS elimina todo el contenido de NO2. Como consecuencia, el contenido de NO medido por el CLD solo refleja la suma de la concentración de S-NOs y Fe-NOs. La inyección de HgCl2 en una muestra alícuota antes de la inyección de AS hace que S-NO libere NO2-. El tratamiento con AS (que conduce a la eliminación de NO2– ) garantiza que el contenido de NO medido solo refleje la concentración de Fe-NOs. Una serie de restas entre las evaluaciones permiten calcular la concentración precisa de los tres derivados de NO22.
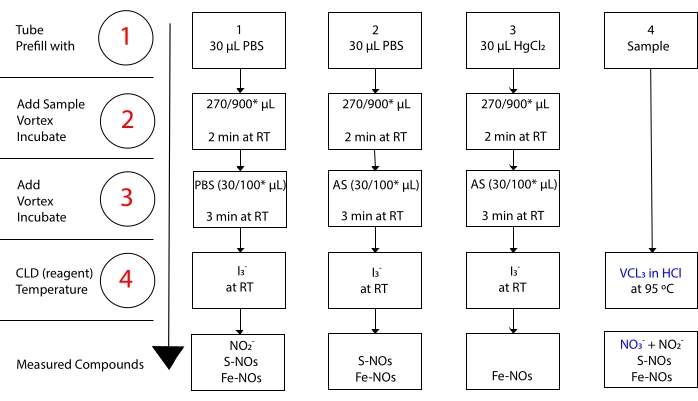
Figura 3: Pasos en la preparación de la muestra para el ensayo de quimioluminiscencia de ácido acético I3– in. Se ilustran los pasos secuenciales para la preparación del ensayo de quimioluminiscencia de ácido acético I3– in. Se requiere el uso de tubos de centrífuga protegidos contra la luz. Los tubos 1, 2 y 3 son los que se utilizan para prepararse para el ensayo. Se necesita otra alícuota de muestra (tubo 4) para el ensayo VCl3 en HCl si se requiere la medición de nitrato (NO3–). Los pasos se indican con números en rojo. Prellene (Paso 1) como se indica con solución salina tampón de fosfato (PBS) o HgCl2 antes de agregar el volumen de la muestra. Agregue el volumen de muestra (2) como se indica, vórtice e incube durante 2 min a temperatura ambiente (RT). Agregue (3) PBS o sulfanilamida acidificada (AS) según lo indicado, vórtice e incube durante 3 min a RT. Ejecute el ensayo (4). La concentración medida por el ensayo es la suma de la concentración de los compuestos reportados debajo de cada tubo. El tubo número 1 permitirá mediciones de nitrito (NO2–), S-nitrosotioles (S-NO) y complejos hierro-nitrosil (Fe-NOs) como una sola señal. Para la medición del nitrato (NO3–), las muestras se ejecutarán con I3– en ácido acético y VCl3 en ensayos de HCl, y el valor obtenido del tubo 1 deberá restarse del obtenido del tubo 4. *cantidades sugeridas para ser utilizadas para el análisis de Hb para la determinación de NO 2-residual, S-nitrosohemoglobina y hierro-nitrosil-hemoglobina. Haga clic aquí para ver una versión más grande de esta figura.
Para la medición de NO3, el cloruro de vanadio (III) (VCl3) en ácido clorhídrico (HCl) se utiliza para la conversión de NO3 a NO en el recipiente de purga con el fin de medir NO3– estequiométricamente con la EPC:
2 NO3–+ 3V+3 + 2H2O → 2NO + 3VO2+ + 4H+
Para lograr una conversión suficientemente rápida, la reacción debe realizarse a 90-95 ° C. La reducción de NO3 a NO 2 se combina con la reducción de NO2 a NO por HCl. El metal de vanadio también reduce los S-NO liberando su fracción de NO22,36. La concentración final obtenida por CLD con VCl3 en HCl refleja la concentración agregada de NO3–, NO2 y otros compuestos nitrosados. La sustracción de este último valor de la concentración obtenida con CLD con I3– permite el cálculo de la concentración de NO3– 36,37 (Figura 3).
En el ensayo de consumo de NO, la liberación continua de NO en el recipiente de purga por donantes de NO como (Z)-1-[2-(2-aminoethyl)-N-(2-ammonioethyl)amino]diazen-1-ium-1,2-diolate (DETA-NONOate) genera una señal estable que permite cuantificar el oxiHb libre de células en las muestras inyectadas. La cantidad de NO consumido en el recipiente de purga está en una relación estequiométrica con la cantidad de oxyHb en la muestra38.
Se ilustran los protocolos para la medición de NO2–, NO3–, S-nitrosotioles, complejos hierro-nitrosil y no consumo de NO por Hb libre de células en muestras de plasma. Los estudios sobre el NO en el entorno de los glóbulos rojos requieren un tratamiento muestral específico seguido de cromatografía de exclusión para medir S-NO-Hb y Hb-NO extremadamente frágiles junto con la determinación de la concentración total de Hb15,22. La preparación de la muestra es fundamental para corregir la medición. La preexistencia de NO2– en H2O y la liberación de NO2– durante el ensayo pueden conducir a la medición de concentraciones artificialmente más altas de derivados de NO como S-NO-Hb14,39. También se presentan aspectos importantes de la preparación de la muestra.
Protocol
Representative Results
Discussion
Debido a la alta sensibilidad, los ensayos basados en quimioluminiscencia para la determinación de NO y compuestos relacionados tienen un alto riesgo de contaminación por NO2. Cada reactivo (especialmente la solución de bloqueo de NO2) y diluyente (incluido ddH2O) utilizado en el experimento debe probarse por su contenido de NO2– para corregir la señal de fondo. El nitrito es extremadamente reactivo con una vida media en sangre total alreded…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Los protocolos reportados en este manuscrito fueron posibles gracias a las contribuciones acumuladas de becarios anteriores del laboratorio de Investigación de Anestesia en Cuidados Críticos del Dr. Warren Zapol, Departamento de Anestesia del Hospital General de Massachusetts. Reconocemos la contribución de los Dres. Akito Nakagawa, Francesco Zadek, Emanuele Vassena, Chong Lei, Yasuko Nagasaka, Ester Spagnolli y Emanuele Rezoagli.
Materials
| Acetic Acid | Sigma | 45754 | 500 mL – liquid |
| Antifoam B Emulsion | Sigma | A5757 | 250 mL – liquid |
| DETA NONOate | Cayman | 82120 | 10 mg |
| Gibco DPBS (1x) no calcium, no magnesium | ThermoFisher | 14190144 | 500 mL |
| Hydroochloric Acid 37% (1 M) | Sigma | 258148 | 500 mL – liquid |
| Iodine | SAFC | 207772 | 100 g – solid |
| Kimwipes | Kimtech | 34155 | |
| Mercury (II) Chloride ACS reagent> 99.5% | Sigma | 215465 | 100 g – solid (dissolve in water) |
| Mili-Q Water Purification System | Millipore | ||
| Model 705 RN 50 μL syringe | Hamilton | 80530 | Microliter syringe |
| Model 802 N 25 μL Syringe | Hamilton | 84854 | Microliter syringe |
| N-ethylmaleimide | Sigma | 4260 | 25 g – crystalline |
| Nitric Oxide Analyzer + Bundle Software – Purge Vessel | Zysense | NOA 280i | Chemiluminescence Detector |
| Nonidet p-40 (NP-40) | ThermoFisher | 85125 | 10% – 500 mL |
| Potassium hexacyanoferrate (III) ACS reagent≥ 99% | Sigma | 244023 | 100 g – powder |
| Potassium Iodide ACS reagent> 99% | Sigma | 221945 | 100 g – solid |
| Potassium Nitrite cryst. For analysis EMSURE ACS | Supelco | 105067 | 250 g – crystalline |
| PowerGen 125 | Fisher Scientific | 14-359-251 | Mechanic Homogenizer |
| RV3 Two Stage Rotary Vane Pump | Edwards | A65201906 | Vacuum Pump – Bundled with analyzer |
| Sodium Heparin – BD Hemogard Clo | BD Biosciences | BD367871 | 75 USP Units |
| Sodium hydroxide anhydrous ACS reagent ≥ 97% | Sigma | 795429 | 1 kg – pelletts |
| Sodium Nitrate ACS reagent ≥ 99% | Sigma | 221341 | 500 g – powder |
| Sodium nitrite ≥ 99% | Sigma | S2252 | 500 g – crystalline |
| Sulfanilamide ≥ 98% | Sigma | S9251 | 100 g – solid |
| Vanadium (III) Chloride | Sigma | 112393 | 25 g – solid – Caution (exothermic) |
| Whatman 1 Filter Paper | Sigma | WHA10010155 |
Riferimenti
- Palmer, R. M. J., Ferrige, A. G., Moncada, S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature. 327 (6122), 524-526 (1987).
- Furchgott, R. F. The discovery of endothelium-derived relaxing factor and its importance in the identification of nitric oxide. JAMA: The Journal of the American Medical Association. 276 (14), 1186 (1996).
- Ignarro, L. J., Buga, G. M., Byrns, R. E., Wood, K. S., Chaudhuri, G. Endothelium-derived relaxing factor and nitric oxide possess identical pharmacologic properties as relaxants of bovine arterial and venous smooth muscle. The Journal of Pharmacology and Experimental Therapeutics. 246 (1), 218-226 (1998).
- Arnold, W. P., Mittal, C. K., Katsuki, S., Murad, F. Nitric oxide activates guanylate cyclase and increases guanosine 3′:5′-cyclic monophosphate levels in various tissue preparations. Proceedings of the National Academy of Sciences of the United States of America. 74 (8), 3203-3207 (1977).
- Hayashida, K., et al. Depletion of vascular nitric oxide contributes to poor outcomes after cardiac arrest. American Journal of Respiratory and Critical Care Medicine. 199 (10), 1288-1290 (2019).
- Ignarro, L. J. Inhaled NO and COVID-19. British Journal of Pharmacology. 177 (16), 3848-3849 (2020).
- Gantner, B. N., LaFond, K. M., Bonini, M. G. Nitric oxide in cellular adaptation and disease. Redox Biology. 34, 101550 (2020).
- Clark, R. H., et al. Low-dose nitric oxide therapy for persistent pulmonary hypertension of the newborn. New England Journal of Medicine. 342 (7), 469-474 (2000).
- Goldbart, A., et al. Inhaled nitric oxide therapy in acute bronchiolitis: A multicenter randomized clinical trial. Scientific Reports. 10 (1), (2020).
- Bangirana, P., et al. Inhaled nitric oxide and cognition in pediatric severe malaria: A randomized double-blind placebo controlled trial. PloS One. 13 (1), 0191550 (2018).
- Jiang, S., Dandu, C., Geng, X. Clinical application of nitric oxide in ischemia and reperfusion injury: A literature review. Brain Circulation. 6 (4), 248-253 (2020).
- Lei, C., et al. Nitric oxide decreases acute kidney injury and stage 3 chronic kidney disease after cardiac surgery. American Journal of Respiratory and Critical Care Medicine. 198 (10), 1279-1287 (2018).
- Kelm, M. Nitric oxide metabolism and breakdown. Biochimica et Biophysica Acta. 1411 (2-3), 273-289 (1999).
- Bryan, N. S., Grisham, M. B. Methods to detect nitric oxide and its metabolites in biological samples. Free Radical Biology and Medicine. 43 (5), 645-657 (2007).
- Macarthur, P. H., Shiva, S., Gladwin, M. T. Measurement of circulating nitrite and S-nitrosothiols by reductive chemiluminescence. Journal of Chromatography B. 851 (1-2), 93-105 (2007).
- Helms, C., Kim-Shapiro, D. B. Hemoglobin-mediated nitric oxide signaling. Free Radical Biology and Medicine. 61, 464-472 (2013).
- Kim-Shapiro, D. B., Schechter, A. N., Gladwin, M. T. Unraveling the reactions of nitric oxide, nitrite, and hemoglobin in physiology and therapeutics. Arteriosclerosis, Thrombosis, and Vascular Biology. 26 (4), 697-705 (2006).
- Rezoagli, E., et al. Pulmonary and systemic vascular resistances after cardiopulmonary bypass: role of hemolysis. Journal of Cardiothoracic and Vascular Anesthesia. 31 (2), 505-515 (2017).
- Shiva, S. Nitrite: A physiological store of nitric oxide and modulator of mitochondrial function. Redox Biology. 1 (1), 40-44 (2013).
- Lundberg, J. O., Weitzberg, E., Gladwin, M. T. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nature Reviews Drug Discovery. 7 (2), 156-167 (2008).
- Heinrich, T. A., Da Silva, R. S., Miranda, K. M., Switzer, C. H., Wink, D. A., Fukuto, J. M. Biological nitric oxide signalling: chemistry and terminology. British Journal of Pharmacology. 169 (7), 1417-1429 (2013).
- Yang, B. K., Vivas, E. X., Reiter, C. D., Gladwin, M. T. Methodologies for the sensitive and specific measurement of s -nitrosothiols, iron-nitrosyls, and nitrite in biological samples. Free Radical Research. 37 (1), 1-10 (2003).
- Hayashida, K., et al. Improvement in outcomes after cardiac arrest and resuscitation by inhibition of s-nitrosoglutathione reductase. Circulation. 139 (6), 815-827 (2019).
- Rodríguez-Ortigosa, C. M., et al. Biliary secretion of S-nitrosoglutathione is involved in the hypercholeresis induced by ursodeoxycholic acid in the normal rat. Hepatology. 52 (2), 667-677 (2010).
- Mitchell, D. A., Marletta, M. A. Thioredoxin catalyzes the S-nitrosation of the caspase-3 active site cysteine. Nature Chemical Biology. 1 (3), 154-158 (2005).
- Mannick, J. B., et al. Fas-induced caspase denitrosylation. Science. 284 (5414), 651-654 (1999).
- Choi, Y. -. B., et al. Molecular basis of NMDA receptor-coupled ion channel modulation by S-nitrosylation. Nature Neuroscience. 3 (1), 15-21 (2000).
- Eu, J. P., Sun, J., Xu, L., Stamler, J. S., Meissner, G. The skeletal muscle calcium release channel: Coupled O2 sensor and NO signaling functions. Cell. 102 (4), 499-509 (2000).
- Stamler, J. S., et al. Nitric oxide circulates in mammalian plasma primarily as an S-nitroso adduct of serum albumin. Proceedings of the National Academy of Sciences of the United States of America. 89 (16), 7674-7677 (1992).
- Dunham, A. J., Barkley, R. M., Sievers, R. E. Aqueous nitrite ion determination by selective reduction and gas phase nitric oxide chemiluminescence. Analytical Chemistry. 67 (1), 220-224 (1995).
- Hogg, N., Zielonka, J., Kalyanaraman, B., Ignarro, L. J., Freeman, B. A. Detection of Nitric Oxide and Peroxynitrite in Biological Systems: A State-of-the-Art Review. Nitric Oxide (Third Edition). , 23-44 (2017).
- Gudem, M., Hazra, A. Mechanism of the chemiluminescent reaction between nitric oxide and ozone. The Journal of Physical Chemistry A. 123 (4), 715-722 (2019).
- Ishibe, Y., Liu, R., Hirosawa, J., Kawamura, K., Yamasaki, K., Saito, N. Exhaled nitric oxide level decreases after cardiopulmonary bypass in adult patients. Critical Care Medicine. 28 (12), 3823-3827 (2000).
- American Thoracic Society, European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide, 2005. American Journal of Respiratory and Critical Care Medicine. 171 (8), 912-930 (2005).
- Cuthbertson, B. H., Stott, S. A., Webster, N. R. Exhaled nitric oxide as a marker of lung injury in coronary artery bypass surgery. British Journal of Anaesthesia. 89 (2), 247-250 (2002).
- Ewing, J. F., Janero, D. R. Specific S-nitrosothiol (thionitrite) quantification as solution nitrite after vanadium(III) reduction and ozone-chemiluminescent detection. Free Radical Biology and Medicine. 25 (4-5), 621-628 (1998).
- Braman, R. S., Hendrix, S. A. Nanogram nitrite and nitrate determination in environmental and biological materials by vanadium(III) reduction with chemiluminescence detection. Analytical Chemistry. 61 (24), 2715-2718 (1989).
- Wang, X., et al. Biological activity of nitric oxide in the plasmatic compartment. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11477-11482 (2004).
- Bryan, N. S., Rassaf, T., Rodriguez, J., Feelisch, M. Bound NO in human red blood cells: fact or artifact. Nitric Oxide. 10 (4), 221-228 (2004).
- Kida, K., Shirozu, K., Yu, B., Mandeville, J. B., Bloch, K. D., Ichinose, F. Beneficial effects of nitric oxide on outcomes after cardiac arrest and cardiopulmonary resuscitation in hypothermia-treated mice. Anesthesiology. 120 (4), 880-889 (2014).
- Gladwin, M. T., et al. S-Nitrosohemoglobin is unstable in the reductive erythrocyte environment and lacks O2/NO-linked allosteric function. The Journal of Biological Chemistry. 277 (31), 27818-27828 (2002).
- Feelisch, M., et al. and heme-nitros(yl)ation in biological tissues and fluids: implications for the fate of NO in vivo. The FASEB Journal. 16 (13), 1775-1785 (2002).
- Liu, T., et al. L-NAME releases nitric oxide and potentiates subsequent nitroglycerin-mediated vasodilation. Redox Biology. 26, 101238 (2019).
- Piknova, B., Park, J. W., Cassel, K. S., Gilliard, C. N., Schechter, A. N. Measuring nitrite and nitrate, metabolites in the nitric oxide pathway, in biological materials using the chemiluminescence method. Journal of Visualized Experiments: JoVE. (118), e54879 (2016).
- Keefer, L. K., Nims, R. W., Davies, K. M., Wink, D. A. 34;NONOates" (1-substituted diazen-1-ium-1,2-diolates) as nitric oxide donors: Convenient nitric oxide dosage forms. Methods in Enzymology. , 281-293 (1996).
- Nagababu, E., Rifkind, J. M. Measurement of plasma nitrite by chemiluminescence without interference of S-, N-nitroso and nitrated species. Free Radical Biology and Medicine. 42 (8), 1146-1154 (2007).
- Doctor, A., et al. Hemoglobin conformation couples erythrocyte S-nitrosothiol content to O2 gradients. Proceedings of the National Academy of Sciences of the United States of America. 102 (16), 5709-5714 (2005).
- Zhang, Y., Keszler, A., Broniowska, K. A., Hogg, N. Characterization and application of the biotin-switch assay for the identification of S-nitrosated proteins. Free Radical Biology and Medicine. 38 (7), 874-881 (2005).
- Davies, I. R., Zhang, X., Poole, R. K. Nitric Oxide Selective Electrodes. Methods in enzymology. , 63-95 (2008).
- Saito, J., et al. Comparison of fractional exhaled nitric oxide levels measured by different analyzers produced by different manufacturers. Journal of Asthma. 57 (11), 1216-1226 (2020).

