Autofluorescence Imaging for å evaluere cellulær metabolisme
Summary
Denne protokollen beskriver fluorescensavbildning og analyse av endogene metabolske koenzymer, redusert nikotinamid adenin (fosfat) dinukleotid (NAD(P)H) og oksidert flavin adenin dinukleotid (FAD). Autofluorescence imaging av NAD (P)H og FAD gir en etikettfri, ikke-ødeleggende metode for å vurdere cellulær metabolisme.
Abstract
Cellulær metabolisme er prosessen der celler genererer energi, og mange sykdommer, inkludert kreft, er preget av unormal metabolisme. Redusert nikotinamid adenin (fosfat) dinukleotid (NAD(P)H) og oksidert flavin adenin dinukleotid (FAD) er koenzymer av metabolske reaksjoner. NAD(P)H og FAD utviser autofluorescens og kan isoleres av eksitasjons- og utslippsbølgelengder. Både koenzymer, NAD (P)H og FAD, kan eksistere i enten en fri eller proteinbundet konfigurasjon, som hver har en tydelig fluorescens levetid – tiden som fluoroforen forblir i spent tilstand. Fluorescens livstidsavbildning (FLIM) tillater kvantifisering av fluorescensintensiteten og levetiden til NAD (P)H og FAD for etikettfri analyse av cellulær metabolisme. Fluorescensintensitet og livstidsmikroskop kan optimaliseres for avbildning av NAD(P)H og FAD ved å velge passende eksitasjons- og utslippsbølgelengder. Metabolske perturbasjoner ved cyanid verifiserer autofluorescence imaging protokoller for å oppdage metabolske endringer i celler. Denne artikkelen vil demonstrere teknikken for autofluorescence imaging av NAD (P)H og FAD for måling av cellulær metabolisme.
Introduction
Metabolisme er den cellulære prosessen med å produsere energi. Cellulær metabolisme omfatter flere veier, inkludert glykolyse, oksidativ fosforylering og glutaminolyse. Sunn celler bruker disse metabolske veiene for å generere energi til spredning og funksjon, for eksempel produksjon av cytokiner av immunceller. Mange sykdommer, inkludert metabolske forstyrrelser, kreft og nevrodegenerasjon, er preget av endret cellulær metabolisme1. For eksempel har noen kreftcelletyper forhøyede glykolysehastigheter, selv i nærvær av oksygen, for å generere molekyler for syntese av nukleinsyrer, proteiner og lipider2,3. Dette fenomenet, kjent som Warburg-effekten, er et kjennetegn på mange krefttyper, inkludert brystkreft, lungekreft og glioblastomer4. På grunn av endringene i cellulær metabolisme forbundet med kreftprogresjon, kan cellulær metabolisme være en surrogatbiomarkør for legemiddelrespons5,6. Videre er det avgjørende å forstå legemiddeleffekten på cellenivå, da celle heterogenitet kan føre til forskjellige legemiddelresponser hos personer7,8.
Teknologier som identifiserer og kvantifiserer endringer i cellulær metabolisme er avgjørende for studier av kreft og legemiddelrespons. Kjemiske og proteinanalyser brukes til å evaluere metabolismen av celler eller vev, men mangler encellet oppløsning og romlig informasjon. Metabolske plateleserbaserte analyser kan måle pH- og oksygenforbruk i prøven over tid og den påfølgende metabolske perturbasjonen av kjemikalier. pH kan brukes til å beregne den ekstracellulære forsuringshastigheten (ECAR), som gir et innblikk i cellenes glykolytiske aktivitet9. Avbildningsmetoder for hele kroppen, inkludert 2-[fluor-18] fluor-D-glukose positronutslippstomografi (FDG PET) og magnetisk resonansspektroskopi (MRS), er ikke-invasive avbildningsmodaliteter som brukes klinisk for å identifisere tumor gjentakelse og legemiddeleffekt gjennom metabolske målinger10,11,12,13,14.
FDG-PET tar bilder av vevsopptaket til FDG, en radiomerket glukoseanalog. Økt opptak av FDG-PET av svulster i forhold til omkringliggende vev skyldes Warburg-effekten12,13. MRS-bilder vanlige kjerner av molekyler som brukes til metabolisme, for eksempel 13C og 31P, og kan få dynamisk informasjon om hvordan metabolisme endres som respons på stimuli, for eksempel trening eller spising14. Selv om FDG-PET og MRS kan brukes klinisk, mangler disse teknologiene den romlige oppløsningen for å løse intratumoral heterogenitet. På samme måte gjøres oksygenforbruksmålinger på en bulkpopulasjon av celler. Autofluorescence imaging overvinner den romlige oppløsningen hinderet for disse teknologiene og gir en ikke-invasiv metode for kvantifisering av cellulær metabolisme.
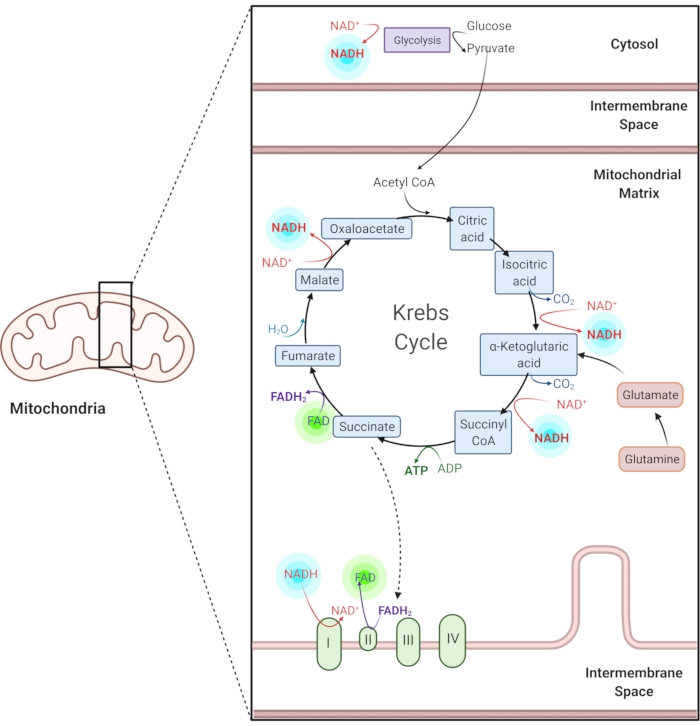
Figur 1: NADH og FAD i vanlige metabolske veier. NADH og FAD er koenzymer som brukes i glykolyse, Krebs-syklusen og elektrontransportkjeden. Autofluorescence avbildning av disse molekylene gir informasjon om cellulær metabolisme. Klikk her for å se en større versjon av denne figuren.
Redusert nikotinamid adenin (fosfat) dinukleotid (NAD(P)H) og oksidert flavin adenin dinukleotid (FAD) er koenzymer av metabolske reaksjoner, inkludert glykolyse, oksidativ fosforylering og glutaminolyse (figur 1). Både NAD(P)H og FAD er autofluorescerende og gir endogen kontrast for fluorescensavbildning1,15. NADPH har lignende fluorescerende egenskaper som NADH. På grunn av dette brukes NAD(P)H ofte til å representere det kombinerte signalet til NADH og NADPH2,16.
Fluorescens livstidsavbildning (FLIM) kvantifiserer fluorescenslevetiden eller tiden som en fluorofor er i spent tilstand. Fluorescenslevetidene reagerer på mikromiljøet i fluoroforene og gir informasjon om cellulær metabolisme17. NAD(P)H og FAD kan eksistere i celler i enten proteinbundne eller frie konformasjoner, som hver har forskjellig levetid. Gratis NAD(P)H har kortere levetid enn proteinbundet NAD(P)H; på den annen side har fri FAD lengre levetid enn bundet FAD18,19. Levetids- og levetidskomponentvektene kan kvantifiseres fra fluorescenslevetidsforfallsdata gjennom Eq. (1)20:
I(t) = α 1e-t/τ1 + α 2e-t/τ2 + C (1)
Eq (1) representerer den normaliserte fluorescensintensiteten som en tidsfunksjon. Den α 1 og α 2 i denne ligningen representerer de proporsjonale komponentene i kort og lang levetid (henholdsvis α 1+ α 2 = 1), henholdsvis τ1 og τ2 representerer henholdsvis korte og lange levetider, og C står for bakgrunnslys7,20. Den amplitudevektede levetiden, representert her som τm, beregnes ved hjelp av Eq. (2).
τm= α 1τ1+ α 2τ2 (2)
En gjennomsnittlig levetid kan beregnes ved å beregne “t” over fluoroforens intensitetsforfall, som for et to eksponentielt forfall er vist av Eq. (3)17,21.
τ*m= (α 1τ12+ α 2τ22)/ (α 1τ1+ α 2τ2) (3)
Et fluorescensintensitetsbilde kan beregnes fra levetidsbildet ved å integrere fluorescenslevetidens forfall. Autofluorescence avbildning er en ikke-ødeleggende og etikettfri metode som kan brukes til å karakterisere metabolismen av levende celler med en subcellulær oppløsning. Det optiske redoksforholdet gir en optisk analog beregning av cellens kjemiske redokstilstand og beregnes som forholdet mellom NAD(P)H- og FAD-intensiteter. Selv om formelen for beregning av det optiske redoksforholdet ikke er standardisert22,23,24,25, er det her definert som intensiteten av FAD over de kombinerte intensitetene til NAD (P)H og FAD. Denne definisjonen brukes fordi den summerte intensiteten i nevneren normaliserer metrikkverdien mellom 0 og 1, og det forventede resultatet av cyanidinhiberingen er en reduksjon i redoksforholdet. Fluorescenslevetidene til fri NAD(P)H og FAD gir innsikt i endringer i det metabolske løsningsmiddelmikromiljøet, inkludert pH, temperatur, nærhet til oksygen og osmolaritet17.
Endringer i fluorescenslevetiden for de bundne fraksjonene av NAD(P)H og FAD kan indikere metabolsk baneutnyttelse og substratspesifikk metabolisme26. Komponentvekter kan tolkes for endringer i fri til den bundne brøkdelen av koenzymene18,19. Til sammen tillater disse kvantitative autofluorescence levetidsmålingene analysen av cellulær metabolisme, og autofluorescence imaging har blitt brukt til å identifisere neoplasmer fra normale vev27,28, karakterisere stamceller29,30, evaluere immuncellefunksjon31,32,33,34,35, måle nevrologisk aktivitet36, 37,38, og forstå legemiddeleffekt i krefttyper som brystkreft og hode- og nakkekreft21,39,40,41,42. Høyoppløselig autofluorescence-avbildning kan kombineres med bildesegmentering for encellet analyse og kvantifisering av intrapopulerings heterogenitet43,44,45,46,47.
NAD(P)H og FAD kan avbildes på enkeltfoton- eller multifotonfluorescensmikroskoper som er konfigurert for intensitet eller livstidsavbildning. For enkeltfotonmikroskoper er NAD(P)H og FAD vanligvis begeistret for bølgelengder på henholdsvis 375-405 nm og 488 nm på grunn av vanlige laserkilder ved disse bølgelengdene48. I to-foton fluorescens excitation, NAD (P)H og FAD vil begeistre ved bølgelengder på ca 700 til 750 nm og 700 til 900 nm, henholdsvis15,49. Når fluoroforene er begeistret, avgir NAD(P)H og FAD fotoner ved bølgelengder mellom ~ 410 nm til ~ 490 nm og ~ 510 nm til ~ 640 nm, henholdsvis15. NAD(P)H og FAD maxima utslipp bølgelengder er ca 450 nm og 535 nm, henholdsvis48.
På grunn av deres forskjellige eksitasjons- og utslippsbølgelengder, kan fluorescensen til de to metabolske koenzymene isoleres spektralt. En forståelse av spektralkarakteristikkene til NAD(P)H og FAD er nødvendig for design og optimalisering av autofluorescence imaging protokoller. Cyanid er en elektrontransportkjede (ETC) kompleks IV-hemmer. Effektene av cyanid på cellulær metabolisme og autofluorescensintensiteter og levetider for NAD(P)H og FAD i celler er godt karakterisert27,40. Derfor er et cyanidperturbasjonseksperiment et effektivt middel for å validere NAD(P)H- og FAD-bildebehandlingsprotokoller. Et vellykket cyanideksperiment gir tillit til at NAD(P)H- og FAD-bildebehandlingsprotokollen kan brukes til å vurdere metabolismen av ukjente grupper eller perturbasjoner.
Protocol
Representative Results
Discussion
Autofluorescence intensitet og livstidsavbildning har blitt mye brukt til å vurdere metabolisme i celler21,55. FLIM er høyoppløselig og løser derfor enkeltceller, noe som er viktig for kreftstudier fordi cellulær heterogenitet bidrar til tumor aggresjon og narkotikaresistens7,39,41,44,45,46,58.<su…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Finansieringskilder inkluderer Cancer Prevention and Research Institute of Texas (CPRIT RP200668) og Texas A&M University. Figur 1 ble opprettet med BioRender.com.
Materials
| 2-deoxy-d-glucose (2-DG) | Sigma | AC111980000; AC111980010; AC111980050; AC111980250 | |
| Antibiotic Antimicrobial (pen-strep) | Gibco | 15240096 | |
| Cell Samples | American Type Culture Collection | N/A | MCF-7 cancer line |
| CellProfiler | Broad Institute | N/A | Image analysis software |
| Conical Tube | VWR | 89039-664 | 15 mL conical tube |
| DMEM | ThermoFisher | 11965092 | Culture media |
| FAD dichroic mirror | Semrock | FF495-Di03-25×36 | 495 nm |
| FAD emission filter | Semrock | FF01-550/88-25 | 550/88 nm |
| FAD excitation filter | Semrock | FF01-458/64-25 | 458/64 nm |
| FBS | ThermoFisher | 16000036 | |
| Fluorescence Lifetime Microscope | 3i | N/A | |
| Glass bottom dish | MatTek Corp | P35G-1.0-14-C | |
| Multiphoton Laser | Coherent | N/A | 2P Coherent Laser, Tunable 680 nm-1080 nm |
| NAD(P)H dichroic mirror | Semrock | FF409-Di03-25×36 | 409 nm |
| NAD(P)H emission filter | Semrock | FF02-447/60-25 | 447/60 nm |
| NAD(P)H excitation filter | Semrock | FF01-357/44-25 | 357/44 nm |
| PBS | ThermoFisher | 70011044 | |
| Potassium Cyanide | Sigma-Aldrich | 380970 | |
| SlideBooks 6 | 3i | N/A | Image acquisition software |
| SPCImage | Becker & Hickl GmbH | N/A | Fluorescence lifetime analysis software |
| Stage Top Incubator | okoLab | N/A | |
| Trypsin | Biosciences | 786-262 | |
| Urea | Sigma-Aldrich | U5128 | |
| YG beads | Polysciences | 19096-2 | Yg microspheres (20.0 µm) |
Riferimenti
- Heikal, A. A. Intracellular coenzymes as natural biomarkers for metabolic activities and mitochondrial anomalies. Biomarkers in Medicine. 4 (2), 241-263 (2010).
- Georgakoudi, I., Quinn, K. P. Optical imaging using endogenous contrast to assess metabolic state. Annual Review of Biomedical Engineering. 14, 351-367 (2012).
- Zheng, J. Energy metabolism of cancer: Glycolysis versus oxidative phosphorylation (Review). Oncology Letters. 4 (6), 1151-1157 (2012).
- Potter, M., Newport, E., Morten, K. J. The Warburg effect: 80 years on. Biochemical Society Transactions. 44 (5), 1499-1505 (2016).
- Zhao, Y., Butler, E. B., Tan, M. Targeting cellular metabolism to improve cancer therapeutics. Cell Death and Disease. 4 (3), 532 (2013).
- Patel, S., Ahmed, S. Emerging field of metabolomics: Big promise for cancer biomarker identification and drug discovery. Journal of Pharmaceutical and Biomedical Analysis. 107, 63-74 (2015).
- Walsh, A. J., Cook, R. S., Skala, M. C. Functional optical imaging of primary human tumor organoids: Development of a personalized drug screen. Journal of Nuclear Medicine. 58 (9), 1367-1372 (2017).
- Zaal, E. A., Berkers, C. R. The influence of metabolism on drug response in cancer. Frontiers in Oncology. 8, 500 (2018).
- Little, A. C., et al. High-content fluorescence imaging with the metabolic flux assay reveals insights into mitochondrial properties and functions. Communications Biology. 3 (1), 271 (2020).
- Wang, X., et al. Comparison of magnetic resonance spectroscopy and positron emission tomography in detection of tumor recurrence in posttreatment of glioma: A diagnostic meta-analysis. Asia-Pacific Journal of Clinical Oncology. 11 (2), 97-105 (2015).
- Nabi, H. A., Zubeldia, J. M. Clinical applications of 18F-FDG in oncology. Journal of Nuclear Medicine Technology. 30 (1), 3-9 (2002).
- Kostakoglu, L., Agress, H., Goldsmith, S. J. Clinical role of FDG PET in evaluation of cancer patients. Radiographics. 23 (2), 315-340 (2003).
- Hoh, C. K. Clinical use of FDG PET. Nuclear Medicine and Biology. 34 (7), 737-742 (2007).
- van de Weijer, T., Schrauwen-Hinderling, V. B. Application of magnetic resonance spectroscopy in metabolic research. Biochimica et Biophysica Acta. Molecular Basis of Disease. 1865 (4), 741-748 (2019).
- Huang, S., Heikal, A. A., Webb, W. W. Two-photon fluorescence spectroscopy and microscopy of NAD(P)H and Flavoprotein. Biophysical Journal. 82, 2811-2825 (2002).
- Lagarto, J. L., et al. Characterization of NAD(P)H and FAD autofluorescence signatures in a Langendorff isolated-perfused rat heart model. Biomedical Optics Express. 9 (10), 4961-4978 (2018).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. , (2013).
- Lakowicz, J. R., Szmacinski, H., Nowaczyk, K., Johnson, M. L. Fluorescence lifetime imaging of free and protein-bound NADH. Proceedings of the National Academy of the Sciences of the United States of America. 89 (4), 1271-1275 (1992).
- Nakashima, N., Yoshihara, K., Tanaka, F., Yagi, K. Picosecond fluorescence lifetime of the coenzyme of D-amino acid oxidase. Journal of Biological Chemistry. 255 (11), 5261-5263 (1980).
- Hu, L., Wang, N., Cardona, E., Walsh, A. J. Fluorescence intensity and lifetime redox ratios detect metabolic perturbations in T cells. Biomedical Optics Express. 11 (10), 5674-5688 (2020).
- Datta, R., Heaster, T. M., Sharick, J. T., Gillette, A. A., Skala, M. C. Fluorescence lifetime imaging microscopy: fundamentals and advances in instrumentation, analysis, and applications. Journal of Biomedical Optics. 25 (7), 1-43 (2020).
- Liu, Z., et al. Mapping metabolic changes by noninvasive, multiparametric, high-resolution imaging using endogenous contrast. Science Advances. 4 (3), (2018).
- Georgakoudi, I., Quinn, K. P. Optical imaging using endogenous contrast to assess metabolic state. Annual Review of Biomedical Engineering. 14, 351-367 (2012).
- Varone, A., et al. Endogenous two-photon fluorescence imaging elucidates metabolic changes related to enhanced glycolysis and glutamine consumption in precancerous epithelial tissues. Ricerca sul cancro. 74 (11), 3067-3075 (2014).
- Chance, B., Schoener, B., Oshino, R., Itshak, F., Nakase, Y. Oxidation-reduction ratio studies of mitochondria in freeze-trapped samples. NADH and flavoprotein fluorescence signals. Journal of Biological Chemistry. 254 (11), 4764-4771 (1979).
- Sharick, J. T., et al. Protein-bound NAD(P)H lifetime is sensitive to multiple fates of glucose carbon. Scientific Reports. 8 (1), 5456 (2018).
- Skala, M. C., et al. In vivo multiphoton microscopy of NADH and FAD redox states, fluorescence lifetimes, and cellular morphology in precancerous epithelia. Proceedings of the National Academy of Sciences of the United States of America. 104 (49), 19494-19499 (2007).
- Skala, M. C., et al. In vivo multiphoton fluorescence lifetime imaging of protein-bound and free nicotinamide adenine dinucleotide in normal and precancerous epithelia. Journal of Biomedical Optics. 12 (2), 024014 (2007).
- Uchugonova, A. A., König, K. Two-photon autofluorescence and second-harmonic imaging of adult stem cells. Journal of Biomedical Optics. 13 (5), 054068 (2008).
- Miranda-Lorenzo, I., et al. Intracellular autofluorescence: a biomarker for epithelial cancer stem cells. Nature Methods. 11 (11), 1161-1169 (2014).
- Walsh, A. J., et al. Classification of T-cell activation via autofluorescence lifetime imaging. Nature Biomedical Engineering. 5 (1), 77-88 (2021).
- Heaster, T. M., Humayun, M., Yu, J., Beebe, D. J., Skala, M. C. Autofluorescence imaging of 3D tumor-macrophage microscale cultures resolves spatial and temporal dynamics of macrophage metabolism. Ricerca sul cancro. 80 (23), 5408-5423 (2020).
- Pavillon, N., Hobro, A. J., Akira, S., Smith, N. I. Noninvasive detection of macrophage activation with single-cell resolution through machine learning. Proceedings of the National Academy of Sciences of the United States of America. 115 (12), 2676-2685 (2018).
- Chang, C. H., et al. Posttranscriptional control of T cell effector function by aerobic glycolysis. Cell. 153 (6), 1239-1251 (2013).
- Kaech, S. M., Cui, W. Transcriptional control of effector and memory CD8+ T cell differentiation. Nature Reviews. Immunology. 12 (11), 749-761 (2012).
- Gómez, C. A., Fu, B., Sakadžić, S., Yaseena, M. A. Cerebral metabolism in a mouse model of Alzheimer’s disease characterized by two-photon fluorescence lifetime microscopy of intrinsic NADH. Neurophotonics. 5 (4), 045008 (2018).
- Yaseen, M. A., et al. In vivo imaging of cerebral energy metabolism with two-photon fluorescence lifetime microscopy of NADH. Biomedical Optics Express. 4 (2), 307-321 (2013).
- Bower, A. J., et al. High-speed label-free two-photon fluorescence microscopy of metabolic transients during neuronal activity. Applied Physics Letters. 118 (8), 081104 (2021).
- Walsh, A. J., et al. Quantitative optical imaging of primary tumor organoid metabolism predicts drug response in breast cancer. Ricerca sul cancro. 74 (18), 5184-5194 (2014).
- Walsh, A. J., et al. Optical metabolic imaging identifies glycolytic levels, subtypes, and early-treatment response in breast cancer. Ricerca sul cancro. 73 (20), 6164-6174 (2013).
- Chowdary, M. V. P., et al. Autofluorescence of breast tissues: Evaluation of discriminating algorithms for diagnosis of normal, benign, and malignant conditions. Photomedicine and Laser Surgery. 27 (2), 241-252 (2009).
- Demos, S. G., Bold, R., White, R. D., Ramsamooj, R. Investigation of near-infrared autofluorescence imaging for the detection of breast cancer. IEEE Journal of Selected Topics in Quantum Electronics. 11 (4), 791-798 (2005).
- Heaster, T. M., Humayun, M., Yu, J., Beebe, D. J., Skala, M. C. Autofluorescence imaging of 3D tumor-macrophage microscale cultures resolves spatial and temporal dynamics of macrophage metabolism. Ricerca sul cancro. 80 (23), 5408-5423 (2020).
- Sharick, J. T., et al. Cellular metabolic heterogeneity in vivo is recapitulated in tumor organoids. Neoplasia. 21 (6), 615-626 (2019).
- Shah, A. T., Diggins, K. E., Walsh, A. J., Irish, J. M., Skala, M. C. In vivo autofluorescence imaging of tumor heterogeneity in response to treatment. Neoplasia. 17 (12), 862-870 (2015).
- Walsh, A. J., Skala, M. C. Optical metabolic imaging quantifies heterogeneous cell populations. Biomedical Optics Express. 6 (2), 559-573 (2015).
- Walsh, A. J., Skala, M. C. An automated image processing routine for segmentation of cell cytoplasms in high-resolution autofluorescence images. Multiphoton Microscopy in the Biomedical Sciences XIV. , (2014).
- Skala, M., Ramanujam, N. . Methods in Molecular Biology. 594, 155-162 (2010).
- Stringari, C., et al. Multicolor two-photon imaging of endogenous fluorophores in living tissues by wavelength mixing. Scientific Reports. 7, 3792 (2017).
- SPCImage 2.9: Data analysis software for fluorescence lifetime imaging microscopy. SPCImage Available from: https://biology.uiowa.edu/sites/biology.uiowa.edu/files/SPCIMAGE29.pdf (2007)
- . CellProfiler Available from: https://cellprofiler.org/releases (2007)
- Autofluorescence Imaging. GitHub Available from: https://github.com/walshlab/Autofluorescence-Imaging (2021)
- Ramey, N. A., Park, C. Y., Gehlbach, P. L., Chuck, R. S. Imaging mitochondria in living corneal endothelial cells using autofluorescence microscopy. Photochemistry and Photobiology. 83 (6), 1325-1329 (2007).
- Walsh, A., Cook, R. S., Rexer, B., Arteaga, C. L., Skala, M. C. Optical imaging of metabolism in HER2 overexpressing breast cancer cells. Biomedical Optics Express. 3 (1), 75-85 (2012).
- Kolenc, O. I., Quinn, K. P. Evaluating cell metabolism through autofluorescence imaging of NAD(P)H and FAD. Antioxidants & Redox Signaling. 30, 875-889 (2019).
- Bird, D. K., et al. Metabolic mapping of MCF10A human breast cells via multiphoton fluorescence lifetime imaging of the coenzyme NADH. Ricerca sul cancro. 65, 8766-8773 (2005).
- Walsh, A. J., et al. Optical metabolic imaging identifies glycolytic levels, subtypes, and early-treatment response in breast cancer. Ricerca sul cancro. 73 (20), 6164-6174 (2013).
- Walsh, A. J., Castellanos, J. A., Nagathihalli, N. S., Merchant, N. B., Skala, M. C. Optical imaging of drug-induced metabolism changes in murine and human pancreatic cancer organoids reveals heterogeneous drug response. Pancreas. 45 (6), 863-869 (2016).
- Gubser, P. M., et al. Rapid effector function of memory CD8+ T cells requires an immediate-early glycolytic switch. Nature Immunology. 14 (10), 1064-1072 (2013).
- Papalexi, E., Satija, R. Single-cell RNA sequencing to explore immune cell heterogeneity. Nature Review. Immunology. 18 (1), 35-45 (2018).
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. The Journals of Gerontology: Series A. 67 (10), 1022-1035 (2012).
- Plitzko, B., Loesgen, S. Measurement of oxygen consumption rate (OCR) and extracellular acidification rate (ECAR) in culture cells for assessment of the energy metabolism. Bio-protocol. 8 (10), 2850 (2018).
- . The bh TCSPC Handbook Available from: https://www.becker-hickl.com/wp-content/uploads/2021/10/SPC-handbook-9ed-05a.pdf (2021)
- Gadella, T. W. J., Mason, W. T. . Fluorescent and Luminescent Probes for Biological Activity. 34, 467-479 (1999).
- Miller, D. R., Jarrett, J. W., Hassan, A. M., Dunna, A. K. Deep tissue iImaging with multiphoton fluorescence microscopy. Current Opinion in Biomedical Engineering. 4, 32-39 (2017).
- Berezin, M. Y., Achilefu, S. Fluorescence lifetime measurements and biological imaging. Chemical Reviews. 110 (5), 2641-2684 (2010).

