Imágenes de autofluorescencia para evaluar el metabolismo celular
Summary
Este protocolo describe imágenes de fluorescencia y análisis de las coenzimas metabólicas endógenas, nicotinamida adenina (fosfato) dinucleótido reducido (NAD(P)H) y dinucleótido de flavina adenina oxidada (FAD). Las imágenes de autofluorescencia de NAD(P)H y FAD proporcionan un método no destructivo sin etiquetas para evaluar el metabolismo celular.
Abstract
El metabolismo celular es el proceso por el cual las células generan energía, y muchas enfermedades, incluido el cáncer, se caracterizan por un metabolismo anormal. La nicotinamida adenina (fosfato) dinucleótido reducido (NAD(P)H) y el dinucleótido de flavina adenina oxidada (FAD) son coenzimas de reacciones metabólicas. NAD(P)H y FAD exhiben autofluorescencia y pueden aislarse espectralmente por excitación y longitudes de onda de emisión. Ambas coenzimas, NAD(P)H y FAD, pueden existir en una configuración libre o unida a proteínas, cada una de las cuales tiene una vida útil de fluorescencia distinta, el tiempo durante el cual el fluoróforo permanece en el estado excitado. Las imágenes de por vida de fluorescencia (FLIM) permiten cuantificar la intensidad de fluorescencia y la vida útil de NAD(P)H y FAD para el análisis sin etiquetas del metabolismo celular. La intensidad de fluorescencia y los microscopios de por vida se pueden optimizar para obtener imágenes de NAD(P)H y FAD seleccionando las longitudes de onda de excitación y emisión apropiadas. Las perturbaciones metabólicas por cianuro verifican los protocolos de imágenes de autofluorescencia para detectar cambios metabólicos dentro de las células. Este artículo demostrará la técnica de imágenes de autofluorescencia de NAD(P)H y FAD para medir el metabolismo celular.
Introduction
El metabolismo es el proceso celular de producción de energía. El metabolismo celular abarca múltiples vías, incluyendo la glucólisis, la fosforilación oxidativa y la glutaminólisis. Las células sanas utilizan estas vías metabólicas para generar energía para la proliferación y la función, como la producción de citoquinas por las células inmunes. Muchas enfermedades, incluyendo trastornos metabólicos, cáncer y neurodegeneración, se caracterizan por un metabolismo celular alterado1. Por ejemplo, algunos tipos de células cancerosas tienen tasas elevadas de glucólisis, incluso en presencia de oxígeno, para generar moléculas para la síntesis de ácidos nucleicos, proteínas y lípidos2,3. Este fenómeno, conocido como el efecto Warburg, es un sello distintivo de muchos tipos de cáncer, incluyendo el cáncer de mama, el cáncer de pulmón y los glioblastomas4. Debido a las alteraciones del metabolismo celular asociadas a la progresión del cáncer, el metabolismo celular puede ser un biomarcador sustituto de la respuesta farmacológica5,6. Además, la comprensión de la eficacia del fármaco a nivel celular es crucial, ya que la heterogeneidad celular puede conducir a diferentes respuestas farmacológicas en los individuos7,8.
Las tecnologías que identifican y cuantifican los cambios en el metabolismo celular son esenciales para los estudios del cáncer y la respuesta a los medicamentos. Los análisis químicos y de proteínas se utilizan para evaluar el metabolismo de las células o tejidos, pero carecen de resolución unicelular e información espacial. Los ensayos basados en lectores de placas metabólicas pueden medir el pH y el consumo de oxígeno en la muestra a lo largo del tiempo y la posterior perturbación metabólica por productos químicos. El pH se puede utilizar para calcular la tasa de acidificación extracelular (ECAR), lo que proporciona una visión de la actividad glucolítica de las células9. Los métodos de imágenes de todo el cuerpo, incluida la tomografía por emisión de positrones fluorados-D-glucosa 2-[flúor-18] (FDG PET) y la espectroscopia de resonancia magnética (MRS), son modalidades de imágenes no invasivas utilizadas clínicamente para identificar la recurrencia tumoral y la eficacia del fármaco a través de mediciones metabólicas10,11,12,13,14.
FDG-PET toma imágenes de la captación tisular de FDG, un análogo de glucosa radiomarcado. El aumento de la captación de FDG-PET por los tumores en relación con el tejido circundante se debe al efecto Warburg12,13. MRS toma imágenes de núcleos comunes de moléculas utilizadas para el metabolismo, como 13C y 31P, y puede obtener información dinámica sobre cómo cambia el metabolismo en respuesta a estímulos, como el ejercicio o la alimentación14. Aunque FDG-PET y MRS se pueden usar clínicamente, estas tecnologías carecen de la resolución espacial para resolver la heterogeneidad intratumoral. Del mismo modo, las mediciones de consumo de oxígeno se realizan en una población masiva de células. Las imágenes de autofluorescencia superan el obstáculo de resolución espacial de estas tecnologías y proporcionan un método no invasivo para cuantificar el metabolismo celular.
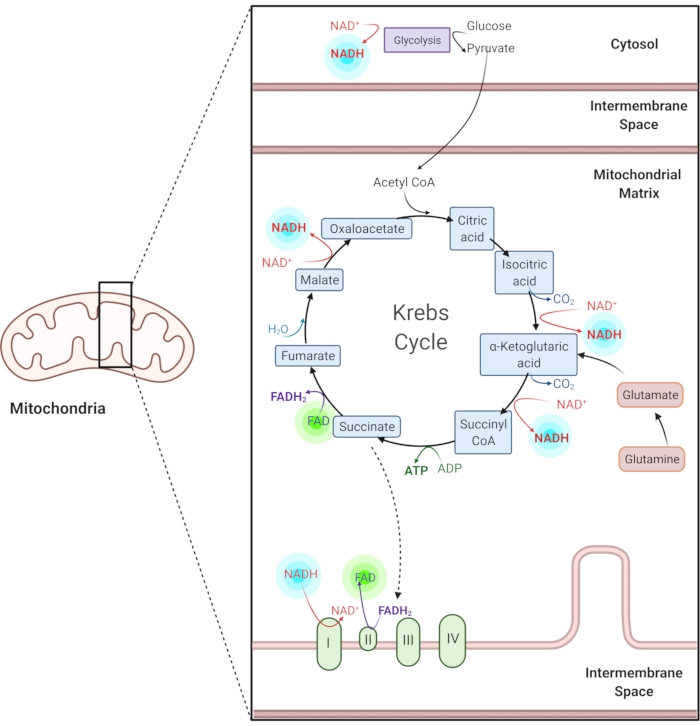
Figura 1: NADH y FAD en vías metabólicas comunes. NADH y FAD son coenzimas utilizadas en la glucólisis, el ciclo de Krebs y la cadena de transporte de electrones. Las imágenes de autofluorescencia de estas moléculas proporcionan información sobre el metabolismo celular. Haga clic aquí para ver una versión más grande de esta figura.
La nicotinamida reducida adenina (fosfato) dinucleótido (NAD(P)H) y el dinucleótido de flavina adenina oxidada (FAD) son coenzimas de reacciones metabólicas, incluyendo glucólisis, fosforilación oxidativa y glutaminólisis (Figura 1). Tanto EL NAD(P)H como el FAD son autofluorescentes y proporcionan contraste endógeno para la obtención de imágenes de fluorescencia1,15. NADPH tiene propiedades fluorescentes similares a NADH. Debido a esto, NAD(P)H se utiliza a menudo para representar la señal combinada de NADH y NADPH2,16.
Las imágenes de por vida de fluorescencia (FLIM) cuantifican la vida útil de la fluorescencia o el tiempo durante el cual un fluoróforo está en estado excitado. Las vidas útiles de fluorescencia responden al microambiente de los fluoróforos y proporcionan información sobre el metabolismo celular17. NAD(P)H y FAD pueden existir dentro de las células en conformaciones unidas a proteínas o libres, cada una de las cuales tiene una vida útil diferente. El NAD(P)H libre tiene una vida útil más corta que el NAD(P)H unido a proteínas; por el contrario, el FAD libre tiene una vida útil más larga que el FAD18,19 enlazado. Las vidas útiles y los pesos de los componentes de por vida se pueden cuantificar a partir de los datos de desintegración de la vida útil de la fluorescencia a través de Eq. (1)20:
I(t) = α 1e-t/τ1 + α 2e-t/τ2 + C (1)
Eq (1) representa la intensidad de fluorescencia normalizada en función del tiempo. Las α 1 y α 2 en esta ecuación representan los componentes proporcionales de vidas cortas y largas (α 1+ α 2=1), respectivamente, τ1 y τ2 representan las vidas cortas y largas, respectivamente, y C representa la luz de fondo7,20. La vida útil ponderada por amplitud, representada aquí como τm, se calcula utilizando Eq. (2).
τm= α 1τ1+ α 2τ2 (2)
Una vida media se puede calcular promediando “t” sobre la desintegración de intensidad del fluoróforo, que para una desintegración dos exponenciales se muestra por Eq. (3)17,21.
τ*m= (α 1τ12+ α 2τ22)/ (α 1τ1+ α 2τ2) (3)
Una imagen de intensidad de fluorescencia se puede calcular a partir de la imagen de por vida integrando la desintegración de la vida útil de fluorescencia. Las imágenes de autofluorescencia son un método no destructivo y libre de etiquetas que se puede utilizar para caracterizar el metabolismo de las células vivas a una resolución subcelular. La relación redox óptica proporciona una métrica analógica óptica del estado redox químico de la célula y se calcula como la relación de intensidades NAD(P)H y FAD. Aunque la fórmula para calcular la relación redox óptica no está estandarizada22,23,24,25, se define aquí como la intensidad de FAD sobre las intensidades combinadas de NAD(P)H y FAD. Esta definición se utiliza porque la intensidad sumada en el denominador normaliza la métrica entre 0 y 1, y el resultado esperado de la inhibición del cianuro es una disminución en la relación redox. Las vidas de fluorescencia de NAD(P)H libre y FAD proporcionan información sobre los cambios en el microambiente del disolvente metabólico, incluido el pH, la temperatura, la proximidad al oxígeno y la osmolaridad17.
Los cambios en la vida útil de fluorescencia de las fracciones unidas de NAD(P)H y FAD pueden indicar la utilización de la vía metabólica y el metabolismo específico del sustrato26. Los pesos de los componentes pueden interpretarse para los cambios en la fracción libre a la fracción unida de las coenzimas18,19. En conjunto, estas métricas cuantitativas de la vida útil de la autofluorescencia permiten el análisis del metabolismo celular, y la imagen de autofluorescencia se ha utilizado para identificar neoplasias de tejidos normales27,28, caracterizar células madre29,30, evaluar la función de las células inmunes31,32,33,34,35, medir la actividad neurológica36, 37,38, y comprender la eficacia de los medicamentos en tipos de cáncer como el cáncer de mama y el cáncer de cabeza y cuello21,39,40,41,42. Las imágenes de autofluorescencia de alta resolución se pueden combinar con la segmentación de imágenes para el análisis unicelular y la cuantificación de la heterogeneidad intrapoblacional43,44,45,46,47.
NAD(P)H y FAD se pueden obtener imágenes en microscopios de fluorescencia de fotón único o multifotón configurados para imágenes de intensidad o de por vida. Para los microscopios de fotón único, NAD(P)H y FAD se excitan típicamente en longitudes de onda de 375-405 nm y 488 nm, respectivamente, debido a fuentes láser comunes en estas longitudes de onda48. En la excitación de fluorescencia de dos fotones, NAD(P)H y FAD excitarán a longitudes de onda de aproximadamente 700 a 750 nm y 700 a 900 nm, respectivamente15,49. Una vez que los fluoróforos se excitan, NAD(P)H y FAD emiten fotones en longitudes de onda entre ~410 nm a ~490 nm y ~510 nm a ~640 nm, respectivamente15. Las longitudes de onda máximas de emisión NAD(P)H y FAD son de aproximadamente 450 nm y 535 nm, respectivamente48.
Debido a sus diferentes longitudes de onda de excitación y emisión, la fluorescencia de las dos coenzimas metabólicas puede aislarse espectralmente. Una comprensión de las características espectrales de NAD(P)H y FAD es necesaria para el diseño y la optimización de los protocolos de imágenes de autofluorescencia. El cianuro es un inhibidor del complejo IV de la cadena de transporte de electrones (ETC). Los efectos del cianuro sobre el metabolismo celular y las intensidades de autofluorescencia y la vida útil de NAD(P)H y FAD dentro de las células están bien caracterizados27,40. Por lo tanto, un experimento de perturbación de cianuro es un medio eficaz para validar los protocolos de imágenes NAD(P)H y FAD. Un experimento exitoso de cianuro proporciona confianza en que el protocolo de imágenes NAD(P)H y FAD se puede utilizar para evaluar el metabolismo de grupos o perturbaciones desconocidas.
Protocol
Representative Results
Discussion
La intensidad de la autofluorescencia y las imágenes de por vida han sido ampliamente utilizadas para evaluar el metabolismo en las células21,55. FLIM es de alta resolución y, por lo tanto, resuelve células individuales, lo cual es importante para los estudios de cáncer porque la heterogeneidad celular contribuye a la agresión tumoral y la resistencia a los medicamentos7,39,41,44,45,46,58.</sup…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Las fuentes de financiamiento incluyen el Instituto de Prevención e Investigación del Cáncer de Texas (CPRIT RP200668) y la Universidad de Texas A&M. La Figura 1 se creó con BioRender.com.
Materials
| 2-deoxy-d-glucose (2-DG) | Sigma | AC111980000; AC111980010; AC111980050; AC111980250 | |
| Antibiotic Antimicrobial (pen-strep) | Gibco | 15240096 | |
| Cell Samples | American Type Culture Collection | N/A | MCF-7 cancer line |
| CellProfiler | Broad Institute | N/A | Image analysis software |
| Conical Tube | VWR | 89039-664 | 15 mL conical tube |
| DMEM | ThermoFisher | 11965092 | Culture media |
| FAD dichroic mirror | Semrock | FF495-Di03-25×36 | 495 nm |
| FAD emission filter | Semrock | FF01-550/88-25 | 550/88 nm |
| FAD excitation filter | Semrock | FF01-458/64-25 | 458/64 nm |
| FBS | ThermoFisher | 16000036 | |
| Fluorescence Lifetime Microscope | 3i | N/A | |
| Glass bottom dish | MatTek Corp | P35G-1.0-14-C | |
| Multiphoton Laser | Coherent | N/A | 2P Coherent Laser, Tunable 680 nm-1080 nm |
| NAD(P)H dichroic mirror | Semrock | FF409-Di03-25×36 | 409 nm |
| NAD(P)H emission filter | Semrock | FF02-447/60-25 | 447/60 nm |
| NAD(P)H excitation filter | Semrock | FF01-357/44-25 | 357/44 nm |
| PBS | ThermoFisher | 70011044 | |
| Potassium Cyanide | Sigma-Aldrich | 380970 | |
| SlideBooks 6 | 3i | N/A | Image acquisition software |
| SPCImage | Becker & Hickl GmbH | N/A | Fluorescence lifetime analysis software |
| Stage Top Incubator | okoLab | N/A | |
| Trypsin | Biosciences | 786-262 | |
| Urea | Sigma-Aldrich | U5128 | |
| YG beads | Polysciences | 19096-2 | Yg microspheres (20.0 µm) |
Riferimenti
- Heikal, A. A. Intracellular coenzymes as natural biomarkers for metabolic activities and mitochondrial anomalies. Biomarkers in Medicine. 4 (2), 241-263 (2010).
- Georgakoudi, I., Quinn, K. P. Optical imaging using endogenous contrast to assess metabolic state. Annual Review of Biomedical Engineering. 14, 351-367 (2012).
- Zheng, J. Energy metabolism of cancer: Glycolysis versus oxidative phosphorylation (Review). Oncology Letters. 4 (6), 1151-1157 (2012).
- Potter, M., Newport, E., Morten, K. J. The Warburg effect: 80 years on. Biochemical Society Transactions. 44 (5), 1499-1505 (2016).
- Zhao, Y., Butler, E. B., Tan, M. Targeting cellular metabolism to improve cancer therapeutics. Cell Death and Disease. 4 (3), 532 (2013).
- Patel, S., Ahmed, S. Emerging field of metabolomics: Big promise for cancer biomarker identification and drug discovery. Journal of Pharmaceutical and Biomedical Analysis. 107, 63-74 (2015).
- Walsh, A. J., Cook, R. S., Skala, M. C. Functional optical imaging of primary human tumor organoids: Development of a personalized drug screen. Journal of Nuclear Medicine. 58 (9), 1367-1372 (2017).
- Zaal, E. A., Berkers, C. R. The influence of metabolism on drug response in cancer. Frontiers in Oncology. 8, 500 (2018).
- Little, A. C., et al. High-content fluorescence imaging with the metabolic flux assay reveals insights into mitochondrial properties and functions. Communications Biology. 3 (1), 271 (2020).
- Wang, X., et al. Comparison of magnetic resonance spectroscopy and positron emission tomography in detection of tumor recurrence in posttreatment of glioma: A diagnostic meta-analysis. Asia-Pacific Journal of Clinical Oncology. 11 (2), 97-105 (2015).
- Nabi, H. A., Zubeldia, J. M. Clinical applications of 18F-FDG in oncology. Journal of Nuclear Medicine Technology. 30 (1), 3-9 (2002).
- Kostakoglu, L., Agress, H., Goldsmith, S. J. Clinical role of FDG PET in evaluation of cancer patients. Radiographics. 23 (2), 315-340 (2003).
- Hoh, C. K. Clinical use of FDG PET. Nuclear Medicine and Biology. 34 (7), 737-742 (2007).
- van de Weijer, T., Schrauwen-Hinderling, V. B. Application of magnetic resonance spectroscopy in metabolic research. Biochimica et Biophysica Acta. Molecular Basis of Disease. 1865 (4), 741-748 (2019).
- Huang, S., Heikal, A. A., Webb, W. W. Two-photon fluorescence spectroscopy and microscopy of NAD(P)H and Flavoprotein. Biophysical Journal. 82, 2811-2825 (2002).
- Lagarto, J. L., et al. Characterization of NAD(P)H and FAD autofluorescence signatures in a Langendorff isolated-perfused rat heart model. Biomedical Optics Express. 9 (10), 4961-4978 (2018).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. , (2013).
- Lakowicz, J. R., Szmacinski, H., Nowaczyk, K., Johnson, M. L. Fluorescence lifetime imaging of free and protein-bound NADH. Proceedings of the National Academy of the Sciences of the United States of America. 89 (4), 1271-1275 (1992).
- Nakashima, N., Yoshihara, K., Tanaka, F., Yagi, K. Picosecond fluorescence lifetime of the coenzyme of D-amino acid oxidase. Journal of Biological Chemistry. 255 (11), 5261-5263 (1980).
- Hu, L., Wang, N., Cardona, E., Walsh, A. J. Fluorescence intensity and lifetime redox ratios detect metabolic perturbations in T cells. Biomedical Optics Express. 11 (10), 5674-5688 (2020).
- Datta, R., Heaster, T. M., Sharick, J. T., Gillette, A. A., Skala, M. C. Fluorescence lifetime imaging microscopy: fundamentals and advances in instrumentation, analysis, and applications. Journal of Biomedical Optics. 25 (7), 1-43 (2020).
- Liu, Z., et al. Mapping metabolic changes by noninvasive, multiparametric, high-resolution imaging using endogenous contrast. Science Advances. 4 (3), (2018).
- Georgakoudi, I., Quinn, K. P. Optical imaging using endogenous contrast to assess metabolic state. Annual Review of Biomedical Engineering. 14, 351-367 (2012).
- Varone, A., et al. Endogenous two-photon fluorescence imaging elucidates metabolic changes related to enhanced glycolysis and glutamine consumption in precancerous epithelial tissues. Ricerca sul cancro. 74 (11), 3067-3075 (2014).
- Chance, B., Schoener, B., Oshino, R., Itshak, F., Nakase, Y. Oxidation-reduction ratio studies of mitochondria in freeze-trapped samples. NADH and flavoprotein fluorescence signals. Journal of Biological Chemistry. 254 (11), 4764-4771 (1979).
- Sharick, J. T., et al. Protein-bound NAD(P)H lifetime is sensitive to multiple fates of glucose carbon. Scientific Reports. 8 (1), 5456 (2018).
- Skala, M. C., et al. In vivo multiphoton microscopy of NADH and FAD redox states, fluorescence lifetimes, and cellular morphology in precancerous epithelia. Proceedings of the National Academy of Sciences of the United States of America. 104 (49), 19494-19499 (2007).
- Skala, M. C., et al. In vivo multiphoton fluorescence lifetime imaging of protein-bound and free nicotinamide adenine dinucleotide in normal and precancerous epithelia. Journal of Biomedical Optics. 12 (2), 024014 (2007).
- Uchugonova, A. A., König, K. Two-photon autofluorescence and second-harmonic imaging of adult stem cells. Journal of Biomedical Optics. 13 (5), 054068 (2008).
- Miranda-Lorenzo, I., et al. Intracellular autofluorescence: a biomarker for epithelial cancer stem cells. Nature Methods. 11 (11), 1161-1169 (2014).
- Walsh, A. J., et al. Classification of T-cell activation via autofluorescence lifetime imaging. Nature Biomedical Engineering. 5 (1), 77-88 (2021).
- Heaster, T. M., Humayun, M., Yu, J., Beebe, D. J., Skala, M. C. Autofluorescence imaging of 3D tumor-macrophage microscale cultures resolves spatial and temporal dynamics of macrophage metabolism. Ricerca sul cancro. 80 (23), 5408-5423 (2020).
- Pavillon, N., Hobro, A. J., Akira, S., Smith, N. I. Noninvasive detection of macrophage activation with single-cell resolution through machine learning. Proceedings of the National Academy of Sciences of the United States of America. 115 (12), 2676-2685 (2018).
- Chang, C. H., et al. Posttranscriptional control of T cell effector function by aerobic glycolysis. Cell. 153 (6), 1239-1251 (2013).
- Kaech, S. M., Cui, W. Transcriptional control of effector and memory CD8+ T cell differentiation. Nature Reviews. Immunology. 12 (11), 749-761 (2012).
- Gómez, C. A., Fu, B., Sakadžić, S., Yaseena, M. A. Cerebral metabolism in a mouse model of Alzheimer’s disease characterized by two-photon fluorescence lifetime microscopy of intrinsic NADH. Neurophotonics. 5 (4), 045008 (2018).
- Yaseen, M. A., et al. In vivo imaging of cerebral energy metabolism with two-photon fluorescence lifetime microscopy of NADH. Biomedical Optics Express. 4 (2), 307-321 (2013).
- Bower, A. J., et al. High-speed label-free two-photon fluorescence microscopy of metabolic transients during neuronal activity. Applied Physics Letters. 118 (8), 081104 (2021).
- Walsh, A. J., et al. Quantitative optical imaging of primary tumor organoid metabolism predicts drug response in breast cancer. Ricerca sul cancro. 74 (18), 5184-5194 (2014).
- Walsh, A. J., et al. Optical metabolic imaging identifies glycolytic levels, subtypes, and early-treatment response in breast cancer. Ricerca sul cancro. 73 (20), 6164-6174 (2013).
- Chowdary, M. V. P., et al. Autofluorescence of breast tissues: Evaluation of discriminating algorithms for diagnosis of normal, benign, and malignant conditions. Photomedicine and Laser Surgery. 27 (2), 241-252 (2009).
- Demos, S. G., Bold, R., White, R. D., Ramsamooj, R. Investigation of near-infrared autofluorescence imaging for the detection of breast cancer. IEEE Journal of Selected Topics in Quantum Electronics. 11 (4), 791-798 (2005).
- Heaster, T. M., Humayun, M., Yu, J., Beebe, D. J., Skala, M. C. Autofluorescence imaging of 3D tumor-macrophage microscale cultures resolves spatial and temporal dynamics of macrophage metabolism. Ricerca sul cancro. 80 (23), 5408-5423 (2020).
- Sharick, J. T., et al. Cellular metabolic heterogeneity in vivo is recapitulated in tumor organoids. Neoplasia. 21 (6), 615-626 (2019).
- Shah, A. T., Diggins, K. E., Walsh, A. J., Irish, J. M., Skala, M. C. In vivo autofluorescence imaging of tumor heterogeneity in response to treatment. Neoplasia. 17 (12), 862-870 (2015).
- Walsh, A. J., Skala, M. C. Optical metabolic imaging quantifies heterogeneous cell populations. Biomedical Optics Express. 6 (2), 559-573 (2015).
- Walsh, A. J., Skala, M. C. An automated image processing routine for segmentation of cell cytoplasms in high-resolution autofluorescence images. Multiphoton Microscopy in the Biomedical Sciences XIV. , (2014).
- Skala, M., Ramanujam, N. . Methods in Molecular Biology. 594, 155-162 (2010).
- Stringari, C., et al. Multicolor two-photon imaging of endogenous fluorophores in living tissues by wavelength mixing. Scientific Reports. 7, 3792 (2017).
- SPCImage 2.9: Data analysis software for fluorescence lifetime imaging microscopy. SPCImage Available from: https://biology.uiowa.edu/sites/biology.uiowa.edu/files/SPCIMAGE29.pdf (2007)
- . CellProfiler Available from: https://cellprofiler.org/releases (2007)
- Autofluorescence Imaging. GitHub Available from: https://github.com/walshlab/Autofluorescence-Imaging (2021)
- Ramey, N. A., Park, C. Y., Gehlbach, P. L., Chuck, R. S. Imaging mitochondria in living corneal endothelial cells using autofluorescence microscopy. Photochemistry and Photobiology. 83 (6), 1325-1329 (2007).
- Walsh, A., Cook, R. S., Rexer, B., Arteaga, C. L., Skala, M. C. Optical imaging of metabolism in HER2 overexpressing breast cancer cells. Biomedical Optics Express. 3 (1), 75-85 (2012).
- Kolenc, O. I., Quinn, K. P. Evaluating cell metabolism through autofluorescence imaging of NAD(P)H and FAD. Antioxidants & Redox Signaling. 30, 875-889 (2019).
- Bird, D. K., et al. Metabolic mapping of MCF10A human breast cells via multiphoton fluorescence lifetime imaging of the coenzyme NADH. Ricerca sul cancro. 65, 8766-8773 (2005).
- Walsh, A. J., et al. Optical metabolic imaging identifies glycolytic levels, subtypes, and early-treatment response in breast cancer. Ricerca sul cancro. 73 (20), 6164-6174 (2013).
- Walsh, A. J., Castellanos, J. A., Nagathihalli, N. S., Merchant, N. B., Skala, M. C. Optical imaging of drug-induced metabolism changes in murine and human pancreatic cancer organoids reveals heterogeneous drug response. Pancreas. 45 (6), 863-869 (2016).
- Gubser, P. M., et al. Rapid effector function of memory CD8+ T cells requires an immediate-early glycolytic switch. Nature Immunology. 14 (10), 1064-1072 (2013).
- Papalexi, E., Satija, R. Single-cell RNA sequencing to explore immune cell heterogeneity. Nature Review. Immunology. 18 (1), 35-45 (2018).
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. The Journals of Gerontology: Series A. 67 (10), 1022-1035 (2012).
- Plitzko, B., Loesgen, S. Measurement of oxygen consumption rate (OCR) and extracellular acidification rate (ECAR) in culture cells for assessment of the energy metabolism. Bio-protocol. 8 (10), 2850 (2018).
- . The bh TCSPC Handbook Available from: https://www.becker-hickl.com/wp-content/uploads/2021/10/SPC-handbook-9ed-05a.pdf (2021)
- Gadella, T. W. J., Mason, W. T. . Fluorescent and Luminescent Probes for Biological Activity. 34, 467-479 (1999).
- Miller, D. R., Jarrett, J. W., Hassan, A. M., Dunna, A. K. Deep tissue iImaging with multiphoton fluorescence microscopy. Current Opinion in Biomedical Engineering. 4, 32-39 (2017).
- Berezin, M. Y., Achilefu, S. Fluorescence lifetime measurements and biological imaging. Chemical Reviews. 110 (5), 2641-2684 (2010).

