eGFP 태그 단백질을 사용하여 초파리 광수용체 세포에서 막 단백질 밀매를 연구하기
Summary
여기에서, 광수용체 막 단백질의 국소화 및 eGFP 형광을 이용한 초파리 화합물 안구에서의 망막 변성의 평가를 위한 비침습적 방법이 기재되어 있다.
Abstract
막 단백질 밀매는 원형질막으로의 수용체 및 이온 채널의 혼입 및 제거를 조절한다. 이 과정은 뉴런의 세포 기능과 세포 완전성에 근본적으로 중요합니다. 초파리 광수용체 세포는 막 단백질 밀매를 연구하기 위한 모델이 되었다. 조명시 광수용체 막으로부터 내재화되고 분해되는 로돕신 외에, 초파리 의 일시적인 수용체 전위 유사 (TRPL) 이온 채널은 횡문근 광수용체 막 (어둠 속에 위치하는 곳)과 광수용체 세포체 (조명시 운반되는) 사이의 광 의존적 전좌를 나타낸다. TRPL의 이러한 세포내 수송은 광수용체 세포에서 eGFP 태깅된 TRPL을 발현시킴으로써 간단하고 비침습적인 방식으로 연구될 수 있다. eGFP 형광은 깊은 의사 동공에서 또는 물 침지 현미경에 의해 관찰 될 수 있습니다. 이러한 방법은 온전한 눈에서 형광의 검출을 허용하므로 TRPL 전좌에 결함 이있는 초파리 돌연변이체에 대한 고처리량 분석 및 유전자 스크리닝에 유용합니다. 여기에서, 파리의 제조, 현미경적 기술, 뿐만 아니라 TRPL의 광-촉발 전좌를 연구하기 위해 사용되는 정량화 방법이 상세히 설명된다. 이들 방법은 다른 초파리 광수용체 단백질, 예를 들어 로돕신에 대한 밀매 연구에도 적용될 수 있다. 또한, eGFP 태깅된 횡문근 단백질을 사용하여, 이들 방법은 광수용체 세포의 변성을 평가하는데 사용될 수 있다.
Introduction
원형질막으로 단백질을 전달하고 제거함으로써, 뉴런의 막 단백질 밀매는 이온 채널뿐만 아니라 수용체로 원형질막 장비를 제어하고, 결과적으로 신경 기능을 조절합니다. 단백질 밀매의 잘못된 조절 또는 결함은 일반적으로 세포에 해로운 영향을 미치고 신경 세포 변성을 초래합니다. 인간에서, 이것은 알츠하이머 및 파킨슨 병 또는 망막염 색소 침착증 1과 같은 신경 퇴행성 질환을 일으킬 수 있습니다. Drosophila melanogaster의 복합 눈에있는 광수용체는 막 단백질 밀매2를 연구하기위한 생체 내 모델 시스템이되었습니다. 이것은 효과적인 유전자 스크리닝을 허용하는 초파리의 유전 적 다양성 때문 일뿐만 아니라 광흡수 광수용체 막의 모든 필수 구성 요소가 매우 상세하고 효율적인 현미경 기술을 사용하여 플라이 아이에 적용 할 수 있기 때문입니다. 이러한 기술은 이 문서의 초점입니다.
초파리 광수용체 세포에서, 정점 원형질막은 횡문근이라고 불리는 세포의 한쪽을 따라 미세 융모의 조밀하게 포장 된 스택을 형성합니다. 광수용체 세포 R1-6의 횡문근은 특징적인 사다리꼴 패턴으로 배열되어 있으며, 광수용체 세포 R7 및 R8은 이 사다리꼴3의 중앙에 단일 횡문근을 형성한다. 막 단백질 트래피킹은 횡문관에서 이러한 광전달 단백질의 적절한 양을 보장하기 위해 로돕신 및 광활성화된 TRP(transient receptor potential) 및 TRPL(TRP-like) 이온 채널과 같은 횡문막 막 단백질의 조절된 턴오버를 위해 필요하다. 광수용체 막 단백질은 소포체에서 합성되고 골지 장치를 통해 횡문근으로 운반된다. 빛에 의한 로돕신의 활성화 후, 로돕신 분자는 두 번째 광자의 흡수에 의해 불활성화되거나 클라트린 매개 엔도사이토시스에 의해 횡문근으로부터 제거될 수 있다. 엔도사이토시스화된 로돕신은 리소좀에서 분해되거나 횡문근 4,5로 다시 재순환된다. 이온 채널 TRPL은 또한 광전달 캐스케이드의 활성화에 따라 내재화되고 횡문관 (파리가 어둠 속에 보관 될 때 위치하는 곳)과 세포 몸체의 ER 농축 저장 구획 (조명시 몇 시간 이내에 운반되는 곳) 사이의 광 의존적 전좌를 겪습니다.6,7,8,9,10 . 엔도사이토시드된 로돕신과는 달리, 단지 소량의 TRPL만이 엔도리소좀 경로를 통해 분해되고, 대부분은 대신 세포내 저장되고 어두운 적응 시 횡문근으로 다시 재순환된다6. 따라서 TRPL은 원형질막 단백질의 광촉발 밀매를 분석하는데 사용될 수 있다. 초파리 광수용체 세포는 또한 신경 변성을 연구하기 위해 사용된다. 광수용체 세포 변성은 퇴행성 과정5의 결과로 분해되는 횡문근의 구조를 평가함으로써 자주 결정된다.
광수용체 세포에서 TRPL 및 로돕신의 세포내 국재화 또는 광수용체 세포 변성을 연구하기 위해, 분석 속도 및 분해능에 관하여 상이한 두 개의 형광 현미경 방법이 여기에 적용되었다. 유전자 스크리닝에 사용할 수 있지만 제한된 공간 분해능을 가진 매우 빠르고 비 침습적 인 방법은 심부 의사 동공 (DPP)에서 형광을 검출하는 것입니다. DPP는 절지 동물 복합 눈의 광학 현상으로, 1971 년 Franceschini와 Kirschfeld에 의해 기하학적 기원이 자세히 설명되었습니다11. 요컨대, 망막 오버레이 아래의 여러 광학 평면에서 인접한 옴마티디아로부터의 횡문근의 이미지가 관찰 될 수 있습니다. 눈의 곡률의 중심을 통과하는 초점 평면에서,이 중첩 된 투영은 단일 옴마티듐에서 횡문근의 사다리꼴 레이아웃과 유사한 이미지를 형성합니다. 이러한 현상은 형광 단백질의 외인성 발현(예를 들어 TRPL::eGFP8)과 독립적으로 관찰될 수 있으며, 그럼에도 불구하고 DPP를 검출하기 쉽게 만든다(도 1A-A‘‘)12. 두 번째 비침습적 방법은 눈의 이관형 장치를 물로 광학적으로 중화시킨 후 형광으로 태그된 단백질을 영상화하는 데 의존하는 침지 현미경 검사입니다(도 1B-C”)12. 수침 방법을 사용하여, 횡문근 또는 세포체에서 TRPL::eGFP의 상대적인 양은 개별 광수용체 세포에 대해 정량적으로 평가될 수 있다. 더욱이, 비-전좌 형광-태깅된 단백질은 횡문근 완전성을 평가하고 여기에 기술된 바와 같이 정량적 방식으로 잠재적인 변성의 시간 경과를 결정하기 위해 이용될 수 있다.
DPP의 기록은 이러한 방법 중 가장 쉽고 빠르게 수행 할 수 있지만 생성 된 데이터의 공간 해상도는 제한적입니다. 또한 DPP가 부재 할 수있는 데는 여러 가지 이유가 있으며, 이는 DPP 이미징 자체만으로 식별 할 수있는 것은 아닙니다. DPP는 여러 옴마티디아의 합산을 나타내기 때문에 개별 세포에 대한 정보가 손실됩니다. 따라서 저해상도 DPP 이미징은 많은 수의 파리를 선별하는 데 중요한 기능을 수행하지만 일반적으로 침수 현미경을 통해 더 높은 해상도의 기록이 뒤따라야합니다. 물 침지 현미경 사진은 개별 세포, 발달 결함, 눈 형태학, 단백질 잘못 국소화 또는 망막 변성에 대한 해석뿐만 아니라 이러한 효과의 정량화를 허용합니다. 이 프로토콜은 이 두 가지 기술을 자세히 설명합니다.
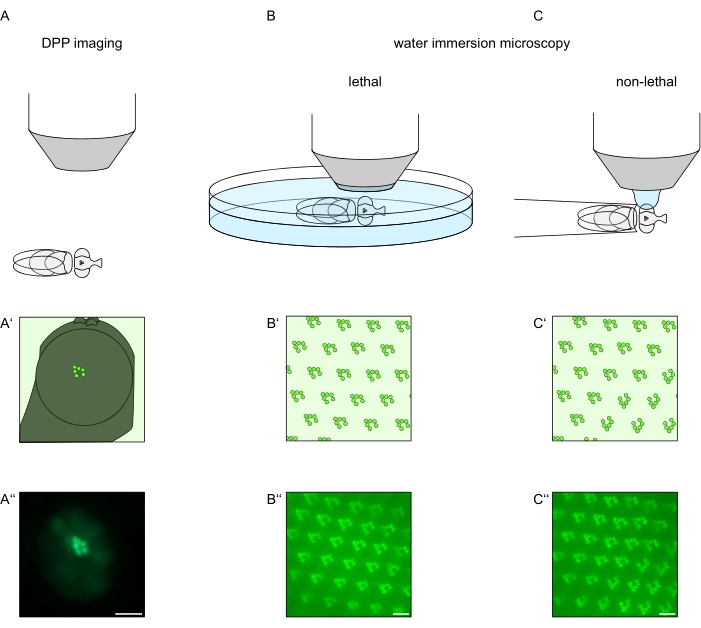
그림 1: 이 프로토콜에 제시된 초파리 눈의 현미경 검사 변형에 대한 개요. (A-A”) 형광 심부 유사동공 (DPP) 영상화, (B-B”) 형광 횡문근막의 치명적인 물 침지 현미경 검사, 및 (C-C‘”) 형광 횡문근막의 비치명적인 물방울 현미경의 개략적인 표현 및 예시적인 현미경 사진. 스케일 바 (A”): 100 μm. 스케일 바 (B’‘–C‘‘): 10 μm. 도면은 참조13에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
형광 단백질의 적용 가능성과 DPP 이미징 및 망막 침지 현미경에 의한 스크리닝의 단순성은 많은 그룹12에 의해 성공적인 것으로 입증되었습니다. 여기에 제시된 것과 유사한 전략은 Rh1::eGFP17,18,19,20,21의 도움으로 로돕신 발현 수준, 항상성, 망막 조직 또는 세포 완?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
우리는 수년에 걸쳐 우리의 학생 연구원에게 감사하고 싶습니다. 특히 Nina Meyer, Sibylle Mayer, Juliane Kaim 및 Laura Jaggy는이 프로토콜에서 대표적인 결과로 활용되었습니다. 여기에 제시된 우리 그룹의 연구는 Deutsche Forschungsgemeinschaft (Hu 839/2-4, Hu 839/7-1)에서 Armin Huber에게 보조금으로 지원되었습니다.
Materials
| 15 mL centrifuge tube | Greiner Bio-One | 188271 | |
| CO2 anaesthesia fly pad | Flystuff | 59-172 | |
| Cold light lamp (KL 1500 LCD) | Zeiss | ||
| Fiji/ImageJ | NIH | ||
| Fluorescence microscope with UV lamp, camera, filter set and software (AxioImager.Z1m, Axiocam 530 mono, 38 HE, ZEN2 blue edition) | Zeiss | ||
| Fluorescent tube (Lumilux T8, L 30W/840, 4000 K, G13) [1750 Lux, Ee470nm = 298 µW cm-2, Ee590nm = 215 µW cm-2] and [760 Lux, Ee470nm = 173 µW cm-2, Ee590nm = 147 µW cm-2] |
Osram | 4050300518039 | |
| Laboratory pipette (20-200 µL) | Eppendorf | ||
| Object slide | Roth | 0656.1 | |
| Petri dish (94 mm) | Greiner Bio-One | 633102 | |
| Pipette tips (200 µL) | Labsolute | 7695844 | |
| Plasticine (Blu-Tack) | Bostik | 30811745 | |
| Stereo microscope (SMZ445) | Nikon | ||
| Stereo microscope with UV lamp, camera, filer set and software (MZ16F, MC170 HD, GFP3, LAS 4.12) | Leica |
Riferimenti
- Wang, X., Huang, T., Bu, G., Xu, H. Dysregulation of protein trafficking in neurodegeneration. Molecular Neurodegeneration. 9. 9, 31 (2014).
- Schopf, K., Huber, A. Membrane protein trafficking in Drosophila photoreceptor cells. European Journal of Cell Biology. 96 (5), 391-401 (2017).
- Hardie, R. C. The photoreceptor array of the dipteran retina. Trends in Neurosciences. 9, 419-423 (1986).
- Wang, T., Montell, C. Phototransduction and retinal degeneration in Drosophila. Pflügers Archiv – European Journal of Physiology. 454 (5), 821-847 (2007).
- Xiong, B., Bellen, H. J. Rhodopsin homeostasis and retinal degeneration: lessons from the fly. Trends in Neurosciences. 36 (11), 652-660 (2013).
- Bähner, M., et al. Light-regulated subcellular translocation of Drosophila TRPL channels induces long-term adaptation and modifies the light-induced current. Neuron. 34 (1), 83-93 (2002).
- Cronin, M. A., Lieu, M. -. H., Tsunoda, S. Two stages of light-dependent TRPL-channel translocation in Drosophila photoreceptors. Journal of Cell Science. 119, 2935-2944 (2006).
- Meyer, N., Joel-Almagor, T., Frechter, S., Minke, B., Huber, A. Subcellular translocation of the eGFP-tagged TRPL channel in Drosophila photoreceptors requires activation of the phototransduction cascade. Journal of Cell Science. 119, 2592-2603 (2006).
- Oberegelsbacher, C., Schneidler, C., Voolstra, O., Cerny, A., Huber, A. The Drosophila TRPL ion channel shares a Rab-dependent translocation pathway with rhodopsin. European Journal of Cell Biology. 90 (8), 620-630 (2011).
- Wagner, K., Smylla, T. K., Lampe, M., Krieg, J., Huber, A. Phospholipase D and retromer promote recycling of TRPL ion channel via the endoplasmic reticulum. Traffic. , (2021).
- Franceschini, N., Kirschfeld, K. Les phénoménes de pseudopupille dans l’oeil compose de Drosophila. Kybernetik. 9 (5), 159-182 (1971).
- Pichaud, F., Desplan, C. A new visualization approach for identifying mutations that affect differentiation and organization of the Drosophila ommatidia. Development. 128 (6), 815-826 (2001).
- Smylla, T. K., Wagner, K., Huber, A. Application of fluorescent proteins for functional dissection of the Drosophila visual system. International Journal of Molecular Sciences. 22 (16), (2021).
- Meyer, N. Mechanisms of the light-dependent translocation of the ion channel TRPL in the photoreceptors of Drosophila melanogaster: Dissertation for obtaining the academic degree Dr. rer. nat. University of Karlsruhe (TH). , (2005).
- Meyer, N., Oberegelsbacher, C., Dürr, T. D., Schäfer, A., Huber, A. An eGFP-based genetic screen for defects in light-triggered subcelluar translocation of the Drosophila photoreceptor channel TRPL. Fly. 2 (1), 36-46 (2008).
- Zheng, L., Carthew, R. W. Lola regulates cell fate by antagonizing Notch induction in the Drosophila eye. Mechanisms of Development. 125 (1-2), 18-29 (2008).
- Hibbard, K. L., O’Tousa, J. E. A role for the cytoplasmic DEAD box helicase Dbp21E2 in rhodopsin maturation and photoreceptor viability. Journal of Neurogenetics. 26 (2), 177-188 (2012).
- Huang, Y., Xie, J., Wang, T. A Fluorescence-based genetic screen to study retinal degeneration in Drosophila. PloS One. 10 (12), 0144925 (2015).
- Zhao, H., Wang, J., Wang, T. The V-ATPase V1 subunit A1 is required for rhodopsin anterograde trafficking in Drosophila. Molecular Biology of the Cell. 29 (13), 1640-1651 (2018).
- Xiong, L., et al. ER complex proteins are required for rhodopsin biosynthesis and photoreceptor survival in Drosophila and mice. Cell Death and Differentiation. 27 (2), 646-661 (2020).
- Zhao, H., Wang, T. PE homeostasis rebalanced through mitochondria-ER lipid exchange prevents retinal degeneration in Drosophila. PLoS Genetics. 16 (10), 1009070 (2020).
- Cerny, A. C., et al. The GTP- and phospholipid-binding protein TTD14 regulates trafficking of the TRPL ion channel in Drosophila photoreceptor cells. PLoS Genetics. 11 (10), 1005578 (2015).
- Richter, D. Structural and functional analyses of TRP ion channels in the photoreceptor cells of Drosophila melanogaster: Dissertation for obtaining the academic degree Dr. rer, nat. University of Karlsruhe (TH). , (2007).
- Gambis, A., Dourlen, P., Steller, H., Mollereau, B. Two-color in vivo imaging of photoreceptor apoptosis and development in Drosophila. Biologia dello sviluppo. 351 (1), 128-134 (2011).
- Hardie, R. C., Liu, C. -. H., Randall, A. S., Sengupta, S. In vivo tracking of phosphoinositides in Drosophila photoreceptors. Journal of Cell Science. 128 (23), 4328-4340 (2015).
- Chakrabarti, P., et al. A dPIP5K dependent pool of phosphatidylinositol 4,5 bisphosphate (PIP2) is required for G-protein coupled signal transduction in Drosophila photoreceptors. PLoS Genetics. 11 (1), 1004948 (2015).

