Undersøgelse af membranproteinhandel i drosophila-fotoreceptorceller ved hjælp af eGFP-mærkede proteiner
Summary
Her beskrives ikke-invasive metoder til lokalisering af fotoreceptormembranproteiner og vurdering af retinal degeneration i Drosophila-forbindelsens øje ved anvendelse af eGFP-fluorescens.
Abstract
Membranproteinhandel regulerer inkorporeringen og fjernelsen af receptorer og ionkanaler i plasmamembranen. Denne proces er grundlæggende vigtig for neuronernes cellefunktion og celleintegritet. Drosophila fotoreceptorceller er blevet en model til at studere membranproteinhandel. Udover rhodopsin, som ved belysning bliver internaliseret fra fotoreceptormembranen og nedbrydes, udviser den forbigående receptorpotentialelignende (TRPL) ionkanal i Drosophila en lysafhængig translokation mellem den rhabdomerale fotoreceptormembran (hvor den er placeret i mørket) og fotoreceptorcellelegemet (som det transporteres til ved belysning). Denne intracellulære transport af TRPL kan studeres på en enkel og ikke-invasiv måde ved at udtrykke eGFP-mærket TRPL i fotoreceptorceller. eGFP-fluorescensen kan derefter observeres enten i den dybe pseudopupil eller ved vandnedsænkningsmikroskopi. Disse metoder gør det muligt at detektere fluorescens i det intakte øje og er derfor nyttige til assays med høj gennemstrømning og genetiske skærme for Drosophila-mutanter , der er defekte i TRPL-translokation. Her forklares forberedelsen af fluer, de mikroskopiske teknikker samt kvantificeringsmetoder, der anvendes til at studere denne lysudløste translokation af TRPL, detaljeret. Disse metoder kan også anvendes til trafficking undersøgelser på andre Drosophila fotoreceptor proteiner, for eksempel rhodopsin. Derudover kan disse metoder ved hjælp af eGFP-mærkede rhabdomerale proteiner bruges til at vurdere degenereringen af fotoreceptorceller.
Introduction
Ved at levere og fjerne proteiner til og fra plasmamembranen styrer membranproteinhandel i neuroner plasmamembranudstyret med receptorer såvel som ionkanaler og regulerer som følge heraf neuronal funktion. Misregulering eller defekter i proteinhandel har typisk skadelige virkninger på celler og resulterer i neuronal degeneration. Hos mennesker kan dette forårsage neurodegenerative sygdomme som Alzheimers og Parkinsons sygdom eller Retinitis pigmentosa1. Fotoreceptorer i drosophila melanogasters sammensatte øje er blevet et in vivo-modelsystem til undersøgelse af membranproteinhandel2. Dette skyldes ikke kun Drosophilas genetiske alsidighed, der muliggør effektive genetiske skærme, men også fordi alle væsentlige komponenter i den lysabsorberende fotoreceptormembran er karakteriseret i detaljer, og der findes effektive mikroskopiske teknikker, der kan påføres flueøjet. Disse teknikker er i fokus i denne artikel.
I Drosophila fotoreceptorceller danner den apikale plasmamembran en tæt pakket stak mikrovilli langs den ene side af cellen, nævnt rhabdomere. Rhabdomeres af fotoreceptorceller R1-6 er arrangeret i et karakteristisk trapezformet mønster, mens fotoreceptorcellerne R7 og R8 danner en enkelt rhabdomere i midten af denne trapez3. Membranproteinhandel er nødvendig for en reguleret omsætning af rhabdomerale membranproteiner såsom rhodopsin og de lysaktiverede TRP (forbigående receptorpotentiale) og TRPL (TRP-lignende) ionkanaler for at sikre den korrekte mængde af disse fototransduktionsproteiner i rhabdomere. Fotoreceptormembranproteiner syntetiseres i det endoplasmatiske retikulum og transporteres via Golgi-apparatet til rhabdomere. Efter aktivering af rhodopsin ved lys kan et rhodopsinmolekyle enten blive inaktiveret ved absorption af en anden foton eller kan fjernes fra rhabdomere ved clathrinmedieret endocytose. Endocytosed rhodopsin bliver enten nedbrudt i lysosomet eller genbruges tilbage til rhabdomere 4,5. Ionkanalen TRPL internaliseres også efter aktivering af fototransduktionskaskaden og gennemgår en lysafhængig translokation mellem rhabdomere (hvor den er placeret, når fluer holdes i mørket) og et ER-beriget opbevaringsrum i cellelegemet (hvortil det transporteres inden for flere timer ved belysning)6,7,8,9,10 . I modsætning til endocytoseret rhodopsin nedbrydes kun små mængder TRPL via den endolysosomale vej, og størstedelen opbevares intracellulært i stedet og genbruges tilbage til rhabdomere ved mørk tilpasning6. TRPL kan således bruges til at analysere lysudløst handel med plasmamembranproteiner. Drosophila fotoreceptorceller anvendes også til at studere neuronal degeneration. Fotoreceptorcelledegeneration bestemmes ofte ved at vurdere strukturen af rhabdomeres, som opløses som følge af degenerative processer5.
For at studere den subcellulære lokalisering af TRPL og rhodopsin i fotoreceptorceller eller fotoreceptorcelledegeneration er der anvendt to fluorescensmikroskopimetoder, der adskiller sig med hensyn til analysehastighed og opløsning. En meget hurtig, ikke-invasiv metode, der kan bruges til genetiske skærme, men med en begrænset rumlig opløsning, er påvisning af fluorescens i den dybe pseudopupil (DPP). DPP er et optisk fænomen af leddyr sammensatte øjne, hvis geometriske oprindelse er blevet forklaret detaljeret af Franceschini og Kirschfeld i 197111. Kort sagt, på flere optiske planer under nethinden kan overlay-billeder af rhabdomeres fra tilstødende ommatidia observeres. På et brændplan gennem midten af øjets krumning danner disse overlejrede fremspring et billede, der ligner det trapezformede layout af rhabdomeres i et enkelt ommatidium, kun størrelsesordener større. Dette fænomen kan også observeres uafhængigt af eksogen ekspression af fluorescensproteiner (f.eks. TRPL::eGFP8), hvilket ikke desto mindre gør DPP lettere at detektere (figur 1A-A”)12. En anden ikke-invasiv metode er vandnedsænkningsmikroskopi, der er afhængig af billeddannelse af fluorescerende mærkede proteiner efter optisk neutralisering af øjnenes dioptriske apparat med vand (figur 1B-C”)12. Ved hjælp af vandnedsænkningsmetoden kan den relative mængde TRPL::eGFP i rhabdomeres eller cellelegemet vurderes kvantitativt for individuelle fotoreceptorceller. Desuden kan ikke-translokerende fluorescensmærkede proteiner anvendes til at evaluere rhabdomeral integritet og til at bestemme tidsforløbet for en potentiel degeneration på en kvantitativ måde, som beskrevet her.
Mens optagelser af DPP er langt den nemmeste og hurtigste af disse metoder at udføre, er den rumlige opløsning af data, de genererer, begrænset. Derudover er der mange grunde til, at en DPP kan være fraværende, som ikke nødvendigvis kan ses af DPP-billeddannelse selv. Da DPP repræsenterer en summation af flere ommatidia, går information om individuelle celler tabt. DPP-billeddannelse med lav opløsning tjener således en vigtig funktion ved screening af et stort antal fluer, men bør generelt efterfølges af optagelser med højere opløsning ved hjælp af vandnedsænkningsmikroskopi. Vandnedsænkningsmikrografer tillader fortolkninger om individuelle celler, udviklingsdefekter, øjenmorfologi, proteinfejllokalisering eller retinal degeneration samt kvantificering af disse effekter. Denne protokol beskriver disse to teknikker i detaljer.
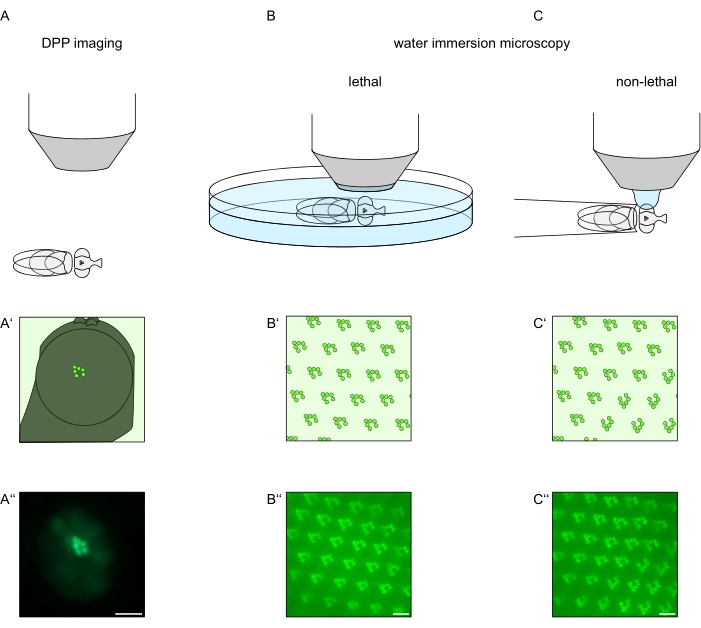
Figur 1: Oversigt over mikroskopivariationer for Drosophila-øjet, der præsenteres i denne protokol. Skematiske repræsentationer og eksemplariske mikrografer af (A-A”) fluorescerende dyb pseudopupil (DPP) billeddannelse, (B-B”) dødelig vandnedsænkningsmikroskopi af fluorescerende rhabdomere og (C-C”) ikke-dødelig vanddråbemikroskopi af fluorescerende rhabdomere. Skalabjælke (A”): 100 μm. Vægtstænger (B”-C”): 10 μm. Figuren er ændret i forhold til reference13. Klik her for at se en større version af denne figur.
Protocol
Representative Results
Discussion
Anvendeligheden af fluorescensproteiner og enkelheden ved screening ved DPP-billeddannelse og retinal vandnedsænkningsmikroskopi har vist sig at være vellykket af mange grupper12. Strategier svarende til dem, der præsenteres her, er blevet brugt i flere genetiske skærme til at detektere defekter i rhodopsinekspressionsniveauer, homeostase, retinal organisation eller cellulær integritet ved hjælp af Rh1::eGFP 17,18,19,20,21.</sup…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Vi vil gerne takke vores studenterforskere gennem årene. Især Nina Meyer, Sibylle Mayer, Juliane Kaim og Laura Jaggy, hvis data er blevet brugt i denne protokol som repræsentative resultater. Forskning fra vores gruppe, der blev præsenteret her, blev finansieret af tilskud fra Deutsche Forschungsgemeinschaft (Hu 839/2-4, Hu 839/7-1) til Armin Huber.
Materials
| 15 mL centrifuge tube | Greiner Bio-One | 188271 | |
| CO2 anaesthesia fly pad | Flystuff | 59-172 | |
| Cold light lamp (KL 1500 LCD) | Zeiss | ||
| Fiji/ImageJ | NIH | ||
| Fluorescence microscope with UV lamp, camera, filter set and software (AxioImager.Z1m, Axiocam 530 mono, 38 HE, ZEN2 blue edition) | Zeiss | ||
| Fluorescent tube (Lumilux T8, L 30W/840, 4000 K, G13) [1750 Lux, Ee470nm = 298 µW cm-2, Ee590nm = 215 µW cm-2] and [760 Lux, Ee470nm = 173 µW cm-2, Ee590nm = 147 µW cm-2] |
Osram | 4050300518039 | |
| Laboratory pipette (20-200 µL) | Eppendorf | ||
| Object slide | Roth | 0656.1 | |
| Petri dish (94 mm) | Greiner Bio-One | 633102 | |
| Pipette tips (200 µL) | Labsolute | 7695844 | |
| Plasticine (Blu-Tack) | Bostik | 30811745 | |
| Stereo microscope (SMZ445) | Nikon | ||
| Stereo microscope with UV lamp, camera, filer set and software (MZ16F, MC170 HD, GFP3, LAS 4.12) | Leica |
Riferimenti
- Wang, X., Huang, T., Bu, G., Xu, H. Dysregulation of protein trafficking in neurodegeneration. Molecular Neurodegeneration. 9. 9, 31 (2014).
- Schopf, K., Huber, A. Membrane protein trafficking in Drosophila photoreceptor cells. European Journal of Cell Biology. 96 (5), 391-401 (2017).
- Hardie, R. C. The photoreceptor array of the dipteran retina. Trends in Neurosciences. 9, 419-423 (1986).
- Wang, T., Montell, C. Phototransduction and retinal degeneration in Drosophila. Pflügers Archiv – European Journal of Physiology. 454 (5), 821-847 (2007).
- Xiong, B., Bellen, H. J. Rhodopsin homeostasis and retinal degeneration: lessons from the fly. Trends in Neurosciences. 36 (11), 652-660 (2013).
- Bähner, M., et al. Light-regulated subcellular translocation of Drosophila TRPL channels induces long-term adaptation and modifies the light-induced current. Neuron. 34 (1), 83-93 (2002).
- Cronin, M. A., Lieu, M. -. H., Tsunoda, S. Two stages of light-dependent TRPL-channel translocation in Drosophila photoreceptors. Journal of Cell Science. 119, 2935-2944 (2006).
- Meyer, N., Joel-Almagor, T., Frechter, S., Minke, B., Huber, A. Subcellular translocation of the eGFP-tagged TRPL channel in Drosophila photoreceptors requires activation of the phototransduction cascade. Journal of Cell Science. 119, 2592-2603 (2006).
- Oberegelsbacher, C., Schneidler, C., Voolstra, O., Cerny, A., Huber, A. The Drosophila TRPL ion channel shares a Rab-dependent translocation pathway with rhodopsin. European Journal of Cell Biology. 90 (8), 620-630 (2011).
- Wagner, K., Smylla, T. K., Lampe, M., Krieg, J., Huber, A. Phospholipase D and retromer promote recycling of TRPL ion channel via the endoplasmic reticulum. Traffic. , (2021).
- Franceschini, N., Kirschfeld, K. Les phénoménes de pseudopupille dans l’oeil compose de Drosophila. Kybernetik. 9 (5), 159-182 (1971).
- Pichaud, F., Desplan, C. A new visualization approach for identifying mutations that affect differentiation and organization of the Drosophila ommatidia. Development. 128 (6), 815-826 (2001).
- Smylla, T. K., Wagner, K., Huber, A. Application of fluorescent proteins for functional dissection of the Drosophila visual system. International Journal of Molecular Sciences. 22 (16), (2021).
- Meyer, N. Mechanisms of the light-dependent translocation of the ion channel TRPL in the photoreceptors of Drosophila melanogaster: Dissertation for obtaining the academic degree Dr. rer. nat. University of Karlsruhe (TH). , (2005).
- Meyer, N., Oberegelsbacher, C., Dürr, T. D., Schäfer, A., Huber, A. An eGFP-based genetic screen for defects in light-triggered subcelluar translocation of the Drosophila photoreceptor channel TRPL. Fly. 2 (1), 36-46 (2008).
- Zheng, L., Carthew, R. W. Lola regulates cell fate by antagonizing Notch induction in the Drosophila eye. Mechanisms of Development. 125 (1-2), 18-29 (2008).
- Hibbard, K. L., O’Tousa, J. E. A role for the cytoplasmic DEAD box helicase Dbp21E2 in rhodopsin maturation and photoreceptor viability. Journal of Neurogenetics. 26 (2), 177-188 (2012).
- Huang, Y., Xie, J., Wang, T. A Fluorescence-based genetic screen to study retinal degeneration in Drosophila. PloS One. 10 (12), 0144925 (2015).
- Zhao, H., Wang, J., Wang, T. The V-ATPase V1 subunit A1 is required for rhodopsin anterograde trafficking in Drosophila. Molecular Biology of the Cell. 29 (13), 1640-1651 (2018).
- Xiong, L., et al. ER complex proteins are required for rhodopsin biosynthesis and photoreceptor survival in Drosophila and mice. Cell Death and Differentiation. 27 (2), 646-661 (2020).
- Zhao, H., Wang, T. PE homeostasis rebalanced through mitochondria-ER lipid exchange prevents retinal degeneration in Drosophila. PLoS Genetics. 16 (10), 1009070 (2020).
- Cerny, A. C., et al. The GTP- and phospholipid-binding protein TTD14 regulates trafficking of the TRPL ion channel in Drosophila photoreceptor cells. PLoS Genetics. 11 (10), 1005578 (2015).
- Richter, D. Structural and functional analyses of TRP ion channels in the photoreceptor cells of Drosophila melanogaster: Dissertation for obtaining the academic degree Dr. rer, nat. University of Karlsruhe (TH). , (2007).
- Gambis, A., Dourlen, P., Steller, H., Mollereau, B. Two-color in vivo imaging of photoreceptor apoptosis and development in Drosophila. Biologia dello sviluppo. 351 (1), 128-134 (2011).
- Hardie, R. C., Liu, C. -. H., Randall, A. S., Sengupta, S. In vivo tracking of phosphoinositides in Drosophila photoreceptors. Journal of Cell Science. 128 (23), 4328-4340 (2015).
- Chakrabarti, P., et al. A dPIP5K dependent pool of phosphatidylinositol 4,5 bisphosphate (PIP2) is required for G-protein coupled signal transduction in Drosophila photoreceptors. PLoS Genetics. 11 (1), 1004948 (2015).

