Augenentfernung in lebenden Zebrafischlarven zur Untersuchung des innervationsabhängigen Wachstums und der Entwicklung des visuellen Systems
Summary
Der Artikel erklärt, wie man Augen von lebenden Zebrafischlarven chirurgisch entfernt, als ersten Schritt zur Untersuchung, wie der retinale Input das Wachstum und die Entwicklung des optischen Tektums beeinflusst. Darüber hinaus enthält der Artikel Informationen über Larvenanästhesie, Fixierung und Hirndissektion, gefolgt von Immunhistochemie und konfokaler Bildgebung.
Abstract
Zebrafische weisen ein bemerkenswertes lebenslanges Wachstum und regenerative Fähigkeiten auf. Zum Beispiel unterstützen spezialisierte Stammzellnischen, die während der Embryogenese etabliert wurden, das kontinuierliche Wachstum des gesamten visuellen Systems, sowohl im Auge als auch im Gehirn. Koordiniertes Wachstum zwischen der Netzhaut und dem optischen Tectum gewährleistet eine genaue retinotopische Kartierung, wenn neue Neuronen in den Augen und im Gehirn hinzugefügt werden. Um zu untersuchen, ob retinale Axone entscheidende Informationen für die Regulierung des Verhaltens von tektalen Stamm- und Vorläuferzellen wie Überleben, Proliferation und / oder Differenzierung liefern, ist es notwendig, innervierte und denervierte tektale Lappen innerhalb desselben Tieres und zwischen Tieren vergleichen zu können.
Die chirurgische Entfernung eines Auges aus lebenden Larvenzebrafischen mit anschließender Beobachtung des optischen Tectums erreicht dieses Ziel. Das begleitende Video zeigt, wie man Larven betäubt, Wolframnadeln elektrolytisch schärft und damit ein Auge entfernt. Als nächstes wird gezeigt, wie man Gehirne aus festsitzenden Zebrafischlarven seziert. Schließlich bietet das Video einen Überblick über das Protokoll für die Immunhistochemie und eine Demonstration, wie gefärbte Embryonen in Agarose mit niedrigem Schmelzpunkt für die Mikroskopie gemountet werden können.
Introduction
Ziel dieser Methode ist es zu untersuchen, wie der retinale Input das Wachstum und die Entwicklung des optischen Tektums, des visuellen Verarbeitungszentrums im Zebrafischgehirn, beeinflusst. Durch Entfernen eines Auges und anschließenden Vergleich der beiden Seiten des optischen Tektums können tektale Veränderungen innerhalb derselben Probe beobachtet und normalisiert werden, was einen Vergleich zwischen mehreren Proben ermöglicht. Moderne molekulare Ansätze in Kombination mit dieser Technik werden Einblicke in die Mechanismen liefern, die dem Wachstum und der Entwicklung des visuellen Systems sowie der axonalen Degeneration und Regeneration zugrunde liegen.
Sensorische Systeme – visuelle, auditive und somatosensorische – sammeln Informationen von externen Organen und leiten diese Informationen an das zentrale Nervensystem weiter, wodurch “Karten” der äußeren Welt im Mittelhirn erzeugtwerden 1,2. Das Sehen ist die dominierende sensorische Modalität für fast alle Wirbeltiere, einschließlich vieler Fische. Die Netzhaut, das Nervengewebe im Auge, sammelt Informationen mit einem neuronalen Schaltkreis, der hauptsächlich aus Photorezeptoren, bipolaren Zellen und retinalen Ganglienzellen (RGCs), den Projektionsneuronen der Netzhaut, besteht. RGCs haben lange Axone, die ihren Weg über die innere Oberfläche der Netzhaut zum Sehnervenkopf finden, wo sie faszikulieren und gemeinsam durch das Gehirn wandern und schließlich im visuellen Verarbeitungszentrum im dorsalen Mittelhirn enden. Diese Struktur wird bei Fischen und anderen Nicht-Säugetierwirbeltieren als optisches Tectum bezeichnet und ist homolog zum Colliculus superior bei Säugetieren3.
Das optische Tectum ist eine bilateral symmetrische Mehrschichtstruktur im dorsalen Mittelhirn. Bei Zebrafischen und den meisten anderen Fischen erhält jeder Lappen des optischen Tektums visuelleEingaben ausschließlich vom kontralateralen Auge, so dass der linke Sehnerv im rechten Tektallappen und der rechte Sehnerv im linken Tektallappen 4 endet (Abbildung 1). Wie sein Gegenstück bei Säugetieren, der Colliculus superior, integriert das optische Tectum visuelle Informationen mit anderen sensorischen Eingaben, einschließlich Vorsprechen und Somatosensation, und steuert Verschiebungen der visuellen Aufmerksamkeit und Augenbewegungen wie Sakkaden 1,5,6. Im Gegensatz zum Colliculus superior des Säugetiers erzeugt das optische Tectum jedoch kontinuierlich neue Neuronen und Glia aus einer spezialisierten Stammzellnische in der Nähe der medialen und kaudalen Ränder der tektalen Lappen, der sogenannten tektalen Proliferationszone7. Die Aufrechterhaltung proliferativer Vorläufer im optischen Tectum und anderen Regionen des zentralen Nervensystems trägt zum Teil zu der bemerkenswerten Regenerationsfähigkeit bei, die in Zebrafisch8 dokumentiert ist.
Frühere Arbeiten, die das Gehirn von blinden oder einäugigen Fischen untersuchten, ergaben, dass die Größe des optischen Tektums direkt proportional zur Menge der retinalen Innervation ist, die sie erhält 9,10,11. Bei erwachsenen Höhlenfischen, deren Augen in der frühen Embryogenese degenerieren, ist das optische Tectum merklich kleiner als bei eng verwandten, gesichteten Oberflächenfischen9. Die Degeneration der Höhlenfischaugen kann blockiert werden, indem die endogene Linse während der Embryogenese durch eine Linse von einem Oberflächenfisch ersetzt wird. Wenn diese einäugigen Höhlenfische bis ins Erwachsenenalter aufgezogen werden, enthält der innervierte Tektallappen etwa 10% mehr Zellen als der nicht innervierte Tektallappen9. In ähnlicher Weise war bei Larvenkillifischen, die mit chemischen Behandlungen inkubiert wurden, um Augen unterschiedlicher Größe innerhalb desselben Individuums zu erzeugen, die Seite des Tektums mit mehr Innervation größer und enthielt mehr Neuronen10. Beweise aus Experimenten zur Quetschung des Sehnervs an erwachsenen Goldfischen deuten darauf hin, dass die Innervation die Proliferation fördert, wobei die Proliferation der tektalen Zellen abnimmt, wenn die Innervation gestört ist11.
Mehrere neuere Berichte, die diese klassischen Studien bestätigen und erweitern, liefern Daten, die darauf hindeuten, dass die Proliferation als Reaktion auf Innervation zumindest teilweise durch den BDNF-TrkB-Signalweg12,13 moduliert wird. Es bleiben viele offene Fragen zum Wachstum und zur Entwicklung des optischen Tektums, einschließlich der Frage, wie ein sich entwickelndes sensorisches System mit Verletzungen und Axondegeneration fertig wird, welche zellulären und molekularen Signale es ermöglichen, dass der Netzhauteintrag das Wachstum des optischen Tektums reguliert, wann diese Mechanismen aktiv werden und ob die innervationsbedingte Proliferation und Differenzierung es der Netzhaut und ihrem Zielgewebe ermöglicht, Wachstumsraten zu koordinieren und eine genaue retinotopische Kartierung zu gewährleisten. Darüber hinaus gibt es viel größere Fragen zur aktivitätsabhängigen Entwicklung, die durch die Befragung des visuellen Systems des Zebrafisches mit chirurgischen Ansätzen wie dem unten beschriebenen beantwortet werden können.
Um die zellulären und molekularen Mechanismen zu untersuchen, durch die neuronale Aktivität, insbesondere durch visuellen Input, das Überleben und die Proliferation von Zellen verändert, vergleicht der beschriebene Ansatz direkt innervierte und denervierte tektale Lappen (Abbildung 1) innerhalb einzelner Zebrafischlarven. Diese Methode ermöglicht die Dokumentation der RGC-Axondegeneration im optischen Tectum und die Bestätigung, dass die Anzahl der mitotischen Zellen mit der Innervation korreliert.
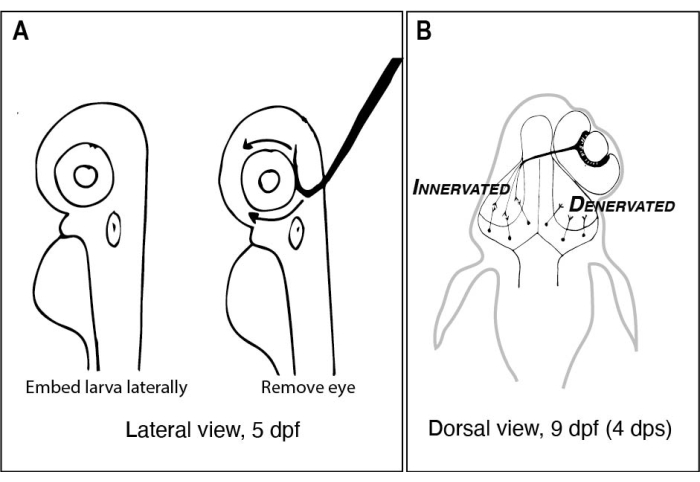
Abbildung 1: Skizzen von Zebrafischlarven vor und nach einseitiger Augenentfernung . (A) Zeichnung von 5 dpf-Larven unter einem Seziermikroskop. Jede Larve ist in Agarose mit niedrigem Schmelzpunkt eingebettet und seitlich ausgerichtet, bevor eine Wolframnadel mit einer scharfen, hakenförmigen Spitze verwendet wird, um das nach oben gerichtete Auge (in diesem Beispiel linkes Auge) herauszuholen. (B) Zeichnung der dorsalen Ansicht einer 9 dpf Larve, die aus der in A dargestellten Operation resultiert. Nur drei hochschematisierte RGC-Axone aus dem rechten Auge sind defaszikulierend und verbinden sich mit Neuronen im linken tektalen Lappen. Abkürzungen: dpf = Tage nach der Befruchtung; dps = Tage nach der Operation; RGC = retinale Ganglienzellen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Protocol
Representative Results
Discussion
Die in diesem Artikel beschriebenen Techniken veranschaulichen einen von vielen Ansätzen zur Untersuchung der visuellen Systementwicklung von Wirbeltieren bei Zebrafischen. Andere Forscher haben Methoden veröffentlicht, um die embryonale Netzhaut zu sezieren und Genexpressionsanalysendurchzuführen 19 oder neuronale Aktivität im optischen Tectum30 zu visualisieren. Dieses Papier bietet einen Ansatz, um zu untersuchen, wie differentieller Netzhauteintrag das Zellverhalten…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Die Finanzierung dieser Arbeit wurde in erster Linie durch Startkapital vom Reed College an KLC, Helen Stafford Research Fellowship-Mittel an OLH und ein Reed College Science Research Fellowship an YK unterstützt. Dieses Projekt begann im Labor von Steve Wilson als Zusammenarbeit mit HR, die von einer Wellcome Trust Studentship (2009-2014) unterstützt wurde. Wir danken Máté Varga, Steve Wilson und anderen Mitgliedern des Wilson-Labors für die ersten Diskussionen über dieses Projekt, und wir danken insbesondere Florencia Cavodeassi und Kate Edwards, die als erste KLC beigebracht haben, wie man Embryonen in Agarose besteigt und Zebrafisch-Hirndissektionen durchführt. Wir danken auch Greta Glover und Jay Ewing für die Hilfe bei der Montage unseres Wolfram-Nadelschärfgeräts.
Materials
| Equipment and supplies: | |||
| Breeding boxes | Aquaneering | ZHCT100 | |
| Dow Corning high vacuum grease | Sigma or equivalent supplier | Z273554 | |
| Erlenmeyer flasks (125 mL) | For making Marc's Modified Ringers (MMR) with antibiotics for post-surgery incubation | ||
| Fine forceps – Dumont #5 | Fine Science Tools (FST) | 11252-20 | |
| Glass Pasteur pipettes | DWK Lifescience | 63A53 & 63A53WT | For pipetting embryos and larvae |
| Glass slides for microscopy | VWR or equivalent supplier | 48311-703 | Standard glass microscope slides can be ordered from many different laboratory suppliers. |
| Glassware including graduated bottles and graduated cylinders | For making and storing solutions | ||
| 2-part epoxy resin | ACE Hardware or other equivalent supplier of Gorilla Glue or equivalent | 0.85 oz syringe | https://www.acehardware.com/departments/paint-and-supplies/tape-glues-and-adhesives/glues-and-epoxy/1590793 |
| Microcentrifuge tube (1.7 mL) | VWR or equivalent supplier | 22234-046 | |
| Nickel plated pin holder (17 cm length) | Fine Science Tools (FST) | 26018-17 | To hold tungsten wire while sharpening and performing surgeries/dissections. |
| Nylon mesh tea strainer or equivalent | Ali Express or equivalent | For harvesting zebrafish eggs after spawning; https://www.aliexpress.com/item/1005002219569756.html | |
| Paper clip | For Tungsten needle sharpening device. | ||
| Petri dishes 100 mm | Fischer Scientific or equivalent supplier | 50-190-0267 | |
| Petri dishes 35 mm | Fischer Scientific or equivalent supplier | 08-757-100A | |
| Pipette pump | SP Bel-Art or equivalent | F37898-0000 | |
| Potassium hydroxide (KOH) | Sigma | 909122 | For Tungsten needle sharpening device. Make a 10% w/v solution of KOH in the hood by adding pellets to deionized water. |
| Power supply (variable voltage) | For Tungsten needle sharpening device. Any power supply with variable voltage will work (even one used for gel electrophoresis). | ||
| Sylgard 184 Elastomer kit | Dow Corning | 3097358 | |
| Tungsten wire (0.125 mm diameter) | World Precision Instruments (WPI) | TGW0515 | Sharpen to remove eye and dissect larvae. |
| Variable temperature heat block | The Lab Depot or equivalent supplier | BSH1001 or BSH1002 | Set to 40-42 °C ahead of experiments. |
| Wide-mouth glass jar with lid (e.g., clean jam or salsa jar) | For Tungsten needle sharpening device. | ||
| Wires with alligator clip leads | For Tungsten needle sharpening device. | ||
| Microscopes: | |||
| Dissecting microscope | Any type will work but having adjustable transmitted light on a mirrored base is preferred. | ||
| Laser scanning confocal microscope | High NA, 20-25x water dipping objective lens is recommended. Microscope control and image capture software (Elements) is used here but any confocal microscope will work. |
||
| Reagents for surgeries and dissections: | |||
| Calcium chloride dihydrate | Sigma | C7902 | For Marc's Modified Ringers (MMR) and embryo medium (E3). |
| HEPES | Sigma | H7006 | For Marc's Modified Ringers (MMR). |
| Low melting point agarose | Invitrogen | 16520-050 | Make 1% in embryo medium (E3) or Marc's Modified Ringers (MMR). |
| Magnesium chloride hexahydrate | Sigma | 1374248 | For embryo medium (E3). |
| Magnesium sulfate | Sigma | M7506 | For Marc's Modified Ringers (MMR). |
| Paraformaldehyde | Electron Microscopy Sciences | 19210 | Dilute 8% (w/v) stock with 2x concentrated PBS (diluted from 10x PBS stock). |
| Penicillin/Streptomycin | Sigma | P4333-20ML | Dilute 1:100 in Marc's Modified Ringers. |
| Phosphate buffered saline (PBS) tablets | Diagnostic BioSystems | DMR E404-01 | Make 10x stock in deionized water, autoclave and store at room temperature. Dilute to 1x working concentration. |
| Potassium chloride | Sigma | P3911 | For Marc's Modified Ringers (MMR) and embryo medium (E3). |
| Sodium chloride | Sigma | S9888 | For Marc's Modified Ringers (MMR) and embryo medium (E3). |
| Sodium hydroxide | Sigma | S5881 | Make 10 M and use to adjust pH of MMR to 7.4. |
| Sucrose | Sigma | S9378 | |
| Tricaine-S | Pentair | 100G #TRS1 | Recipe: https://zfin.atlassian.net/wiki/spaces/prot/pages/362220023/TRICAINE |
| Reagents for immunohistochemistry: | |||
| Alexafluor 568 tagged Secondary antibody to detect rabbit IgG | Invitrogen | A-11011 | Use at 1:500 dilution for wholemount immunohistochemistry. |
| DAPI or ToPro3 | Invitrogen | 1306 or T3605 | Make up 1 mg/mL solutions in DMSO; 1:5,000 dilution for counterstaining. |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | A component of immunoblock buffer. |
| Methanol (MeOH) | Sigma | 34860 | Mixing MeOH with aqueous solutions like PBST is exothermic. Make the MeOH/PBST solutions at least several hours ahead of time or cool them on ice before using. |
| Normal goat serum | ThermoFisher Scientific | 50-062Z | A component of immunoblock buffer. Can be aliquoted in 1-10 mL volumes and stored at -20 °C. |
| Primary antibody to detect phosphohistone H3 | Millipore | 06-570 | Use at 1:300 dilution for wholemount immunohistochemistry. |
| Primary antibody to detect Red Fluorescent Protein (RFP; detects dsRed derivatives) | MBL International | PM005 | Use at 1:500 dilution for wholemount immunohistochemistry. |
| Proteinase K (PK) | Sigma | P2308-10MG | Make up 10 mg/mL stock solutions in PBS and use at 10 µg/mL. |
| Triton X-100 | Sigma | T8787 | Useful to make a 20% (v/v) stock solution in PBS. |
| Software for data analysis | |||
| ImageJ (Fiji) | freeware for image analysis; https://imagej.net/software/fiji/ | ||
| Rstudio | freeware for statistical analysis and data visualization; https://www.rstudio.com/products/rstudio/download/ | ||
| Adobe Photoshop or GIMP | Proprietary image processing software (Adobe Photoshop and Illustrator) are often used to compose figures). A freeware alternative is Gnu Image Manipulation Program (GIMP; https://www.gimp.org/) | ||
| Zebrafish strains | available from the Zebrafish International Resource Centers in the US (https://zebrafish.org/home/guide.php) or in Europe (https://www.ezrc.kit.edu/). Specialized transgenic strains that have not yet been deposited in either resource center can be requested from individual labs after publication. |
Riferimenti
- Butler, A. B., Hodos, W. Optic tectum. Comparative Vertebrate Neuroanatomy: Evolution and Adaptation. , 311-340 (2005).
- Cang, J., Feldheim, D. A. Developmental mechanisms of topographic map formation and alignment. Annual Review of Neuroscience. 36 (1), 51-77 (2013).
- Basso, M. A., Bickford, M. E., Cang, J. Unraveling circuits of visual perception and cognition through the superior colliculus. Neuron. 109 (6), 918-937 (2021).
- Burrill, J. D., Easter, S. S. Development of the retinofugal projections in the embryonic and larval zebrafish (Brachydanio rerio). The Journal of Comparative Neurology. 346 (4), 583-600 (1994).
- Regeneration in the goldfish visual system. Webvision: The Organization of the Retina and Visual System Available from: https://webvision.med.utah.edu/book/part-x-repair-and-regeneration-in-the-visual-system/regeneration-in-the-goldfish-visual-system/ (2021)
- Regeneration in the visual system of adult mammals. Webvision: The Organization of the Retina and Visual System Available from: https://webvision.med.utah.edu/book/part-x-repair-and-regeneration-in-the-visual-system/regeneration-in-the-visual-system-of-adult-mammals/ (2021)
- Cerveny, K. L., Varga, M., Wilson, S. W. Continued growth and circuit building in the anamniote visual system. Developmental Neurobiology. 72 (3), 328-345 (2012).
- Lindsey, B. W., et al. Midbrain tectal stem cells display diverse regenerative capacities in zebrafish. Scientific Reports. 9 (1), 4420 (2019).
- Soares, D., Yamamoto, Y., Strickler, A. G., Jeffery, W. R. The lens has a specific influence on optic nerve and tectum development in the blind cavefish Astyanax. Developmental Neuroscience. 26 (5-6), 308-317 (2004).
- White, E. L. An experimental study of the relationship between the size of the eye and the size of the optic tectum in the brain of the developing teleost, Fundulus heteroclitus. Journal of Experimental Zoology. 108 (3), 439-469 (1948).
- Raymond, P., Easter, S., Burnham, J., Powers, M. Postembryonic growth of the optic tectum in goldfish. II. Modulation of cell proliferation by retinal fiber input. The Journal of Neuroscience. 3 (5), 1092-1099 (1983).
- Sato, Y., Yano, H., Shimizu, Y., Tanaka, H., Ohshima, T. Optic nerve input-dependent regulation of neural stem cell proliferation in the optic tectum of adult zebrafish. Developmental Neurobiology. 77 (4), 474-482 (2017).
- Hall, Z. J., Tropepe, V. Visual experience facilitates BDNF-dependent adaptive recruitment of new neurons in the postembryonic optic tectum. The Journal of Neuroscience. 38 (8), 2000-2014 (2018).
- Nusslein-Volhard, C., Dahm, R. . Zebrafish. , (2002).
- Cold Spring Harbor Protocols. Marc’s modified Ringer’s (MMR) (10X, pH 7.4). Cold Spring Harbor Protocols. , (2009).
- Turner, K. J., Bracewell, T. G., Hawkins, T. A. Anatomical dissection of zebrafish brain development. Brain Development. 1082, 197-214 (2014).
- Brady, J. A simple technique for making very fine, durable dissecting needles by sharpening tungsten wire electrolytically. Bulletin of the World Health Organization. 32 (1), 143-144 (1965).
- . ZFIN Tricaine recipe Available from: https://zfin.atlassian.net/wiki/spaces/prot/pages/362220023/TRICAINE (2018)
- Zhang, L., Leung, Y. F. Microdissection of zebrafish embryonic eye tissues. Journal of Visualized Experiments: JoVE. (40), e2028 (2010).
- . ZFIN protocols Available from: https://zfin.atlassian.net/wiki/spaces/prot/overview (2021)
- Engerer, P., Plucinska, G., Thong, R., Trovò, L., Paquet, D., Godinho, L. Imaging subcellular structures in the living zebrafish embryo. Journal of Visualized Experiments: JoVE. (110), e53456 (2016).
- ImageJ with batteries included. Fiji Available from: https://figi.sc/ (2021)
- O’Brien, J., Hayder, H., Peng, C. Automated quantification and analysis of cell counting procedures using ImageJ plugins. Journal of Visualized Experiments: JoVE. (117), e54719 (2016).
- Poggi, L., Vitorino, M., Masai, I., Harris, W. A. Influences on neural lineage and mode of division in the zebrafish retina in vivo. The Journal of Cell Biology. 171 (6), 991-999 (2005).
- Karlstrom, R. O., et al. Zebrafish mutations affecting retinotectal axon pathfinding. Development. 123 (1), 427-438 (1996).
- Harvey, B. M., Baxter, M., Granato, M. Optic nerve regeneration in larval zebrafish exhibits spontaneous capacity for retinotopic but not tectum specific axon targeting. PLOS ONE. 14 (6), 0218667 (2019).
- Robles, E., Filosa, A., Baier, H. Precise lamination of retinal axons generates multiple parallel input pathways in the tectum. Journal of Neuroscience. 33 (11), 5027-5039 (2013).
- Vargas, M. E., Barres, B. A. Why Is Wallerian degeneration in the CNS so slow. Annual Review of Neuroscience. 30 (1), 153-179 (2007).
- Hughes, A. N., Appel, B. Microglia phagocytose myelin sheaths to modify developmental myelination. Nature Neuroscience. 23 (9), 1055-1066 (2020).
- de Calbiac, H., Dabacan, A., Muresan, R., Kabashi, E., Ciura, S. Behavioral and physiological analysis in a zebrafish model of epilepsy. Journal of Visualized Experiments: JoVE. (176), e58837 (2021).
- Adams, S. L., Zhang, T., Rawson, D. M. The effect of external medium composition on membrane water permeability of zebrafish (Danio rerio) embryos. Theriogenology. 64 (7), 1591-1602 (2005).
- Fredj, N. B., et al. Synaptic activity and activity-dependent competition regulates axon arbor maturation, growth arrest, and territory in the retinotectal projection. Journal of Neuroscience. 30 (32), 10939-10951 (2010).
- Alberio, L., et al. A light-gated potassium channel for sustained neuronal inhibition. Nature Methods. 15 (11), 969-976 (2018).
- Kay, J. N., Finger-Baier, K. C., Roeser, T., Staub, W., Baier, H. Retinal ganglion cell genesis requires lakritz, a zebrafish atonal homolog. Neuron. 30 (3), 725-736 (2001).
- Gnuegge, L., Schmid, S., Neuhauss, S. C. F. Analysis of the activity-deprived zebrafish mutant macho reveals an essential requirement of neuronal activity for the development of a fine-grained visuotopic map. The Journal of Neuroscience. 21 (10), 3542-3548 (2001).
- Jeffery, W. R. Astyanax surface and cave fish morphs. EvoDevo. 11 (1), 14 (2020).
- Sieger, D., Peri, F. Animal models for studying microglia: The first, the popular, and the new. Glia. 61 (1), 3-9 (2013).
- Svahn, A. J., et al. Development of ramified microglia from early macrophages in the zebrafish optic tectum. Developmental Neurobiology. 73 (1), 60-71 (2013).
- Herzog, C., et al. Rapid clearance of cellular debris by microglia limits secondary neuronal cell death after brain injury in vivo. Development. 146 (9), (2019).
- Chen, J., Poskanzer, K. E., Freeman, M. R., Monk, K. R. Live-imaging of astrocyte morphogenesis and function in zebrafish neural circuits. Nature Neuroscience. 23 (10), 1297-1306 (2020).

