Rimozione dell'occhio nelle larve di zebrafish viventi per esaminare la crescita dipendente dall'innervazione e lo sviluppo del sistema visivo
Summary
L’articolo spiega come rimuovere chirurgicamente gli occhi dalle larve viventi di zebrafish come primo passo verso lo studio di come l’input retinico influenza la crescita e lo sviluppo del tectum ottico. Inoltre, l’articolo fornisce informazioni sull’anestesia larvale, la fissazione e la dissezione cerebrale, seguite da immunoistochimica e imaging confocale.
Abstract
I pesci zebra mostrano una notevole crescita per tutta la vita e capacità rigenerative. Ad esempio, nicchie di cellule staminali specializzate stabilite durante l’embriogenesi supportano la crescita continua dell’intero sistema visivo, sia nell’occhio che nel cervello. La crescita coordinata tra la retina e il tectum ottico garantisce un’accurata mappatura retinotopica quando vengono aggiunti nuovi neuroni negli occhi e nel cervello. Per capire se gli assoni retinici forniscono informazioni cruciali per la regolazione dei comportamenti delle cellule staminali e progenitrici del tectale come la sopravvivenza, la proliferazione e / o la differenziazione, è necessario essere in grado di confrontare i lobi tettoli innervati e denervati all’interno dello stesso animale e tra gli animali.
La rimozione chirurgica di un occhio dal pesce zebra larvale vivente seguita dall’osservazione del tectum ottico raggiunge questo obiettivo. Il video di accompagnamento dimostra come anestetizzare le larve, affilare elettroliticamente gli aghi di tungsteno e usarli per rimuovere un occhio. Successivamente mostra come sezionare il cervello dalle larve fisse di zebrafish. Infine, il video fornisce una panoramica del protocollo per l’immunoistochimica e una dimostrazione di come montare embrioni colorati in agarosio a basso punto di fusione per la microscopia.
Introduction
L’obiettivo di questo metodo è quello di indagare come l’input retinico influenza la crescita e lo sviluppo del tectum ottico, il centro di elaborazione visiva nel cervello del pesce zebra. Rimuovendo un occhio e quindi confrontando i due lati del tectum ottico, è possibile osservare e normalizzare i cambiamenti tectali all’interno dello stesso campione, consentendo il confronto tra più campioni. I moderni approcci molecolari combinati con questa tecnica forniranno informazioni sui meccanismi alla base della crescita e dello sviluppo del sistema visivo, nonché della degenerazione e rigenerazione assonale.
I sistemi sensoriali – visivi, uditivi e somatosensoriali – raccolgono informazioni dagli organi esterni e trasmettono tali informazioni al sistema nervoso centrale, generando “mappe” del mondo esterno attraverso il mesencefalo 1,2. La visione è la modalità sensoriale dominante per quasi tutti i vertebrati, compresi molti pesci. La retina, il tessuto neurale dell’occhio, raccoglie informazioni con un circuito neuronale costituito principalmente da fotorecettori, cellule bipolari e cellule gangliari retiniche (RGC), i neuroni di proiezione della retina. Gli RGC hanno lunghi assoni che trovano la loro strada attraverso la superficie interna della retina fino alla testa del nervo ottico, dove si fascicolano e viaggiano insieme attraverso il cervello, terminando infine nel centro di elaborazione visiva nel mesencefalo dorsale. Questa struttura è chiamata tectum ottico nei pesci e in altri vertebrati non mammiferi ed è omologa al collicolo superiore nei mammiferi3.
Il tectum ottico è una struttura multistrato bilateralmente simmetrica nel mesencefalo dorsale. Nel pesce zebra e nella maggior parte degli altri pesci, ogni lobo del tectum ottico riceve input visivi esclusivamente dall’occhio controlaterale, in modo tale che il nervo ottico sinistro termina nel lobo tectale destro e il nervo ottico destro termina nel lobo tectale sinistro4 (Figura 1). Come la sua controparte mammifera, il collicolo superiore, il tectum ottico integra le informazioni visive con altri input sensoriali, tra cui l’audizione e la somatosensazione, controllando i cambiamenti nell’attenzione visiva e nei movimenti oculari come le saccadi 1,5,6. Tuttavia, a differenza del collicolo superiore dei mammiferi, il tectum ottico genera continuamente nuovi neuroni e glia da una nicchia di cellule staminali specializzate vicino ai bordi mediali e caudali dei lobi tettoli chiamati zona di proliferazione tectale7. Il mantenimento dei progenitori proliferativi nel tectum ottico e in altre regioni del sistema nervoso centrale contribuisce, in parte, alla notevole capacità rigenerativa documentata nel pesce zebra8.
Lavori precedenti che esaminano il cervello di pesci ciechi o con un occhio solo hanno rivelato che la dimensione del tectum ottico è direttamente proporzionale alla quantità di innervazione retinica che riceve 9,10,11. Nei pesci delle caverne adulti, i cui occhi degenerano nell’embriogenesi precoce, il tectum ottico è notevolmente più piccolo di quello dei pesci di superficie strettamente imparentati e vedenti9. La degenerazione dell’occhio di pesce delle caverne può essere bloccata sostituendo la lente endogena con una lente da un pesce di superficie durante l’embriogenesi. Quando questi pesci delle caverne con un occhio solo vengono allevati fino all’età adulta, il lobo tectale innervato contiene circa il 10% in più di cellule rispetto al lobo tectale non innervato9. Allo stesso modo, nei killifish larvali che sono stati incubati con trattamenti chimici per generare occhi di dimensioni diverse all’interno dello stesso individuo, il lato del tectum con più innervazione era più grande e conteneva più neuroni10. Le prove degli esperimenti di schiacciamento del nervo ottico nel pesce rosso adulto indicano che l’innervazione promuove la proliferazione, con la proliferazione delle cellule tettoniche che diminuisce quando l’innervazione è stata interrotta11.
Confermando ed estendendo questi studi classici, diversi rapporti recenti forniscono dati che suggeriscono che la proliferazione in risposta all’innervazione è modulata, almeno in parte, dalla via BDNF-TrkB12,13. Rimangono molte domande aperte sulla crescita e lo sviluppo del tectum ottico, incluso il modo in cui un sistema sensoriale in via di sviluppo affronta la degenerazione di lesioni e assoni, quali segnali cellulari e molecolari consentono l’input retinico per regolare la crescita del tectum ottico, quando questi meccanismi diventano attivi e se la proliferazione e la differenziazione legate all’innervazione consentono alla retina e al suo tessuto bersaglio di coordinare i tassi di crescita e garantire un’accurata mappatura retinotopica. Inoltre, ci sono domande molto più grandi sullo sviluppo dipendente dall’attività che possono essere affrontate interrogando il sistema visivo del pesce zebra con approcci chirurgici come quello descritto di seguito.
Per studiare i meccanismi cellulari e molecolari con cui l’attività neurale, in particolare dall’input visivo, altera la sopravvivenza e la proliferazione cellulare, l’approccio descritto confronta direttamente i lobi tettoli innervati e denervati (Figura 1) all’interno delle singole larve di zebrafish. Questo metodo consente la documentazione della degenerazione dell’assone RGC nel tectum ottico e la conferma che il numero di cellule mitotiche è correlato all’innervazione.
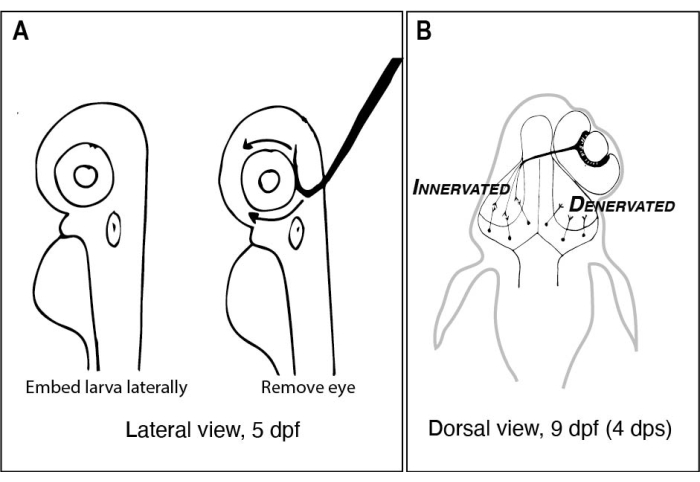
Figura 1: Schizzi di larve di zebrafish prima e dopo la rimozione unilaterale dell’occhio. (A) Disegno di 5 larve dpf viste al microscopio di dissezione. Ogni larva è incorporata in agarosio a basso punto di fusione e orientata lateralmente prima che un ago di tungsteno con una punta affilata e uncinata venga utilizzato per estrarre l’occhio rivolto verso l’alto (occhio sinistro in questo esempio). (B) Disegno della vista dorsale di una larva di 9 dpf risultante dall’intervento chirurgico raffigurato in A. Solo tre assoni RGC altamente schematizzati dall’occhio destro sono mostrati defascicolare e connettersi con i neuroni nel lobo tectale sinistro. Abbreviazioni: dpf = giorni dopo la fecondazione; dps = giorni dopo l’intervento; RGC = cellule gangliari retiniche. Fare clic qui per visualizzare una versione più grande di questa figura.
Protocol
Representative Results
Discussion
Le tecniche descritte in questo articolo illustrano uno dei tanti approcci per lo studio dello sviluppo del sistema visivo dei vertebrati nel pesce zebra. Altri ricercatori hanno pubblicato metodi per sezionare la retina embrionale ed eseguire analisi di espressione genica19 o visualizzare l’attività neuronale nel tectum ottico30. Questo documento fornisce un approccio per esplorare come l’input retinico differenziale può influenzare i comportamenti cellulari nel tectum o…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Il finanziamento per questo lavoro è stato sostenuto principalmente da fondi di start-up dal Reed College a KLC, dai fondi Helen Stafford Research Fellowship a OLH e da una Reed College Science Research Fellowship a YK. Questo progetto è iniziato nel laboratorio di Steve Wilson come collaborazione con le risorse umane, che è stato supportato da un Wellcome Trust Studentship (2009-2014). Ringraziamo Máté Varga, Steve Wilson e altri membri del laboratorio Wilson per le discussioni iniziali su questo progetto, e ringraziamo in particolare Florencia Cavodeassi e Kate Edwards, che sono state le prime a insegnare a KLC come montare embrioni in agarosio ed eseguire dissezioni cerebrali di zebrafish. Ringraziamo anche Greta Glover e Jay Ewing per l’aiuto nell’assemblaggio del nostro dispositivo di affilatura ad ago in tungsteno.
Materials
| Equipment and supplies: | |||
| Breeding boxes | Aquaneering | ZHCT100 | |
| Dow Corning high vacuum grease | Sigma or equivalent supplier | Z273554 | |
| Erlenmeyer flasks (125 mL) | For making Marc's Modified Ringers (MMR) with antibiotics for post-surgery incubation | ||
| Fine forceps – Dumont #5 | Fine Science Tools (FST) | 11252-20 | |
| Glass Pasteur pipettes | DWK Lifescience | 63A53 & 63A53WT | For pipetting embryos and larvae |
| Glass slides for microscopy | VWR or equivalent supplier | 48311-703 | Standard glass microscope slides can be ordered from many different laboratory suppliers. |
| Glassware including graduated bottles and graduated cylinders | For making and storing solutions | ||
| 2-part epoxy resin | ACE Hardware or other equivalent supplier of Gorilla Glue or equivalent | 0.85 oz syringe | https://www.acehardware.com/departments/paint-and-supplies/tape-glues-and-adhesives/glues-and-epoxy/1590793 |
| Microcentrifuge tube (1.7 mL) | VWR or equivalent supplier | 22234-046 | |
| Nickel plated pin holder (17 cm length) | Fine Science Tools (FST) | 26018-17 | To hold tungsten wire while sharpening and performing surgeries/dissections. |
| Nylon mesh tea strainer or equivalent | Ali Express or equivalent | For harvesting zebrafish eggs after spawning; https://www.aliexpress.com/item/1005002219569756.html | |
| Paper clip | For Tungsten needle sharpening device. | ||
| Petri dishes 100 mm | Fischer Scientific or equivalent supplier | 50-190-0267 | |
| Petri dishes 35 mm | Fischer Scientific or equivalent supplier | 08-757-100A | |
| Pipette pump | SP Bel-Art or equivalent | F37898-0000 | |
| Potassium hydroxide (KOH) | Sigma | 909122 | For Tungsten needle sharpening device. Make a 10% w/v solution of KOH in the hood by adding pellets to deionized water. |
| Power supply (variable voltage) | For Tungsten needle sharpening device. Any power supply with variable voltage will work (even one used for gel electrophoresis). | ||
| Sylgard 184 Elastomer kit | Dow Corning | 3097358 | |
| Tungsten wire (0.125 mm diameter) | World Precision Instruments (WPI) | TGW0515 | Sharpen to remove eye and dissect larvae. |
| Variable temperature heat block | The Lab Depot or equivalent supplier | BSH1001 or BSH1002 | Set to 40-42 °C ahead of experiments. |
| Wide-mouth glass jar with lid (e.g., clean jam or salsa jar) | For Tungsten needle sharpening device. | ||
| Wires with alligator clip leads | For Tungsten needle sharpening device. | ||
| Microscopes: | |||
| Dissecting microscope | Any type will work but having adjustable transmitted light on a mirrored base is preferred. | ||
| Laser scanning confocal microscope | High NA, 20-25x water dipping objective lens is recommended. Microscope control and image capture software (Elements) is used here but any confocal microscope will work. |
||
| Reagents for surgeries and dissections: | |||
| Calcium chloride dihydrate | Sigma | C7902 | For Marc's Modified Ringers (MMR) and embryo medium (E3). |
| HEPES | Sigma | H7006 | For Marc's Modified Ringers (MMR). |
| Low melting point agarose | Invitrogen | 16520-050 | Make 1% in embryo medium (E3) or Marc's Modified Ringers (MMR). |
| Magnesium chloride hexahydrate | Sigma | 1374248 | For embryo medium (E3). |
| Magnesium sulfate | Sigma | M7506 | For Marc's Modified Ringers (MMR). |
| Paraformaldehyde | Electron Microscopy Sciences | 19210 | Dilute 8% (w/v) stock with 2x concentrated PBS (diluted from 10x PBS stock). |
| Penicillin/Streptomycin | Sigma | P4333-20ML | Dilute 1:100 in Marc's Modified Ringers. |
| Phosphate buffered saline (PBS) tablets | Diagnostic BioSystems | DMR E404-01 | Make 10x stock in deionized water, autoclave and store at room temperature. Dilute to 1x working concentration. |
| Potassium chloride | Sigma | P3911 | For Marc's Modified Ringers (MMR) and embryo medium (E3). |
| Sodium chloride | Sigma | S9888 | For Marc's Modified Ringers (MMR) and embryo medium (E3). |
| Sodium hydroxide | Sigma | S5881 | Make 10 M and use to adjust pH of MMR to 7.4. |
| Sucrose | Sigma | S9378 | |
| Tricaine-S | Pentair | 100G #TRS1 | Recipe: https://zfin.atlassian.net/wiki/spaces/prot/pages/362220023/TRICAINE |
| Reagents for immunohistochemistry: | |||
| Alexafluor 568 tagged Secondary antibody to detect rabbit IgG | Invitrogen | A-11011 | Use at 1:500 dilution for wholemount immunohistochemistry. |
| DAPI or ToPro3 | Invitrogen | 1306 or T3605 | Make up 1 mg/mL solutions in DMSO; 1:5,000 dilution for counterstaining. |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | A component of immunoblock buffer. |
| Methanol (MeOH) | Sigma | 34860 | Mixing MeOH with aqueous solutions like PBST is exothermic. Make the MeOH/PBST solutions at least several hours ahead of time or cool them on ice before using. |
| Normal goat serum | ThermoFisher Scientific | 50-062Z | A component of immunoblock buffer. Can be aliquoted in 1-10 mL volumes and stored at -20 °C. |
| Primary antibody to detect phosphohistone H3 | Millipore | 06-570 | Use at 1:300 dilution for wholemount immunohistochemistry. |
| Primary antibody to detect Red Fluorescent Protein (RFP; detects dsRed derivatives) | MBL International | PM005 | Use at 1:500 dilution for wholemount immunohistochemistry. |
| Proteinase K (PK) | Sigma | P2308-10MG | Make up 10 mg/mL stock solutions in PBS and use at 10 µg/mL. |
| Triton X-100 | Sigma | T8787 | Useful to make a 20% (v/v) stock solution in PBS. |
| Software for data analysis | |||
| ImageJ (Fiji) | freeware for image analysis; https://imagej.net/software/fiji/ | ||
| Rstudio | freeware for statistical analysis and data visualization; https://www.rstudio.com/products/rstudio/download/ | ||
| Adobe Photoshop or GIMP | Proprietary image processing software (Adobe Photoshop and Illustrator) are often used to compose figures). A freeware alternative is Gnu Image Manipulation Program (GIMP; https://www.gimp.org/) | ||
| Zebrafish strains | available from the Zebrafish International Resource Centers in the US (https://zebrafish.org/home/guide.php) or in Europe (https://www.ezrc.kit.edu/). Specialized transgenic strains that have not yet been deposited in either resource center can be requested from individual labs after publication. |
Riferimenti
- Butler, A. B., Hodos, W. Optic tectum. Comparative Vertebrate Neuroanatomy: Evolution and Adaptation. , 311-340 (2005).
- Cang, J., Feldheim, D. A. Developmental mechanisms of topographic map formation and alignment. Annual Review of Neuroscience. 36 (1), 51-77 (2013).
- Basso, M. A., Bickford, M. E., Cang, J. Unraveling circuits of visual perception and cognition through the superior colliculus. Neuron. 109 (6), 918-937 (2021).
- Burrill, J. D., Easter, S. S. Development of the retinofugal projections in the embryonic and larval zebrafish (Brachydanio rerio). The Journal of Comparative Neurology. 346 (4), 583-600 (1994).
- Regeneration in the goldfish visual system. Webvision: The Organization of the Retina and Visual System Available from: https://webvision.med.utah.edu/book/part-x-repair-and-regeneration-in-the-visual-system/regeneration-in-the-goldfish-visual-system/ (2021)
- Regeneration in the visual system of adult mammals. Webvision: The Organization of the Retina and Visual System Available from: https://webvision.med.utah.edu/book/part-x-repair-and-regeneration-in-the-visual-system/regeneration-in-the-visual-system-of-adult-mammals/ (2021)
- Cerveny, K. L., Varga, M., Wilson, S. W. Continued growth and circuit building in the anamniote visual system. Developmental Neurobiology. 72 (3), 328-345 (2012).
- Lindsey, B. W., et al. Midbrain tectal stem cells display diverse regenerative capacities in zebrafish. Scientific Reports. 9 (1), 4420 (2019).
- Soares, D., Yamamoto, Y., Strickler, A. G., Jeffery, W. R. The lens has a specific influence on optic nerve and tectum development in the blind cavefish Astyanax. Developmental Neuroscience. 26 (5-6), 308-317 (2004).
- White, E. L. An experimental study of the relationship between the size of the eye and the size of the optic tectum in the brain of the developing teleost, Fundulus heteroclitus. Journal of Experimental Zoology. 108 (3), 439-469 (1948).
- Raymond, P., Easter, S., Burnham, J., Powers, M. Postembryonic growth of the optic tectum in goldfish. II. Modulation of cell proliferation by retinal fiber input. The Journal of Neuroscience. 3 (5), 1092-1099 (1983).
- Sato, Y., Yano, H., Shimizu, Y., Tanaka, H., Ohshima, T. Optic nerve input-dependent regulation of neural stem cell proliferation in the optic tectum of adult zebrafish. Developmental Neurobiology. 77 (4), 474-482 (2017).
- Hall, Z. J., Tropepe, V. Visual experience facilitates BDNF-dependent adaptive recruitment of new neurons in the postembryonic optic tectum. The Journal of Neuroscience. 38 (8), 2000-2014 (2018).
- Nusslein-Volhard, C., Dahm, R. . Zebrafish. , (2002).
- Cold Spring Harbor Protocols. Marc’s modified Ringer’s (MMR) (10X, pH 7.4). Cold Spring Harbor Protocols. , (2009).
- Turner, K. J., Bracewell, T. G., Hawkins, T. A. Anatomical dissection of zebrafish brain development. Brain Development. 1082, 197-214 (2014).
- Brady, J. A simple technique for making very fine, durable dissecting needles by sharpening tungsten wire electrolytically. Bulletin of the World Health Organization. 32 (1), 143-144 (1965).
- . ZFIN Tricaine recipe Available from: https://zfin.atlassian.net/wiki/spaces/prot/pages/362220023/TRICAINE (2018)
- Zhang, L., Leung, Y. F. Microdissection of zebrafish embryonic eye tissues. Journal of Visualized Experiments: JoVE. (40), e2028 (2010).
- . ZFIN protocols Available from: https://zfin.atlassian.net/wiki/spaces/prot/overview (2021)
- Engerer, P., Plucinska, G., Thong, R., Trovò, L., Paquet, D., Godinho, L. Imaging subcellular structures in the living zebrafish embryo. Journal of Visualized Experiments: JoVE. (110), e53456 (2016).
- ImageJ with batteries included. Fiji Available from: https://figi.sc/ (2021)
- O’Brien, J., Hayder, H., Peng, C. Automated quantification and analysis of cell counting procedures using ImageJ plugins. Journal of Visualized Experiments: JoVE. (117), e54719 (2016).
- Poggi, L., Vitorino, M., Masai, I., Harris, W. A. Influences on neural lineage and mode of division in the zebrafish retina in vivo. The Journal of Cell Biology. 171 (6), 991-999 (2005).
- Karlstrom, R. O., et al. Zebrafish mutations affecting retinotectal axon pathfinding. Development. 123 (1), 427-438 (1996).
- Harvey, B. M., Baxter, M., Granato, M. Optic nerve regeneration in larval zebrafish exhibits spontaneous capacity for retinotopic but not tectum specific axon targeting. PLOS ONE. 14 (6), 0218667 (2019).
- Robles, E., Filosa, A., Baier, H. Precise lamination of retinal axons generates multiple parallel input pathways in the tectum. Journal of Neuroscience. 33 (11), 5027-5039 (2013).
- Vargas, M. E., Barres, B. A. Why Is Wallerian degeneration in the CNS so slow. Annual Review of Neuroscience. 30 (1), 153-179 (2007).
- Hughes, A. N., Appel, B. Microglia phagocytose myelin sheaths to modify developmental myelination. Nature Neuroscience. 23 (9), 1055-1066 (2020).
- de Calbiac, H., Dabacan, A., Muresan, R., Kabashi, E., Ciura, S. Behavioral and physiological analysis in a zebrafish model of epilepsy. Journal of Visualized Experiments: JoVE. (176), e58837 (2021).
- Adams, S. L., Zhang, T., Rawson, D. M. The effect of external medium composition on membrane water permeability of zebrafish (Danio rerio) embryos. Theriogenology. 64 (7), 1591-1602 (2005).
- Fredj, N. B., et al. Synaptic activity and activity-dependent competition regulates axon arbor maturation, growth arrest, and territory in the retinotectal projection. Journal of Neuroscience. 30 (32), 10939-10951 (2010).
- Alberio, L., et al. A light-gated potassium channel for sustained neuronal inhibition. Nature Methods. 15 (11), 969-976 (2018).
- Kay, J. N., Finger-Baier, K. C., Roeser, T., Staub, W., Baier, H. Retinal ganglion cell genesis requires lakritz, a zebrafish atonal homolog. Neuron. 30 (3), 725-736 (2001).
- Gnuegge, L., Schmid, S., Neuhauss, S. C. F. Analysis of the activity-deprived zebrafish mutant macho reveals an essential requirement of neuronal activity for the development of a fine-grained visuotopic map. The Journal of Neuroscience. 21 (10), 3542-3548 (2001).
- Jeffery, W. R. Astyanax surface and cave fish morphs. EvoDevo. 11 (1), 14 (2020).
- Sieger, D., Peri, F. Animal models for studying microglia: The first, the popular, and the new. Glia. 61 (1), 3-9 (2013).
- Svahn, A. J., et al. Development of ramified microglia from early macrophages in the zebrafish optic tectum. Developmental Neurobiology. 73 (1), 60-71 (2013).
- Herzog, C., et al. Rapid clearance of cellular debris by microglia limits secondary neuronal cell death after brain injury in vivo. Development. 146 (9), (2019).
- Chen, J., Poskanzer, K. E., Freeman, M. R., Monk, K. R. Live-imaging of astrocyte morphogenesis and function in zebrafish neural circuits. Nature Neuroscience. 23 (10), 1297-1306 (2020).

