Extirpación de ojos en larvas vivas de pez cebra para examinar el crecimiento dependiente de la inervación y el desarrollo del sistema visual
Summary
El artículo explica cómo extirpar quirúrgicamente los ojos de las larvas vivas de pez cebra como el primer paso hacia la investigación de cómo la entrada de retina influye en el crecimiento y desarrollo del tectum óptico. Además, el artículo proporciona información sobre la anestesia larvaria, la fijación y la disección cerebral, seguida de inmunohistoquímica e imágenes confocales.
Abstract
El pez cebra exhibe un notable crecimiento de por vida y habilidades regenerativas. Por ejemplo, los nichos especializados de células madre establecidos durante la embriogénesis apoyan el crecimiento continuo de todo el sistema visual, tanto en el ojo como en el cerebro. El crecimiento coordinado entre la retina y el tectum óptico garantiza un mapeo retinotópico preciso a medida que se agregan nuevas neuronas en los ojos y el cerebro. Para abordar si los axones de la retina proporcionan información crucial para regular los comportamientos de las células madre y progenitoras tectales, como la supervivencia, la proliferación y / o la diferenciación, es necesario poder comparar los lóbulos tectales inervados y denervados dentro del mismo animal y entre animales.
La extirpación quirúrgica de un ojo del pez cebra larval vivo seguida de la observación del tectum óptico logra este objetivo. El video que lo acompaña muestra cómo anestesiar larvas, afilar electrolíticamente agujas de tungsteno y usarlas para extirpar un ojo. A continuación, muestra cómo diseccionar cerebros de larvas fijas de pez cebra. Finalmente, el video proporciona una visión general del protocolo para la inmunohistoquímica y una demostración de cómo montar embriones teñidos en agarosa de bajo punto de fusión para microscopía.
Introduction
El objetivo de este método es investigar cómo la entrada de retina influye en el crecimiento y desarrollo del tectum óptico, el centro de procesamiento visual en el cerebro del pez cebra. Al extraer un ojo y luego comparar los dos lados del tectum óptico, se pueden observar y normalizar los cambios técnicos dentro de la misma muestra, lo que permite la comparación entre múltiples muestras. Los enfoques moleculares modernos combinados con esta técnica proporcionarán información sobre los mecanismos subyacentes al crecimiento y desarrollo del sistema visual, así como a la degeneración y regeneración axonal.
Los sistemas sensoriales (visual, auditivo y somatosensorial) recopilan información de los órganos externos y transmiten esa información al sistema nervioso central, generando “mapas” del mundo externo a través delmesencéfalo 1,2. La visión es la modalidad sensorial dominante para casi todos los vertebrados, incluidos muchos peces. La retina, el tejido neural en el ojo, recopila información con un circuito neuronal que consiste principalmente en fotorreceptores, células bipolares y células ganglionares de la retina (RGC), las neuronas de proyección de la retina. Los RGC tienen axones largos que encuentran su camino a través de la superficie interna de la retina hasta la cabeza del nervio óptico, donde fasciculan y viajan juntos a través del cerebro, terminando finalmente en el centro de procesamiento visual en el mesencéfalo dorsal. Esta estructura se denomina tectum óptico en peces y otros vertebrados no mamíferos y es homóloga al colículo superior en mamíferos3.
El tectum óptico es una estructura multicapa bilateralmente simétrica en el mesencéfalo dorsal. En el pez cebra y la mayoría de los otros peces, cada lóbulo del tectum óptico recibe información visual únicamente del ojo contralateral, de modo que el nervio óptico izquierdo termina en el lóbulo tectal derecho y el nervio óptico derecho termina en el lóbulo tecttal izquierdo4 (Figura 1). Al igual que su contraparte en mamíferos, el colículo superior, el tectum óptico integra la información visual con otras entradas sensoriales, incluyendo la audición y la somatosensación, controlando los cambios en la atención visual y los movimientos oculares como las sacadas 1,5,6. Sin embargo, a diferencia del colículo superior de los mamíferos, el tectum óptico genera continuamente nuevas neuronas y glía a partir de un nicho especializado de células madre cerca de los bordes medial y caudal de los lóbulos tectales llamado zona de proliferacióntectal 7. El mantenimiento de progenitores proliferativos en el tectum óptico y otras regiones del sistema nervioso central contribuye, en parte, a la notable capacidad regenerativa documentada en el pez cebra8.
Trabajos previos que examinaron los cerebros de peces ciegos o tuertos revelaron que el tamaño del tectum óptico es directamente proporcional a la cantidad de inervación retiniana que recibe 9,10,11. En los peces de cueva adultos, cuyos ojos degeneran en la embriogénesis temprana, el tectum óptico es notablemente más pequeño que el de los peces de superficie avistados estrechamente relacionados9. La degeneración del ojo de pez de cueva se puede bloquear reemplazando la lente endógena con una lente de un pez de superficie durante la embriogénesis. Cuando estos peces de cueva tuertos se crían hasta la edad adulta, el lóbulo tectal inervado contiene aproximadamente un 10% más de células que el lóbulo tectal no inervado9. Del mismo modo, en los killifish larvales que fueron incubados con tratamientos químicos para generar ojos de diferentes tamaños dentro del mismo individuo, el lado del tectum con más inervación era más grande y contenía más neuronas10. La evidencia de los experimentos de aplastamiento del nervio óptico en peces de colores adultos indica que la inervación promueve la proliferación, con la proliferación de células tectales disminuyendo cuando se interrumpió la inervación11.
Confirmando y extendiendo estos estudios clásicos, varios informes recientes proporcionan datos que sugieren que la proliferación en respuesta a la inervación está modulada, al menos en parte, por la vía BDNF-TrkB12,13. Quedan muchas preguntas abiertas sobre el crecimiento y desarrollo del tectum óptico, incluida la forma en que un sistema sensorial en desarrollo hace frente a las lesiones y la degeneración del axón, qué señales celulares y moleculares permiten que la entrada de la retina regule el crecimiento del tectum óptico, cuándo estos mecanismos se activan y si la proliferación y la diferenciación vinculadas a la inervación permiten que la retina y su tejido objetivo coordinen las tasas de crecimiento y garanticen un mapeo retinotópico preciso. Además, hay preguntas mucho más grandes sobre el desarrollo dependiente de la actividad que se pueden abordar interrogando el sistema visual del pez cebra con enfoques quirúrgicos como el que se describe a continuación.
Para investigar los mecanismos celulares y moleculares por los cuales la actividad neuronal, específicamente a partir de la entrada visual, altera la supervivencia y proliferación celular, el enfoque descrito compara directamente los lóbulos tectales inervados y denervados (Figura 1) dentro de larvas individuales de pez cebra. Este método permite la documentación de la degeneración del axón RGC en el tectum óptico y la confirmación de que el número de células mitóticas se correlaciona con la inervación.
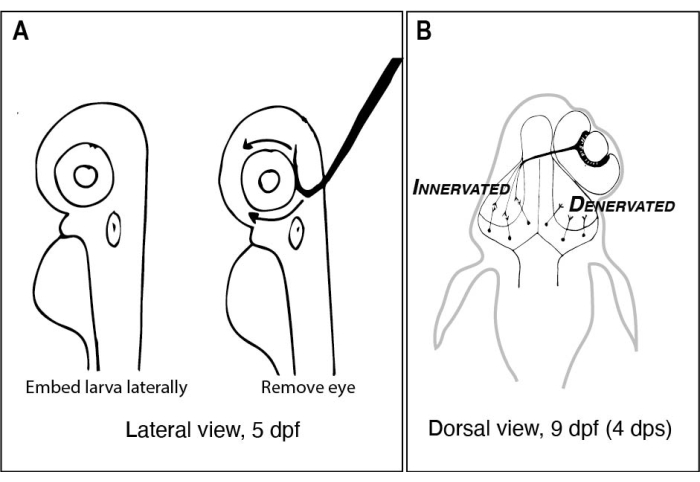
Figura 1: Bocetos de larvas de pez cebra antes y después de la extracción unilateral del ojo. (A) Dibujo de larvas de 5 dpf vistas bajo un microscopio de disección. Cada larva está incrustada en agarosa de bajo punto de fusión y orientada lateralmente antes de que se use una aguja de tungsteno con una punta afilada y enganchada para sacar el ojo hacia arriba (ojo izquierdo en este ejemplo). (B) Dibujo de la vista dorsal de una larva de 9 dpf resultante de la cirugía representada en A. Solo tres axones RGC altamente esquematizados del ojo derecho se muestran desfasciculando y conectando con neuronas en el lóbulo tectal izquierdo. Abreviaturas: dpf = días después de la fertilización; dps = días después de la cirugía; RGC = células ganglionares de la retina. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
Las técnicas descritas en este artículo ilustran uno de los muchos enfoques para estudiar el desarrollo del sistema visual de vertebrados en el pez cebra. Otros investigadores han publicado métodos para diseccionar la retina embrionaria y realizar análisis de expresión génica19 o visualizar la actividad neuronal en el tectum óptico30. Este artículo proporciona un enfoque para explorar cómo la entrada diferencial de la retina puede influir en los comportamientos cel…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
El financiamiento para este trabajo fue apoyado principalmente por fondos de inicio de Reed College a KLC, fondos de Helen Stafford Research Fellowship a OLH y una beca de investigación científica de Reed College a YK. Este proyecto comenzó en el laboratorio de Steve Wilson como una colaboración con Recursos Humanos, quien fue apoyado por un Wellcome Trust Studentship (2009-2014). Agradecemos a Máté Varga, Steve Wilson y otros miembros del laboratorio Wilson por las discusiones iniciales sobre este proyecto, y agradecemos especialmente a Florencia Cavodeassi y Kate Edwards, quienes fueron las primeras en enseñar a KLC cómo montar embriones en agarosa y realizar disecciones cerebrales de pez cebra. También agradecemos a Greta Glover y Jay Ewing por su ayuda con el montaje de nuestro dispositivo de afilado con aguja de tungsteno.
Materials
| Equipment and supplies: | |||
| Breeding boxes | Aquaneering | ZHCT100 | |
| Dow Corning high vacuum grease | Sigma or equivalent supplier | Z273554 | |
| Erlenmeyer flasks (125 mL) | For making Marc's Modified Ringers (MMR) with antibiotics for post-surgery incubation | ||
| Fine forceps – Dumont #5 | Fine Science Tools (FST) | 11252-20 | |
| Glass Pasteur pipettes | DWK Lifescience | 63A53 & 63A53WT | For pipetting embryos and larvae |
| Glass slides for microscopy | VWR or equivalent supplier | 48311-703 | Standard glass microscope slides can be ordered from many different laboratory suppliers. |
| Glassware including graduated bottles and graduated cylinders | For making and storing solutions | ||
| 2-part epoxy resin | ACE Hardware or other equivalent supplier of Gorilla Glue or equivalent | 0.85 oz syringe | https://www.acehardware.com/departments/paint-and-supplies/tape-glues-and-adhesives/glues-and-epoxy/1590793 |
| Microcentrifuge tube (1.7 mL) | VWR or equivalent supplier | 22234-046 | |
| Nickel plated pin holder (17 cm length) | Fine Science Tools (FST) | 26018-17 | To hold tungsten wire while sharpening and performing surgeries/dissections. |
| Nylon mesh tea strainer or equivalent | Ali Express or equivalent | For harvesting zebrafish eggs after spawning; https://www.aliexpress.com/item/1005002219569756.html | |
| Paper clip | For Tungsten needle sharpening device. | ||
| Petri dishes 100 mm | Fischer Scientific or equivalent supplier | 50-190-0267 | |
| Petri dishes 35 mm | Fischer Scientific or equivalent supplier | 08-757-100A | |
| Pipette pump | SP Bel-Art or equivalent | F37898-0000 | |
| Potassium hydroxide (KOH) | Sigma | 909122 | For Tungsten needle sharpening device. Make a 10% w/v solution of KOH in the hood by adding pellets to deionized water. |
| Power supply (variable voltage) | For Tungsten needle sharpening device. Any power supply with variable voltage will work (even one used for gel electrophoresis). | ||
| Sylgard 184 Elastomer kit | Dow Corning | 3097358 | |
| Tungsten wire (0.125 mm diameter) | World Precision Instruments (WPI) | TGW0515 | Sharpen to remove eye and dissect larvae. |
| Variable temperature heat block | The Lab Depot or equivalent supplier | BSH1001 or BSH1002 | Set to 40-42 °C ahead of experiments. |
| Wide-mouth glass jar with lid (e.g., clean jam or salsa jar) | For Tungsten needle sharpening device. | ||
| Wires with alligator clip leads | For Tungsten needle sharpening device. | ||
| Microscopes: | |||
| Dissecting microscope | Any type will work but having adjustable transmitted light on a mirrored base is preferred. | ||
| Laser scanning confocal microscope | High NA, 20-25x water dipping objective lens is recommended. Microscope control and image capture software (Elements) is used here but any confocal microscope will work. |
||
| Reagents for surgeries and dissections: | |||
| Calcium chloride dihydrate | Sigma | C7902 | For Marc's Modified Ringers (MMR) and embryo medium (E3). |
| HEPES | Sigma | H7006 | For Marc's Modified Ringers (MMR). |
| Low melting point agarose | Invitrogen | 16520-050 | Make 1% in embryo medium (E3) or Marc's Modified Ringers (MMR). |
| Magnesium chloride hexahydrate | Sigma | 1374248 | For embryo medium (E3). |
| Magnesium sulfate | Sigma | M7506 | For Marc's Modified Ringers (MMR). |
| Paraformaldehyde | Electron Microscopy Sciences | 19210 | Dilute 8% (w/v) stock with 2x concentrated PBS (diluted from 10x PBS stock). |
| Penicillin/Streptomycin | Sigma | P4333-20ML | Dilute 1:100 in Marc's Modified Ringers. |
| Phosphate buffered saline (PBS) tablets | Diagnostic BioSystems | DMR E404-01 | Make 10x stock in deionized water, autoclave and store at room temperature. Dilute to 1x working concentration. |
| Potassium chloride | Sigma | P3911 | For Marc's Modified Ringers (MMR) and embryo medium (E3). |
| Sodium chloride | Sigma | S9888 | For Marc's Modified Ringers (MMR) and embryo medium (E3). |
| Sodium hydroxide | Sigma | S5881 | Make 10 M and use to adjust pH of MMR to 7.4. |
| Sucrose | Sigma | S9378 | |
| Tricaine-S | Pentair | 100G #TRS1 | Recipe: https://zfin.atlassian.net/wiki/spaces/prot/pages/362220023/TRICAINE |
| Reagents for immunohistochemistry: | |||
| Alexafluor 568 tagged Secondary antibody to detect rabbit IgG | Invitrogen | A-11011 | Use at 1:500 dilution for wholemount immunohistochemistry. |
| DAPI or ToPro3 | Invitrogen | 1306 or T3605 | Make up 1 mg/mL solutions in DMSO; 1:5,000 dilution for counterstaining. |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418 | A component of immunoblock buffer. |
| Methanol (MeOH) | Sigma | 34860 | Mixing MeOH with aqueous solutions like PBST is exothermic. Make the MeOH/PBST solutions at least several hours ahead of time or cool them on ice before using. |
| Normal goat serum | ThermoFisher Scientific | 50-062Z | A component of immunoblock buffer. Can be aliquoted in 1-10 mL volumes and stored at -20 °C. |
| Primary antibody to detect phosphohistone H3 | Millipore | 06-570 | Use at 1:300 dilution for wholemount immunohistochemistry. |
| Primary antibody to detect Red Fluorescent Protein (RFP; detects dsRed derivatives) | MBL International | PM005 | Use at 1:500 dilution for wholemount immunohistochemistry. |
| Proteinase K (PK) | Sigma | P2308-10MG | Make up 10 mg/mL stock solutions in PBS and use at 10 µg/mL. |
| Triton X-100 | Sigma | T8787 | Useful to make a 20% (v/v) stock solution in PBS. |
| Software for data analysis | |||
| ImageJ (Fiji) | freeware for image analysis; https://imagej.net/software/fiji/ | ||
| Rstudio | freeware for statistical analysis and data visualization; https://www.rstudio.com/products/rstudio/download/ | ||
| Adobe Photoshop or GIMP | Proprietary image processing software (Adobe Photoshop and Illustrator) are often used to compose figures). A freeware alternative is Gnu Image Manipulation Program (GIMP; https://www.gimp.org/) | ||
| Zebrafish strains | available from the Zebrafish International Resource Centers in the US (https://zebrafish.org/home/guide.php) or in Europe (https://www.ezrc.kit.edu/). Specialized transgenic strains that have not yet been deposited in either resource center can be requested from individual labs after publication. |
Riferimenti
- Butler, A. B., Hodos, W. Optic tectum. Comparative Vertebrate Neuroanatomy: Evolution and Adaptation. , 311-340 (2005).
- Cang, J., Feldheim, D. A. Developmental mechanisms of topographic map formation and alignment. Annual Review of Neuroscience. 36 (1), 51-77 (2013).
- Basso, M. A., Bickford, M. E., Cang, J. Unraveling circuits of visual perception and cognition through the superior colliculus. Neuron. 109 (6), 918-937 (2021).
- Burrill, J. D., Easter, S. S. Development of the retinofugal projections in the embryonic and larval zebrafish (Brachydanio rerio). The Journal of Comparative Neurology. 346 (4), 583-600 (1994).
- Regeneration in the goldfish visual system. Webvision: The Organization of the Retina and Visual System Available from: https://webvision.med.utah.edu/book/part-x-repair-and-regeneration-in-the-visual-system/regeneration-in-the-goldfish-visual-system/ (2021)
- Regeneration in the visual system of adult mammals. Webvision: The Organization of the Retina and Visual System Available from: https://webvision.med.utah.edu/book/part-x-repair-and-regeneration-in-the-visual-system/regeneration-in-the-visual-system-of-adult-mammals/ (2021)
- Cerveny, K. L., Varga, M., Wilson, S. W. Continued growth and circuit building in the anamniote visual system. Developmental Neurobiology. 72 (3), 328-345 (2012).
- Lindsey, B. W., et al. Midbrain tectal stem cells display diverse regenerative capacities in zebrafish. Scientific Reports. 9 (1), 4420 (2019).
- Soares, D., Yamamoto, Y., Strickler, A. G., Jeffery, W. R. The lens has a specific influence on optic nerve and tectum development in the blind cavefish Astyanax. Developmental Neuroscience. 26 (5-6), 308-317 (2004).
- White, E. L. An experimental study of the relationship between the size of the eye and the size of the optic tectum in the brain of the developing teleost, Fundulus heteroclitus. Journal of Experimental Zoology. 108 (3), 439-469 (1948).
- Raymond, P., Easter, S., Burnham, J., Powers, M. Postembryonic growth of the optic tectum in goldfish. II. Modulation of cell proliferation by retinal fiber input. The Journal of Neuroscience. 3 (5), 1092-1099 (1983).
- Sato, Y., Yano, H., Shimizu, Y., Tanaka, H., Ohshima, T. Optic nerve input-dependent regulation of neural stem cell proliferation in the optic tectum of adult zebrafish. Developmental Neurobiology. 77 (4), 474-482 (2017).
- Hall, Z. J., Tropepe, V. Visual experience facilitates BDNF-dependent adaptive recruitment of new neurons in the postembryonic optic tectum. The Journal of Neuroscience. 38 (8), 2000-2014 (2018).
- Nusslein-Volhard, C., Dahm, R. . Zebrafish. , (2002).
- Cold Spring Harbor Protocols. Marc’s modified Ringer’s (MMR) (10X, pH 7.4). Cold Spring Harbor Protocols. , (2009).
- Turner, K. J., Bracewell, T. G., Hawkins, T. A. Anatomical dissection of zebrafish brain development. Brain Development. 1082, 197-214 (2014).
- Brady, J. A simple technique for making very fine, durable dissecting needles by sharpening tungsten wire electrolytically. Bulletin of the World Health Organization. 32 (1), 143-144 (1965).
- . ZFIN Tricaine recipe Available from: https://zfin.atlassian.net/wiki/spaces/prot/pages/362220023/TRICAINE (2018)
- Zhang, L., Leung, Y. F. Microdissection of zebrafish embryonic eye tissues. Journal of Visualized Experiments: JoVE. (40), e2028 (2010).
- . ZFIN protocols Available from: https://zfin.atlassian.net/wiki/spaces/prot/overview (2021)
- Engerer, P., Plucinska, G., Thong, R., Trovò, L., Paquet, D., Godinho, L. Imaging subcellular structures in the living zebrafish embryo. Journal of Visualized Experiments: JoVE. (110), e53456 (2016).
- ImageJ with batteries included. Fiji Available from: https://figi.sc/ (2021)
- O’Brien, J., Hayder, H., Peng, C. Automated quantification and analysis of cell counting procedures using ImageJ plugins. Journal of Visualized Experiments: JoVE. (117), e54719 (2016).
- Poggi, L., Vitorino, M., Masai, I., Harris, W. A. Influences on neural lineage and mode of division in the zebrafish retina in vivo. The Journal of Cell Biology. 171 (6), 991-999 (2005).
- Karlstrom, R. O., et al. Zebrafish mutations affecting retinotectal axon pathfinding. Development. 123 (1), 427-438 (1996).
- Harvey, B. M., Baxter, M., Granato, M. Optic nerve regeneration in larval zebrafish exhibits spontaneous capacity for retinotopic but not tectum specific axon targeting. PLOS ONE. 14 (6), 0218667 (2019).
- Robles, E., Filosa, A., Baier, H. Precise lamination of retinal axons generates multiple parallel input pathways in the tectum. Journal of Neuroscience. 33 (11), 5027-5039 (2013).
- Vargas, M. E., Barres, B. A. Why Is Wallerian degeneration in the CNS so slow. Annual Review of Neuroscience. 30 (1), 153-179 (2007).
- Hughes, A. N., Appel, B. Microglia phagocytose myelin sheaths to modify developmental myelination. Nature Neuroscience. 23 (9), 1055-1066 (2020).
- de Calbiac, H., Dabacan, A., Muresan, R., Kabashi, E., Ciura, S. Behavioral and physiological analysis in a zebrafish model of epilepsy. Journal of Visualized Experiments: JoVE. (176), e58837 (2021).
- Adams, S. L., Zhang, T., Rawson, D. M. The effect of external medium composition on membrane water permeability of zebrafish (Danio rerio) embryos. Theriogenology. 64 (7), 1591-1602 (2005).
- Fredj, N. B., et al. Synaptic activity and activity-dependent competition regulates axon arbor maturation, growth arrest, and territory in the retinotectal projection. Journal of Neuroscience. 30 (32), 10939-10951 (2010).
- Alberio, L., et al. A light-gated potassium channel for sustained neuronal inhibition. Nature Methods. 15 (11), 969-976 (2018).
- Kay, J. N., Finger-Baier, K. C., Roeser, T., Staub, W., Baier, H. Retinal ganglion cell genesis requires lakritz, a zebrafish atonal homolog. Neuron. 30 (3), 725-736 (2001).
- Gnuegge, L., Schmid, S., Neuhauss, S. C. F. Analysis of the activity-deprived zebrafish mutant macho reveals an essential requirement of neuronal activity for the development of a fine-grained visuotopic map. The Journal of Neuroscience. 21 (10), 3542-3548 (2001).
- Jeffery, W. R. Astyanax surface and cave fish morphs. EvoDevo. 11 (1), 14 (2020).
- Sieger, D., Peri, F. Animal models for studying microglia: The first, the popular, and the new. Glia. 61 (1), 3-9 (2013).
- Svahn, A. J., et al. Development of ramified microglia from early macrophages in the zebrafish optic tectum. Developmental Neurobiology. 73 (1), 60-71 (2013).
- Herzog, C., et al. Rapid clearance of cellular debris by microglia limits secondary neuronal cell death after brain injury in vivo. Development. 146 (9), (2019).
- Chen, J., Poskanzer, K. E., Freeman, M. R., Monk, K. R. Live-imaging of astrocyte morphogenesis and function in zebrafish neural circuits. Nature Neuroscience. 23 (10), 1297-1306 (2020).

