설치류에서 생체 내 및 생체 외 전기 임피던스 근전도 수행
Summary
이 기사에서는 설치류 비복근 근육에서 생체 내 (표면 및 바늘 전극 어레이 사용) 및 생체 외 (유전체 셀 사용) 전기 임피던스 근조영술을 수행하는 방법에 대해 자세히 설명합니다. 생쥐와 쥐 모두에서 기술을 시연하고 사용 가능한 수정 (즉, 비만 동물, 새끼)을 자세히 설명합니다.
Abstract
전기 임피던스 근조영술(EIM)은 근육 조직 건강 및 질병을 평가하기 위해 전임상 및 임상 연구에 사용할 수 있는 편리한 기술입니다. EIM은 주파수 범위(즉, 1kHz에서 10MHz)에 걸쳐 관심 근육에 저강도의 방향성 초점이 맞춰진 전류를 적용하고 결과 전압을 기록함으로써 얻어집니다. 이들로부터 리액턴스, 저항 및 위상을 포함한 몇 가지 표준 임피던스 성분이 얻어집니다. 절제된 근육에 대한 생체 외 측정을 수행할 때 조직의 고유한 수동 전기적 특성, 즉 전도도 및 상대 유전율도 계산할 수 있습니다. EIM은 동물과 인간에서 다양한 질병의 근육 변화를 진단하고 추적하기 위해, 단순한 사용 불용 위축과 관련하여, 또는 치료 적 개입의 척도로 광범위하게 사용되었습니다. 임상적으로 EIM은 시간 경과에 따른 질병 진행을 추적하고 치료적 개입의 영향을 평가할 수 있는 잠재력을 제공하여 임상 시험 기간을 단축하고 표본 크기 요구 사항을 줄일 수 있는 기회를 제공합니다. EIM은 인간뿐만 아니라 살아있는 동물 모델에서 비침습적 또는 최소 침습적으로 수행할 수 있기 때문에 전임상 및 임상 개발을 모두 가능하게 하는 새로운 번역 도구 역할을 할 수 있는 잠재력을 제공합니다. 이 문서에서는 강아지 또는 비만 동물에 사용하기 위한 것과 같은 특정 조건에 기술을 적용하는 접근 방식을 포함하여 생쥐와 쥐에서 생체 내 및 생체 외 EIM 측정을 수행하는 방법에 대한 단계별 지침을 제공합니다.
Introduction
전기 임피던스 근조영술(EIM)은 근육 상태를 평가하는 강력한 방법을 제공하여 잠재적으로 신경근 장애 진단, 질병 진행 추적 및 치료 1,2,3에 대한 반응 평가를 가능하게 합니다. 동물 질병 모델 및 인간과 유사하게 적용될 수 있어 전임상에서 임상 연구로 비교적 원활하게 번역할 수 있습니다. EIM 측정은 선형으로 배치 된 4 개의 전극을 사용하여 쉽게 얻을 수 있으며, 2 개의 외부 전극은 주파수 범위 (일반적으로 1kHz에서 약 2MHz 사이)에 걸쳐 고통없고 약한 전류를 적용하고 2 개의 내부 전극은 결과 전압을 기록합니다1. 이러한 전압으로부터, 저항(R), 전류가 조직을 통과하는 것이 얼마나 어려운지에 대한 척도, 조직의 리액턴스(X) 또는 “전하성”을 포함한 조직의 임피던스 특성을 얻을 수 있다. 리액턴스와 저항으로부터 위상각(θ)은 다음 방정식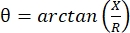 을 통해 계산됩니다. , 단일 합계 임피던스 측정값을 제공합니다. 이러한 측정은 임의의 다중 주파수 바이오임피던스 장치를 사용하여 얻을 수 있다. 근섬유는 본질적으로 긴 실린더이기 때문에 근육 조직도 매우 이방성이며 전류가 섬유를 가로지르는 것보다 섬유를 따라 더 쉽게 흐릅니다4,5. 따라서 EIM은 종종 두 가지 방향으로 수행됩니다 : 전류가 섬유와 평행하게 흐르도록 섬유를 따라 배열을 배치하고 전류가 수직으로 흐르도록 근육을 가로 질러 배치됩니다. 또한, 임피던스 측정 셀에서 알려진 부피의 조직이 측정되는 생체 외 측정에서 근육의 고유 한 전기적 특성 (즉, 전도도 및 상대 유전율)을 도출 할 수 있습니다6.
을 통해 계산됩니다. , 단일 합계 임피던스 측정값을 제공합니다. 이러한 측정은 임의의 다중 주파수 바이오임피던스 장치를 사용하여 얻을 수 있다. 근섬유는 본질적으로 긴 실린더이기 때문에 근육 조직도 매우 이방성이며 전류가 섬유를 가로지르는 것보다 섬유를 따라 더 쉽게 흐릅니다4,5. 따라서 EIM은 종종 두 가지 방향으로 수행됩니다 : 전류가 섬유와 평행하게 흐르도록 섬유를 따라 배열을 배치하고 전류가 수직으로 흐르도록 근육을 가로 질러 배치됩니다. 또한, 임피던스 측정 셀에서 알려진 부피의 조직이 측정되는 생체 외 측정에서 근육의 고유 한 전기적 특성 (즉, 전도도 및 상대 유전율)을 도출 할 수 있습니다6.
“신경근 장애”라는 용어는 구조적 근육 변화 및 기능 장애를 유발하는 광범위한 1 차 및 2 차 질환을 정의합니다. 여기에는 근 위축성 측삭 경화증 및 다양한 형태의 근이영양증뿐만 아니라 노화 (예 : 근육 감소증), 사용 중단 위축 (예 : 장기간의 침상 안정 또는 미세 중력으로 인한) 또는 부상과 관련된 단순한 변화가 포함됩니다7. 원인은 풍부하고 운동 뉴런, 신경, 신경근 접합부 또는 근육 자체에서 비롯될 수 있지만 EIM은 이러한 많은 과정으로 인한 근육의 조기 변화를 감지하고 치료에 대한 진행 또는 반응을 추적하는 데 사용할 수 있습니다. 예를 들어, 뒤셴 근이영양증(DMD) 환자에서 EIM은 질병 진행 및 코르티코스테로이드에 대한 반응을 감지하는 것으로나타났습니다8. 최근 연구에 따르면 EIM은 달이나 화성에서 경험할 수있는 분수 중력9과 노화10,11의 영향을 포함한 다양한 사용 중단 상태에 민감합니다. 마지막으로, 각 측정으로 얻은 데이터 세트(다중 주파수 및 방향 의존적 데이터)에 예측 및 기계 학습 알고리즘을 적용함으로써 근섬유 크기 12,13, 염증 변화 및 부종 14, 결합 조직 및 지방 함량 15,16을 포함한 조직의 조직학적 측면을 추론할 수 있게 됩니다.
바늘 근전도17 및 자기 공명 영상, 컴퓨터 단층 촬영 및 초음파18,19와 같은 영상 기술을 포함하여 인간 및 동물의 근육 건강을 평가하기 위해 몇 가지 다른 비침습적 또는 최소 침습적 방법도 사용됩니다. 그러나 EIM은 이러한 기술에 비해 뚜렷한 이점을 보여줍니다. 예를 들어, 근전도 검사는 근섬유 막의 활성 전기적 특성만 기록하고 수동 특성은 기록하지 않으므로 근육 구성이나 구조에 대한 진정한 평가를 제공할 수 없습니다. 특정 측면에서 이미징 방법은 조직의 구조와 구성에 대한 정보를 제공하기 때문에 EIM과 더 밀접한 관련이 있습니다. 그러나 어떤 의미에서는 너무 많은 데이터를 제공하므로 정량적 출력을 제공하는 것이 아니라 상세한 이미지 분할 및 전문가 분석이 필요합니다. 또한 복잡성을 감안할 때 이미징 기술은 사용되는 하드웨어와 소프트웨어의 특성에 크게 영향을 받으며 이상적으로는 데이터 세트를 비교할 수 있도록 동일한 시스템을 사용해야 합니다. 반대로 EIM이 훨씬 간단하다는 사실은 이러한 기술적 문제의 영향을 덜 받고 어떤 형태의 이미지 처리나 전문가 분석도 필요하지 않다는 것을 의미합니다.
다음 프로토콜은 새로 절제된 근육에 대한 생체 외 EIM뿐만 아니라 비침습적(표면 어레이) 및 최소 침습적(피하 바늘 배열) 기술을 모두 사용하여 쥐와 마우스에서 생체 내 EIM을 수행하는 방법을 보여줍니다.
Protocol
Representative Results
Discussion
이 기사에서는 생체 내 및 생체 외 설치류에서 EIM을 수행하는 기본 방법을 제공합니다. 신뢰할 수 있는 측정값을 얻으려면 일련의 단계를 수행하는 것이 중요합니다. 첫째, 각 근육이 질병, 치료 및 병리에 대해 서로 다른 반응을 보이기 때문에 관심있는 근육을 적절하게 식별해야합니다. 한 근육 (예 : 비복근)에서 획득 한 데이터는 다른 근육 (예 : 전방 경골)과 동일한 정보를 제공하…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
이 작업은 Charley ‘s Fund와 NIH R01NS055099의 지원을 받았습니다.
Materials
| 3D Printer | Formlabs Inc. | Form 2 Desktop | 3D printer |
| 3D Printer | Shenzhen Creality 3D Technology Co. LTD | Creality Ender 3 V2 | 3D printer |
| 3M Micropore surgical tape | Fisher | 19-027761 and 19-061655 | models 1530-0 and 1530-1 |
| 3M TRANSPORE surgical tape | Fisher | 18-999-380 and 18-999-381 | models 1527-0 and 1527-1 |
| Connector header vertical 10 POS 1 mm spacing | Digi-Key (Sullins connector solution) | S9214-ND (SMH100-LPSE-S10-ST-BK) | Plastic spacer 1 mm holes for the rat in vivo array displayed in Figure 2A |
| Cotton-tipped applicators | Fisher | 22-363-172 | |
| Dental Wax | Fisher | NC9377103 | |
| Depilatory agent | NAIR | NA | hair remover lotion with softening baby oil |
| Dumont #7b Forceps | Fine Science Tools | No. 11270-20 | Used for dissection, Style: #7b, Tip Shape: Curved, Tips: Standard, Tip Dimensions: 0.17 mm x 0.1 mm, Alloy/Material: Inox, Length: 11 cm |
| Electronic Digital Caliper | Fisher | 14-648-17 | Used to measure out the dimensions of the Gastrocnemius muscle |
| Epoxy adhesive dual cartridge 4 min work life | Devcon | series 14265, model 2217 | Glue used in the rat in vivo array displayed in Figure 2A |
| Ex vivo dielectric impedance cell | Custom | NA | Dielectric cells were 3D printed in the Rutkove laboratory |
| Graefe Forceps | Fine Science Tools | No. 11051-10 | Used for muscle to place and adjust, Length: 10 cm, Tip Shape: Curved, Tips: Serrated, Tip Width: 0.8 mm, Tip Dimensions: 0.8 mm x 0.7 mm, Alloy/Material |
| Hair clipper | Amazon | NA | Wahl professional animal BravMini+ |
| Impedance Animal Device | Myolex | EIM1103 | mView system – investigational electrical impedance myography device for use in animal research |
| In vivo needle arrays | Custom | NA | Custom arrays using 27 G subdermal needles from Ambu. The construction was finalized using a 3D printer in the Rutkove laboratory |
| In vivo surface array | Custom | NA | The in vivo surface array was printed and assembled in the Rutkove laboratory |
| Isoflurane | Patterson Veterinary Supplies | 07-893-8441 (NDC: 46066-755-04) | Pivetal – 250 mL bottle |
| Non-woven gauze | Fisher | 22-028-559 | 2 x 2 inch |
| Polystyrene Weighing Dishes | Fisher | S67090A | Dimensions (L x W x H): 88.9 mm x 88.9 mm x 25.4 mm |
| Razor Blades | Fisher | 12-640 | Used to cut muscle to right dimensions, Single-edge carbon steel blades |
| Student Fine Scissors | Fine Science Tools | No. 91460-11 | Used for dissection, Tips: Sharp-Sharp, Alloy/Material: Student Stainless Steel, Serrated: No, Tip Shape: Straight, Cutting Edge: 20 mm, Length: 11.5 cm, Feature: Student Quality |
| Subdermal needles 27 G Neuroline | Ambu | 745 12-50/24 | Needles used in the rat in vivo array displayed in Figure 2A |
| Surgical Scissors – Sharp | Fine Science Tools | No. 14002-13 | Used to cut skin, Tips: Sharp-Sharp, Alloy/Material: Stainless Steel, Serrated: No, Tip Shape: Straight, Cutting Edge: 42 mm, Length: 13 cm |
| TECA ELITE monopolar needle electrodes | Natus | 902-DMG50-S | 0.46 mm diameter (26 G). Blue hub |
| Teknova 0.9% saline solution | Fisher | S5815 | 1000 mL sterile |
Riferimenti
- Rutkove, S. B., Sanchez, B. Electrical impedance methods in neuromuscular assessment: An overview. Cold Spring Harbor Perspectives in Medicine. 9 (10), 034405 (2019).
- Rutkove, S. B. Electrical impedance myography: Background, Current State, and Future Directions. Muscle & Nerve. 40, 936-946 (2009).
- Sanchez, B., Rutkove, S. B. Present uses, future applications, and technical underpinnings of electrical impedance myography. Current Neurology and Neuroscience Reports. 17 (11), 86 (2017).
- Garmirian, L. P., Chin, A. B., Rutkove, S. B. Discriminating neurogenic from myopathic disease via measurement of muscle anisotropy. Muscle & Nerve. 39 (1), 16-24 (2009).
- Rutkove, S. B., et al. Loss of electrical anisotropy is an unrecognized feature of dystrophic muscle that may serve as a convenient index of disease status. Clinical Neurophysiology. 127 (12), 3546-3551 (2016).
- Wang, L. L., et al. Assessment of alterations in the electrical impedance of muscle after experimental nerve injury via finite-element analysis. IEEE Transactions on Biomedical Engineering. 58 (6), 1585-1591 (2011).
- Katirji, B., Ruff, R. L., Kaminski, H. J. . Neuromuscular Disorders in Clinical Practice. , (2014).
- Rutkove, S. B., et al. Electrical impedance myography for assessment of Duchenne muscular dystrophy. Annals of Neurology. 81 (5), 622-632 (2017).
- Semple, C., et al. Using electrical impedance myography as a biomarker of muscle deconditioning in rats exposed to micro- and partial-gravity analogs. Frontiers in Physiology. 11, 557796 (2020).
- Kortman, H. G. J., Wilder, S. C., Geisbush, T. R., Narayanaswami, P., Rutkove, S. B. Age- and gender-associated differences in electrical impedance values of skeletal muscle. Physiological Measurement. 34 (12), 1611-1622 (2013).
- Clark, B. C., Rutkove, S., Lupton, E. C., Padilla, C. J., Arnold, W. D. Potential utility of electrical impedance myography in evaluating age-related skeletal muscle function deficits. Frontiers in Physiology. 12, 666964 (2021).
- Kapur, K., et al. Predicting myofiber size with electrical impedance myography: A study in immature mice. Muscle and Nerve. 58 (1), 106-113 (2018).
- Kapur, K., Nagy, J. A., Taylor, R. S., Sanchez, B., Rutkove, S. B. Estimating myofiber size with electrical impedance myography: a study in amyotrophic lateral sclerosis mice. Muscle and Nerve. 58 (5), 713-717 (2018).
- Mortreux, M., Semple, C., Riveros, D., Nagy, J. A., Rutkove, S. B. Electrical impedance myography for the detection of muscle inflammation induced by λ-carrageenan. PLoS ONE. 14 (10), 0223265 (2019).
- Pandeya, S. R., et al. Predicting myofiber cross-sectional area and triglyceride content with electrical impedance myography: A study in db/db mice. Muscle and Nerve. 63 (1), 127-140 (2021).
- Pandeya, S. R., et al. Estimating myofiber cross-sectional area and connective tissue deposition with electrical impedance myography: A study in D2-mdx mice. Muscle & Nerve. 63 (6), 941-950 (2021).
- Stålberg, E., et al. Standards for quantification of EMG and neurography. Clinical Neurophysiology. 130 (9), 1688-1729 (2019).
- Theodorou, D. J., Theodorou, S. J., Kakitsubata, Y. Skeletal muscle disease: Patterns of MRI appearances. British Journal of Radiology. 85 (1020), 1298-1308 (2012).
- Simon, N. G., Noto, Y., Zaidman, C. M. Skeletal muscle imaging in neuromuscular disease. Journal of Clinical Neuroscience. 33, 1-10 (2016).
- Kwon, H., Rutkove, S. B., Sanchez, B. Recording characteristics of electrical impedance myography needle electrodes. Physiological Measurement. 38 (9), 1748-1765 (2017).
- Kwon, H., Di Cristina, J. F., Rutkove, S. B., Sanchez, B. Recording characteristics of electrical impedance-electromyography needle electrodes. Physiological Measurement. 39 (5), 055005 (2018).
- Rutkove, S. B., et al. Characterizing spinal muscular atrophy with electrical impedance myography. Muscle and Nerve. 42 (6), 915-921 (2010).
- Schwartz, S., et al. Optimizing electrical impedance myography measurements by using a multifrequency ratio: A study in Duchenne muscular dystrophy. Clinical Neurophysiology. 126 (1), 202-208 (2015).
- Li, J., Pacheck, A., Sanchez, B., Rutkove, S. B. Single and modeled multifrequency electrical impedance myography parameters and their relationship to force production in the ALS SOD1G93A mouse. Amyotrophic Lateral Sclerosis and Frontotemporal Degeneration. 17 (5-6), 397-403 (2016).
- Hu, N., et al. Antisense oligonucleotide and adjuvant exercise therapy reverse fatigue in old mice with myotonic dystrophy. Molecular Therapy – Nucleic Acids. 23, 393-405 (2021).
- Sanchez, B., et al. Non-invasive assessment of muscle injury in healthy and dystrophic animals with electrical impedance myography. Muscle & Nerve. 56 (6), 85-94 (2017).
- Sanchez, B., Li, J., Bragos, R., Rutkove, S. B. Differentiation of the intracellular structure of slow- versus fast-twitch muscle fibers through evaluation of the dielectric properties of tissue. Physics in Medicine and Biology. 59 (10), 2369-2380 (2014).
- Shefner, J. M., et al. Assessing ALS progression with a dedicated electrical impedance myography system. Amyotrophic Lateral Sclerosis & Frontotemporal Degeneration. 19 (7-8), 555-561 (2018).
- Lungu, C., et al. Quantifying muscle asymmetries in cervical dystonia with electrical impedance: a preliminary assessment. Clinical Neurophysiology. 122 (5), 1027-1031 (2011).
- Wang, Y., et al. Electrical impedance myography for assessing paraspinal muscles of patients with low back pain. Journal of Electrical Bioimpedance. 10 (1), 103-109 (2019).
- Leitner, M. L., et al. Electrical impedance myography for reducing sample size in Duchenne muscular dystrophy trials. Annals of Clinical and Translational Neurology. 7 (1), 4-14 (2020).
- Rutkove, S. B., et al. Improved ALS clinical trials through frequent at-home self-assessment: a proof of concept study. Annals of Clinical and Translational Neurology. 7 (7), 1148-1157 (2020).

