Выполнение in vivo и ex vivo электроимпедансной миографии у грызунов
Summary
В этой статье подробно описано, как выполнить in vivo (с использованием поверхностных и игольчатых электродных массивов) и ex vivo (с использованием диэлектрической ячейки) электроимпедансную миографию на икроножной мышце грызунов. Он продемонстрирует технику как на мышах, так и на крысах и подробно расскажет о доступных модификациях (например, тучных животных, щенках).
Abstract
Электроимпедансная миография (EIM) является удобным методом, который может быть использован в доклинических и клинических исследованиях для оценки здоровья и заболеваний мышечной ткани. EIM получают путем приложения низкоинтенсивного, направленно сфокусированного электрического тока к интересующей мышце в диапазоне частот (т.е. от 1 кГц до 10 МГц) и регистрации результирующих напряжений. Из них получают несколько стандартных компонентов импеданса, включая реактивное сопротивление, сопротивление и фазу. При выполнении измерений ex vivo на иссеченной мышце также могут быть рассчитаны присущие ткани пассивные электрические свойства, а именно проводимость и относительная диэлектрическая проницаемость. EIM широко используется у животных и людей для диагностики и отслеживания мышечных изменений при различных заболеваниях, в связи с простой атрофией неиспользования или в качестве меры терапевтического вмешательства. Клинически EIM предлагает потенциал для отслеживания прогрессирования заболевания с течением времени и оценки воздействия терапевтических вмешательств, тем самым предлагая возможность сократить продолжительность клинических испытаний и уменьшить требования к размеру выборки. Поскольку он может быть выполнен неинвазивно или минимально инвазивно на живых животных моделях, а также на людях, EIM предлагает потенциал для использования в качестве нового трансляционного инструмента, позволяющего как доклинические, так и клинические разработки. В этой статье приведены пошаговые инструкции о том, как выполнять измерения EIM in vivo и ex vivo у мышей и крыс, включая подходы к адаптации методов к конкретным условиям, например, для использования у детенышей или животных с ожирением.
Introduction
Электроимпедансная миография (EIM) обеспечивает мощный метод оценки состояния мышц, потенциально позволяющий диагностировать нервно-мышечные расстройства, отслеживать прогрессирование заболевания и оценивать реакцию на терапию 1,2,3. Он может быть применен аналогично моделям болезней животных и людей, что позволяет относительно беспрепятственно переходить от доклинических к клиническим исследованиям. Измерения EIM легко получены с использованием четырех линейно расположенных электродов, причем два внешних применяют безболезненный, слабый электрический ток в диапазоне частот (обычно от 1 кГц до примерно 2 МГц), а два внутренних регистрируют результирующие напряжения1. Из этих напряжений можно получить импедансные характеристики ткани, включая сопротивление (R), меру того, насколько трудно току проходить через ткань, и реактивность (X) или «зарядоспособность» ткани, меру, связанную со способностью ткани хранить заряд (емкость). Из реактивности и сопротивления фазовый угол (θ) вычисляется с помощью следующего уравнения: 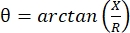 , обеспечивающего единую суммативную меру импеданса. Такие измерения могут быть получены с помощью любого многочастотного биоимпедансного устройства. Поскольку миофибры по существу являются длинными цилиндрами, мышечная ткань также очень анизотропна, причем ток протекает легче вдоль волокон, чем через них 4,5. Таким образом, EIM часто выполняется в двух направлениях: с массивом, размещенным вдоль волокон таким образом, что ток проходит параллельно им, и поперек мышцы таким, что ток течет перпендикулярно им. Кроме того, при измерениях ex vivo, где известный объем ткани измеряется в измерительной ячейке импеданса, могут быть получены присущие мышце электрические свойства (т.е. проводимость и относительная диэлектрическая проницаемость)6.
, обеспечивающего единую суммативную меру импеданса. Такие измерения могут быть получены с помощью любого многочастотного биоимпедансного устройства. Поскольку миофибры по существу являются длинными цилиндрами, мышечная ткань также очень анизотропна, причем ток протекает легче вдоль волокон, чем через них 4,5. Таким образом, EIM часто выполняется в двух направлениях: с массивом, размещенным вдоль волокон таким образом, что ток проходит параллельно им, и поперек мышцы таким, что ток течет перпендикулярно им. Кроме того, при измерениях ex vivo, где известный объем ткани измеряется в измерительной ячейке импеданса, могут быть получены присущие мышце электрические свойства (т.е. проводимость и относительная диэлектрическая проницаемость)6.
Термин «нервно-мышечные расстройства» определяет широкий спектр первичных и вторичных заболеваний, которые приводят к структурным изменениям мышц и дисфункции. Это включает в себя боковой амиотрофический склероз и различные формы мышечной дистрофии, а также более простые изменения, связанные со старением (например, саркопения), атрофию неиспользования (например, из-за длительного постельного режима или микрогравитации) или даже травму7. В то время как причины многочисленны и могут исходить от двигательного нейрона, нервов, нервно-мышечных соединений или самой мышцы, EIM может быть использован для обнаружения ранних изменений в мышцах из-за многих из этих процессов и для отслеживания прогрессирования или ответа на терапию. Например, у пациентов с мышечной дистрофией Дюшенна (МДД) было показано, что EIM обнаруживает прогрессирование заболевания и реакцию на кортикостероиды8. Недавняя работа также показала, что EIM чувствителен к различным состояниям неиспользования, включая фракционную гравитацию9, как это было бы на Луне или Марсе, и эффекты старения10,11. Наконец, применяя алгоритмы прогнозирования и машинного обучения к набору данных, полученным при каждом измерении (многочастотные и зависящие от направления данные), становится возможным вывести гистологические аспекты ткани, включая размер миофибры12,13, воспалительные изменения и отек14, а также содержание соединительной ткани и жира15,16.
Несколько других неинвазивных или минимально инвазивных методов также используются для оценки здоровья мышц у людей и животных, включая игольчатую электромиографию17 и технологии визуализации, такие как магнитно-резонансная томография, компьютерная томография и ультразвук 18,19. Тем не менее, EIM демонстрирует явные преимущества по сравнению с этими технологиями. Например, электромиография регистрирует только активные электрические свойства мембран миофибры, а не пассивные свойства, и, таким образом, не может обеспечить истинную оценку мышечного состава или структуры. В определенном отношении методы визуализации более тесно связаны с EIM, так как они также предоставляют информацию о структуре и составе ткани. Но в некотором смысле они предоставляют слишком много данных, требуя детальной сегментации изображений и экспертного анализа, а не просто предоставления количественного результата. Кроме того, учитывая их сложность, методы визуализации также в значительной степени зависят от специфики как используемого аппаратного, так и программного обеспечения, что в идеале требует использования идентичных систем для сравнения наборов данных. Напротив, тот факт, что EIM намного проще, означает, что он меньше подвержен влиянию этих технических проблем и не требует какой-либо формы обработки изображений или экспертного анализа.
Следующий протокол демонстрирует, как выполнять in vivo EIM у крыс и мышей, используя как неинвазивные (поверхностный массив), так и минимально инвазивные (подкожный игольчатый массив), а также ex vivo EIM на свежеиссеченных мышцах.
Protocol
Representative Results
Discussion
В данной статье приведены основные методы проведения EIM у грызунов, как in vivo , так и ex vivo. Для получения надежных измерений крайне важно выполнить ряд шагов. Во-первых, нужно правильно определить интересующую мышцу, так как каждая мышца будет иметь разные реакции на заболевания, …
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Эта работа была поддержана Фондом Чарли и NIH R01NS055099.
Materials
| 3D Printer | Formlabs Inc. | Form 2 Desktop | 3D printer |
| 3D Printer | Shenzhen Creality 3D Technology Co. LTD | Creality Ender 3 V2 | 3D printer |
| 3M Micropore surgical tape | Fisher | 19-027761 and 19-061655 | models 1530-0 and 1530-1 |
| 3M TRANSPORE surgical tape | Fisher | 18-999-380 and 18-999-381 | models 1527-0 and 1527-1 |
| Connector header vertical 10 POS 1 mm spacing | Digi-Key (Sullins connector solution) | S9214-ND (SMH100-LPSE-S10-ST-BK) | Plastic spacer 1 mm holes for the rat in vivo array displayed in Figure 2A |
| Cotton-tipped applicators | Fisher | 22-363-172 | |
| Dental Wax | Fisher | NC9377103 | |
| Depilatory agent | NAIR | NA | hair remover lotion with softening baby oil |
| Dumont #7b Forceps | Fine Science Tools | No. 11270-20 | Used for dissection, Style: #7b, Tip Shape: Curved, Tips: Standard, Tip Dimensions: 0.17 mm x 0.1 mm, Alloy/Material: Inox, Length: 11 cm |
| Electronic Digital Caliper | Fisher | 14-648-17 | Used to measure out the dimensions of the Gastrocnemius muscle |
| Epoxy adhesive dual cartridge 4 min work life | Devcon | series 14265, model 2217 | Glue used in the rat in vivo array displayed in Figure 2A |
| Ex vivo dielectric impedance cell | Custom | NA | Dielectric cells were 3D printed in the Rutkove laboratory |
| Graefe Forceps | Fine Science Tools | No. 11051-10 | Used for muscle to place and adjust, Length: 10 cm, Tip Shape: Curved, Tips: Serrated, Tip Width: 0.8 mm, Tip Dimensions: 0.8 mm x 0.7 mm, Alloy/Material |
| Hair clipper | Amazon | NA | Wahl professional animal BravMini+ |
| Impedance Animal Device | Myolex | EIM1103 | mView system – investigational electrical impedance myography device for use in animal research |
| In vivo needle arrays | Custom | NA | Custom arrays using 27 G subdermal needles from Ambu. The construction was finalized using a 3D printer in the Rutkove laboratory |
| In vivo surface array | Custom | NA | The in vivo surface array was printed and assembled in the Rutkove laboratory |
| Isoflurane | Patterson Veterinary Supplies | 07-893-8441 (NDC: 46066-755-04) | Pivetal – 250 mL bottle |
| Non-woven gauze | Fisher | 22-028-559 | 2 x 2 inch |
| Polystyrene Weighing Dishes | Fisher | S67090A | Dimensions (L x W x H): 88.9 mm x 88.9 mm x 25.4 mm |
| Razor Blades | Fisher | 12-640 | Used to cut muscle to right dimensions, Single-edge carbon steel blades |
| Student Fine Scissors | Fine Science Tools | No. 91460-11 | Used for dissection, Tips: Sharp-Sharp, Alloy/Material: Student Stainless Steel, Serrated: No, Tip Shape: Straight, Cutting Edge: 20 mm, Length: 11.5 cm, Feature: Student Quality |
| Subdermal needles 27 G Neuroline | Ambu | 745 12-50/24 | Needles used in the rat in vivo array displayed in Figure 2A |
| Surgical Scissors – Sharp | Fine Science Tools | No. 14002-13 | Used to cut skin, Tips: Sharp-Sharp, Alloy/Material: Stainless Steel, Serrated: No, Tip Shape: Straight, Cutting Edge: 42 mm, Length: 13 cm |
| TECA ELITE monopolar needle electrodes | Natus | 902-DMG50-S | 0.46 mm diameter (26 G). Blue hub |
| Teknova 0.9% saline solution | Fisher | S5815 | 1000 mL sterile |
Riferimenti
- Rutkove, S. B., Sanchez, B. Electrical impedance methods in neuromuscular assessment: An overview. Cold Spring Harbor Perspectives in Medicine. 9 (10), 034405 (2019).
- Rutkove, S. B. Electrical impedance myography: Background, Current State, and Future Directions. Muscle & Nerve. 40, 936-946 (2009).
- Sanchez, B., Rutkove, S. B. Present uses, future applications, and technical underpinnings of electrical impedance myography. Current Neurology and Neuroscience Reports. 17 (11), 86 (2017).
- Garmirian, L. P., Chin, A. B., Rutkove, S. B. Discriminating neurogenic from myopathic disease via measurement of muscle anisotropy. Muscle & Nerve. 39 (1), 16-24 (2009).
- Rutkove, S. B., et al. Loss of electrical anisotropy is an unrecognized feature of dystrophic muscle that may serve as a convenient index of disease status. Clinical Neurophysiology. 127 (12), 3546-3551 (2016).
- Wang, L. L., et al. Assessment of alterations in the electrical impedance of muscle after experimental nerve injury via finite-element analysis. IEEE Transactions on Biomedical Engineering. 58 (6), 1585-1591 (2011).
- Katirji, B., Ruff, R. L., Kaminski, H. J. . Neuromuscular Disorders in Clinical Practice. , (2014).
- Rutkove, S. B., et al. Electrical impedance myography for assessment of Duchenne muscular dystrophy. Annals of Neurology. 81 (5), 622-632 (2017).
- Semple, C., et al. Using electrical impedance myography as a biomarker of muscle deconditioning in rats exposed to micro- and partial-gravity analogs. Frontiers in Physiology. 11, 557796 (2020).
- Kortman, H. G. J., Wilder, S. C., Geisbush, T. R., Narayanaswami, P., Rutkove, S. B. Age- and gender-associated differences in electrical impedance values of skeletal muscle. Physiological Measurement. 34 (12), 1611-1622 (2013).
- Clark, B. C., Rutkove, S., Lupton, E. C., Padilla, C. J., Arnold, W. D. Potential utility of electrical impedance myography in evaluating age-related skeletal muscle function deficits. Frontiers in Physiology. 12, 666964 (2021).
- Kapur, K., et al. Predicting myofiber size with electrical impedance myography: A study in immature mice. Muscle and Nerve. 58 (1), 106-113 (2018).
- Kapur, K., Nagy, J. A., Taylor, R. S., Sanchez, B., Rutkove, S. B. Estimating myofiber size with electrical impedance myography: a study in amyotrophic lateral sclerosis mice. Muscle and Nerve. 58 (5), 713-717 (2018).
- Mortreux, M., Semple, C., Riveros, D., Nagy, J. A., Rutkove, S. B. Electrical impedance myography for the detection of muscle inflammation induced by λ-carrageenan. PLoS ONE. 14 (10), 0223265 (2019).
- Pandeya, S. R., et al. Predicting myofiber cross-sectional area and triglyceride content with electrical impedance myography: A study in db/db mice. Muscle and Nerve. 63 (1), 127-140 (2021).
- Pandeya, S. R., et al. Estimating myofiber cross-sectional area and connective tissue deposition with electrical impedance myography: A study in D2-mdx mice. Muscle & Nerve. 63 (6), 941-950 (2021).
- Stålberg, E., et al. Standards for quantification of EMG and neurography. Clinical Neurophysiology. 130 (9), 1688-1729 (2019).
- Theodorou, D. J., Theodorou, S. J., Kakitsubata, Y. Skeletal muscle disease: Patterns of MRI appearances. British Journal of Radiology. 85 (1020), 1298-1308 (2012).
- Simon, N. G., Noto, Y., Zaidman, C. M. Skeletal muscle imaging in neuromuscular disease. Journal of Clinical Neuroscience. 33, 1-10 (2016).
- Kwon, H., Rutkove, S. B., Sanchez, B. Recording characteristics of electrical impedance myography needle electrodes. Physiological Measurement. 38 (9), 1748-1765 (2017).
- Kwon, H., Di Cristina, J. F., Rutkove, S. B., Sanchez, B. Recording characteristics of electrical impedance-electromyography needle electrodes. Physiological Measurement. 39 (5), 055005 (2018).
- Rutkove, S. B., et al. Characterizing spinal muscular atrophy with electrical impedance myography. Muscle and Nerve. 42 (6), 915-921 (2010).
- Schwartz, S., et al. Optimizing electrical impedance myography measurements by using a multifrequency ratio: A study in Duchenne muscular dystrophy. Clinical Neurophysiology. 126 (1), 202-208 (2015).
- Li, J., Pacheck, A., Sanchez, B., Rutkove, S. B. Single and modeled multifrequency electrical impedance myography parameters and their relationship to force production in the ALS SOD1G93A mouse. Amyotrophic Lateral Sclerosis and Frontotemporal Degeneration. 17 (5-6), 397-403 (2016).
- Hu, N., et al. Antisense oligonucleotide and adjuvant exercise therapy reverse fatigue in old mice with myotonic dystrophy. Molecular Therapy – Nucleic Acids. 23, 393-405 (2021).
- Sanchez, B., et al. Non-invasive assessment of muscle injury in healthy and dystrophic animals with electrical impedance myography. Muscle & Nerve. 56 (6), 85-94 (2017).
- Sanchez, B., Li, J., Bragos, R., Rutkove, S. B. Differentiation of the intracellular structure of slow- versus fast-twitch muscle fibers through evaluation of the dielectric properties of tissue. Physics in Medicine and Biology. 59 (10), 2369-2380 (2014).
- Shefner, J. M., et al. Assessing ALS progression with a dedicated electrical impedance myography system. Amyotrophic Lateral Sclerosis & Frontotemporal Degeneration. 19 (7-8), 555-561 (2018).
- Lungu, C., et al. Quantifying muscle asymmetries in cervical dystonia with electrical impedance: a preliminary assessment. Clinical Neurophysiology. 122 (5), 1027-1031 (2011).
- Wang, Y., et al. Electrical impedance myography for assessing paraspinal muscles of patients with low back pain. Journal of Electrical Bioimpedance. 10 (1), 103-109 (2019).
- Leitner, M. L., et al. Electrical impedance myography for reducing sample size in Duchenne muscular dystrophy trials. Annals of Clinical and Translational Neurology. 7 (1), 4-14 (2020).
- Rutkove, S. B., et al. Improved ALS clinical trials through frequent at-home self-assessment: a proof of concept study. Annals of Clinical and Translational Neurology. 7 (7), 1148-1157 (2020).

