مطيافية نيوترونية عالية الدقة لدراسة ديناميكيات بيكو ثانية-نانوثانية للبروتينات ومياه الترطيب
Summary
يوفر التحليل الطيفي للتشتت العكسي للنيوترونات وصولا غير مدمر وخالي من الملصقات إلى ديناميكيات ps-ns للبروتينات ومياه ترطيبها. يتم تقديم سير العمل مع دراستين حول بروتينات الأميلويد: حول ديناميكيات الليزوزيم التي تم حلها زمنيا أثناء التجميع وعلى ديناميكيات الماء المائية لتاو عند تكوين الألياف.
Abstract
يوفر تشتت النيوترونات إمكانية سبر الديناميكيات داخل العينات لمجموعة واسعة من الطاقات بطريقة غير مدمرة وبدون تسمية بخلاف الديوتيريوم. على وجه الخصوص ، يسجل التحليل الطيفي للتشتت العكسي للنيوترونات إشارات التشتت بزوايا تشتت متعددة في وقت واحد وهو مناسب تماما لدراسة ديناميكيات الأنظمة البيولوجية على مقياس ps-ns الزمني. من خلال استخدام D2O – وربما مكونات عازلة متوقفة – تسمح الطريقة بمراقبة كل من انتشار مركز الكتلة وحركات العمود الفقري والسلسلة الجانبية (الديناميات الداخلية) للبروتينات في الحالة السائلة.
بالإضافة إلى ذلك ، يمكن دراسة ديناميكيات مياه الترطيب عن طريق استخدام مساحيق من البروتينات المثبطة المرطبة ب H2O. تقدم هذه الورقة سير العمل المستخدم على الأداة IN16B في معهد Laue-Langevin (ILL) للتحقيق في ديناميكيات البروتين والماء المائي. يتم شرح تحضير عينات المحلول وعينات مسحوق البروتين المائي باستخدام تبادل البخار. يتم وصف إجراء تحليل البيانات لكل من ديناميات البروتين والماء الإماهة لأنواع مختلفة من مجموعات البيانات (الأطياف شبه المرنة أو عمليات المسح ذات النافذة الثابتة) التي يمكن الحصول عليها على مطياف التشتت العكسي للنيوترونات.
يتم توضيح الطريقة من خلال دراستين تتضمنان بروتينات الأميلويد. يظهر أن تجميع الليزوزيم إلى مجاميع كروية بحجم ميكرومتر – يشار إليها بالجسيمات – يحدث في عملية من خطوة واحدة على النطاق المكاني والزمني الذي تم فحصه في IN16B ، بينما تظل الديناميكيات الداخلية دون تغيير. علاوة على ذلك ، تمت دراسة ديناميات ماء الترطيب في تاو على مساحيق رطبة من البروتين perdeuteated. يتبين أن الحركات الانتقالية للماء يتم تنشيطها عند تكوين ألياف الأميلويد. أخيرا ، تتم مناقشة الخطوات الحاسمة في البروتوكول حول كيفية وضع تشتت النيوترونات فيما يتعلق بدراسة الديناميات فيما يتعلق بالطرق الفيزيائية الحيوية التجريبية الأخرى.
Introduction
النيوترون هو جسيم ضخم بدون شحنة تم استخدامه بنجاح على مر السنين لفحص العينات في مختلف المجالات من الفيزياء الأساسية إلى علم الأحياء1. بالنسبة للتطبيقات البيولوجية ، يتم استخدام تشتت النيوترونات بزاوية صغيرة ، وتشتت النيوترونات غير المرن ، وعلم البلورات النيوتروني وقياس الانعكاس على نطاق واسع2،3،4. يوفر تشتت النيوترونات غير المرن قياسا متوسطا للديناميكيات دون الحاجة إلى وضع علامات محددة في حد ذاتها ، وجودة إشارة لا تعتمد على الحجم أو البروتين5. يمكن إجراء القياس باستخدام بيئة معقدة للغاية للبروتين قيد الدراسة الذي يحاكي الوسط داخل الخلايا ، مثل المحللة البكتيرية المنزوعة أو حتى في الجسم الحي3،6،7. يمكن استخدام إعدادات تجريبية مختلفة لدراسة الديناميات ، وهي i) وقت الرحلة الذي يمنح الوصول إلى ديناميكيات ps-ps الفرعية ، ii) الوصول إلى التشتت العكسي إلى ديناميكيات ps-ns ، و iii) الوصول إلى الصدى المغزلي إلى الديناميكيات من ns إلى مئات ns. يستخدم التشتت العكسي للنيوترونات قانون براغ 2d sinθ = nλ ، حيث d هي المسافة بين المستويات في البلورة ، و θ زاوية التشتت ، و n ترتيب التشتت ، و λ الطول الموجي. يسمح استخدام البلورات للتشتت العكسي نحو أجهزة الكشف بتحقيق دقة عالية في الطاقة ، عادة ~ 0.8 μeV. لقياس تبادل الطاقة ، يتم استخدام إما محرك دوبلر يحمل بلورة في التشتت العكسي لتحديد وضبط الطول الموجي النيوتروني الوارد8،9،10 (الشكل 1) ، أو يمكن استخدام إعداد وقت الرحلة على حساب انخفاض في دقة الطاقة11.
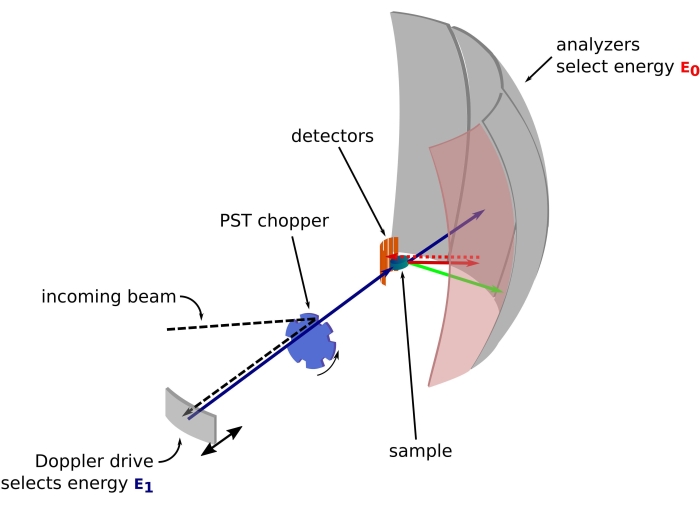
الشكل 1: رسم مطياف التشتت العكسي للنيوترونات بمحرك دوبلر. يصطدم الشعاع الوارد بمروحية تحويل فضاء الطور (PST)42 ، مما يزيد من التدفق في موضع العينة. ثم يتم تشتيتها مرة أخرى نحو العينة بواسطة محرك دوبلر ، الذي يختار الطاقة E1 (السهم السماوي). ثم يتم تشتيت النيوترونات بواسطة العينة (مع طاقات مختلفة ممثلة بلون الأسهم) والمحللين ، المصنوع من بلورات Si 111 ، سوف ينتشر فقط النيوترونات ذات الطاقة المحددة E0 (الأسهم ذات اللون الأحمر هنا). ومن ثم ، يتم الحصول على نقل الزخم q من الموضع المكتشف للنيوترون على صفيف الكاشف ، ويتم الحصول على نقل الطاقة من الفرق E1– E0. يتم استخدام وقت الرحلة المتوقع لنبضة النيوترون التي تنتجها PST لتجاهل الإشارة من النيوترونات المنتشرة مباشرة نحو أنابيب الكاشف. اختصار: PST = تحويل مساحة الطور. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
بالنسبة للتحليل الطيفي للتشتت العكسي ، تأتي المساهمة الرئيسية في الإشارة من العينات الغنية ببروتون الهيدروجين ، مثل البروتينات ، من التشتت غير المترابط ، حيث تظهر شدة التشتت Sinc (q ، ω) بواسطة Eq (1) 12
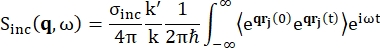 (1)
(1)
حيث σinc هو المقطع العرضي غير المترابط للعنصر المعتبر ، k ‘هو معيار المتجه الموجي المتناثر ، k هو معيار المتجه الموجي الوارد ، q (= k – k’) نقل الزخم ، r j (t) متجه موضع الذرة j في الوقت t ، و ω التردد المقابل لنقل الطاقة بين النيوترون الوارد والنظام. تشير الأقواس الزاوية إلى متوسط المجموعة. ومن ثم ، فإن التشتت غير المترابط يسبر الارتباط الذاتي للجسيم الواحد متوسط المجموعة لمواقع الذرة مع الوقت ويعطي متوسط الديناميكيات الذاتية على جميع الذرات في النظام وأصول زمنية مختلفة (متوسط المجموعة). دالة التشتت هي تحويل فورييه في زمن دالة التشتت الوسيطة I (q، t) ، والتي يمكن اعتبارها تحويل فورييه في الفضاء لدالة ارتباط فان هوف الموضحة بواسطة Eq (2):
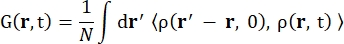 (2)
(2)
حيث ρ (r، t) هي كثافة احتمال إيجاد ذرة في الموضع r والوقت t 13.
بالنسبة لعملية الانتشار الويكي ، تنتج دالة الانتشار الذاتي (انظر Eq (3)) بعد تحويل فورييه المزدوج في دالة تشتت تتكون من لورنتزيان بعرض الخط المعطى بواسطة γ = Dq2.
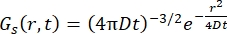 (3)
(3)
تم تطوير نماذج أكثر تطورا ووجدت مفيدة مثل نموذج انتشار القفز بواسطة Singwi و Sjölander لديناميات البروتين الداخليةps-ns 14 أو نموذج الدوران بواسطة Sears لمياه الترطيب15،16،17.
على أداة التشتت العكسي للنيوترونات (NBS) IN16B 8,9 في ILL، غرونوبل، فرنسا (الشكل التكميلي S1)، يتكون الإعداد الذي يشيع استخدامه مع البروتينات من بلورات Si 111 للمحللات مع محرك دوبلر لضبط الطول الموجي الوارد (الشكل التكميلي S2A)، مما يتيح الوصول إلى نطاق نقل الزخم ~ 0.2 Å-1 < q < ~ 2 Å-1 ونطاق نقل الطاقة -30 μeV < 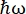 < 30 μeV المقابلة لجداول زمنية تتراوح من بضعة ps إلى عدد قليل من ns ومسافات قليلة Å. بالإضافة إلى ذلك ، يوفر IN16B إمكانية إجراء عمليات مسح مرنة وغير مرنة للنافذة الثابتة (E / IFWS) 10 ، والتي تشمل الحصول على البيانات عند نقل الطاقة الثابتة. نظرا لأن التدفق محدود عند العمل مع النيوترونات ، فإن E / IFWS يسمح بتعظيم التدفق لنقل طاقة واحد ، وبالتالي تقليل وقت الاكتساب اللازم للحصول على نسبة إشارة إلى ضوضاء مرضية. والخيار الأحدث هو النمط11 لمطياف التشتت العكسي ووقت الطيران (BATS) ، والذي يسمح بقياس مجموعة واسعة من عمليات نقل الطاقة ، (على سبيل المثال ، -150 μeV <
< 30 μeV المقابلة لجداول زمنية تتراوح من بضعة ps إلى عدد قليل من ns ومسافات قليلة Å. بالإضافة إلى ذلك ، يوفر IN16B إمكانية إجراء عمليات مسح مرنة وغير مرنة للنافذة الثابتة (E / IFWS) 10 ، والتي تشمل الحصول على البيانات عند نقل الطاقة الثابتة. نظرا لأن التدفق محدود عند العمل مع النيوترونات ، فإن E / IFWS يسمح بتعظيم التدفق لنقل طاقة واحد ، وبالتالي تقليل وقت الاكتساب اللازم للحصول على نسبة إشارة إلى ضوضاء مرضية. والخيار الأحدث هو النمط11 لمطياف التشتت العكسي ووقت الطيران (BATS) ، والذي يسمح بقياس مجموعة واسعة من عمليات نقل الطاقة ، (على سبيل المثال ، -150 μeV < 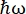 < 150 μeV) ، مع تدفق أعلى من محرك دوبلر ، ولكن على حساب دقة طاقة أقل (الشكل التكميلي S2B).
< 150 μeV) ، مع تدفق أعلى من محرك دوبلر ، ولكن على حساب دقة طاقة أقل (الشكل التكميلي S2B).
من الخصائص المهمة لتشتت النيوترونات أن المقطع العرضي غير المترابط σinc له قيمة أعلى 40 مرة للهيدروجين من الديوتيريوم ولا يكاد يذكر بالنسبة للعناصر الأخرى التي توجد عادة في العينات البيولوجية. لذلك ، يمكن دراسة ديناميكيات البروتينات في بيئة سائلة باستخدام مخزن مؤقت مقسم ، وتسمح حالة المسحوق بدراسة إما الديناميات الداخلية للبروتين مع مسحوق البروتين المهدرج المبلل ب D 2 O ، أودراسة ماء الترطيب لمسحوق البروتين perdeuterated المائي باستخدام H2O. في الحالة السائلة ، يسمح التشتت العكسي للنيوترونات عادة بالوصول في وقت واحد إلى الانتشار الذاتي لمركز الكتلة للبروتينات (الانتشار من نوع Fickian) وديناميكياتها الداخلية. هذه الأخيرة هي حركات العمود الفقري والسلسلة الجانبية التي يصفها عادة ما يسمى نموذج انتشار القفز أو غيره 3,18. في مساحيق البروتين المهدرجة ، يكون انتشار البروتين غائبا ويجب نمذجة الديناميات الداخلية فقط. بالنسبة لمياه الإماهة ، فإن مساهمات الحركات الانتقالية والدورانية لجزيئات الماء تقدم اعتمادا مختلفا على نقل الزخم q ، مما يسمح بتمييزها في عملية تحليل البيانات17.
توضح هذه الورقة طريقة التشتت العكسي للنيوترونات مع دراسة البروتينات التي وجد أنها قادرة على التكشف ، وتتجمع في شكل قانوني يتكون من أكوام من خيوط β – ما يسمى بنمط β المتقاطع19،20 – وتشكل أليافا ممدودة. هذا هو ما يسمى بتجميع الأميلويد ، والذي تمت دراسته على نطاق واسع بسبب دوره المركزي في الاضطرابات التنكسية العصبية مثل مرض الزهايمر أو مرض باركنسون21,22. إن دراسة بروتينات الأميلويد مدفوعة أيضا بالدور الوظيفي الذي يمكن أن تلعبه 23,24 أو إمكاناتها العالية لتطوير مواد حيوية جديدة25. لا تزال المحددات الفيزيائية والكيميائية لتجميع الأميلويد غير واضحة ، ولا تتوفر نظرية عامة لتجميع الأميلويد ، على الرغم من التقدم الهائل خلال السنوات الماضية21,26.
ينطوي تجميع الأميلويد على تغييرات في بنية البروتين واستقراره مع مرور الوقت ، والتي تنطوي دراستها بشكل طبيعي على ديناميكيات مرتبطة باستقرار تكوين البروتين ، ووظيفة البروتين ، ومشهد طاقة البروتين27. ترتبط الديناميكيات ارتباطا مباشرا باستقرار حالة معينة من خلال المساهمة الإنتروبية لأسرع الحركات28 ، ويمكن الحفاظ على وظيفة البروتين من خلال الحركات على نطاقات زمنية مختلفة من sub-ps للبروتينات الحساسة للضوء29 إلى ms لحركات المجال ، والتي يمكن تسهيلها بواسطة ديناميكيات بيكو ثانيةنانو ثانية 30.
سيتم تقديم مثالين على استخدام التحليل الطيفي للتشتت العكسي للنيوترونات لدراسة بروتينات الأميلويد ، أحدهما في الحالة السائلة لدراسة ديناميكيات البروتين والآخر في حالة المسحوق المائي لدراسة ديناميكيات الماء المماهة. يتعلق المثال الأول بتجميع الليزوزيم في كرات بحجم ميكرومتر (تسمى الجسيمات) متبوعة في الوقت الفعلي5 ، والثاني مقارنة لديناميكيات المياه في الحالات الأصلية والمجمعة للبروتين البشري تاو31.
الليزوزيم هو إنزيم يشارك في الدفاع المناعي ويتكون من 129 من بقايا الأحماض الأمينية. يمكن أن يشكل الليزوزيم جسيمات في المخزن المؤقت المثبط عند pD 10.5 وعند درجة حرارة 90 درجة مئوية. مع تشتت النيوترونات ، أظهرنا أن التطور الزمني لمعامل انتشار مركز الكتلة للليزوزيم يتبع الحركية الأسية المفردة لتألق ثيوفلافين T (مسبار فلوري يستخدم لمراقبة تكوين أنماط β المتقاطع الأميلويد32) ، مما يشير إلى أن الهياكل الفوقية للجسيمات وأنماط β المتقاطع تحدث في خطوة واحدة بنفس المعدل. علاوة على ذلك ، ظلت الديناميات الداخلية ثابتة طوال عملية التجميع ، والتي يمكن تفسيرها إما من خلال تغيير توافقي سريع لا يمكن ملاحظته على أدوات NBS ، أو من خلال عدم وجود تغيير كبير في الطاقة الداخلية للبروتين عند التجميع.
البروتين البشري تاو هو بروتين مضطرب جوهريا (IDP) يتكون من 441 من الأحماض الأمينية لما يسمى ب 2N4R isoform ، والذي يشارك بشكل خاص في مرض الزهايمر33. باستخدام التشتت العكسي للنيوترونات على مساحيق بروتين تاو perdeuterated ، أظهرنا أن ديناميكيات الماء المائيات تزداد في حالة الألياف ، مع وجود عدد أكبر من جزيئات الماء التي تخضع لحركات متعدية. تشير النتيجة إلى أن الزيادة في إنتروبيا الماء المائي قد تؤدي إلى رجفان الأميلويد في تاو.
Protocol
Representative Results
Discussion
التحليل الطيفي النيوتروني هو الطريقة الوحيدة التي تسمح بفحص ديناميكيات ps-ns ذات المتوسط الجماعي لعينات البروتين بغض النظر عن حجم البروتين أو تعقيد المحلول عند استخدام deuteration6. على وجه التحديد ، من خلال التحقيق في الانتشار الذاتي لمجموعات البروتين في المحلول ، يمكن تحديد الحجم…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
يعرب المؤلفون عن امتنانهم لميكايلا زامبوني من مركز يوليش لعلوم النيوترون في هاينز ماير لايبنيتز سنتروم ، جارشينج ، ألمانيا ، لجزء من تجارب تشتت النيوترونات التي أجريت على أداة SPHERES. وقد استفاد هذا العمل من أنشطة اتحاد مختبرات Deuteration (DLAB) الذي يموله الاتحاد الأوروبي بموجب العقدين HPRI-2001-50065 و RII3-CT-2003-505925 ، ومن النشاط الممول من مجلس أبحاث العلوم الهندسية والفيزيائية في المملكة المتحدة (EPSRC) داخل معهد Laue Langevin EMBL DLAB بموجب المنح GR / R99393/01 و EP / C015452 / 1. الدعم المقدم من المفوضية الأوروبية في إطار البرنامج الإطاري السابع من خلال الإجراء الرئيسي: تعزيز منطقة البحوث الأوروبية ، يتم الاعتراف بالبنى التحتية البحثية [العقد 226507 (NMI3)]. يشكر كيفن بونوت وكريستيان بيك الوزارة الفيدرالية للتعليم والبحث (BMBF ، رقم المنحة 05K19VTB) على تمويل زمالات ما بعد الدكتوراه.
Materials
| Aluminum sample holder | Not commercially available. Either the local contact on the instrument can provide them or they can be manufactured based on a technical drawing that can be provided by the local contact. | ||
| Deuterium chloride, 35 wt. % in D2O, ≥99 atom % D | Sigma-Aldrich | 543047 |
|
| Deuterium oxide (D, 99.9%) | Eurisotop | DLM-4DR-PK | |
| Dow Corning high-vacuum silicone grease | Sigma-Aldrich | Z273554-1EA | |
| Ethanol 96%, EMSURE Reag. Ph Eur | Sigma-Aldrich | 1.5901 | |
| Glass dessicator | VWR | 75871-660 | |
| Glass dessicator plate, 140 mm | VWR | 89038-068 | |
| Indium wire, 1.0 mm (0.04 in) dia, Puratronic, 99.999% | Alfa Aesar | 00470.G1 | |
| Lysozyme from chicken egg white dialyzed, lyophilized, powder, ~100,000 U/mg | Sigma-Aldrich | 62970 | |
| nPDyn | v3.x | see github.com/kpounot/nPDyn, model functions fot fitting also included in the software | |
| OHAUS AX324 Adventurer balance, internal calibration | Dutscher | 92641 | |
| Phosphorus pentoxide, ReagentPlus, 99% | Sigma-Aldrich | 214701 | |
| Pipette ErgoOne 0.5-10 μL | Starlab | S7100-0510 | |
| Pipette ErgoOne 100-1,000 μL | Starlab | S7100-1000 | |
| Pipette ErgoOne 20-200 μL | Starlab | S7100-2200 | |
| Pipette tip TipOne 1,000 μL | Starlab | S1111-6001 | |
| Pipette tip TipOne 10 μL | Starlab | S1111-3200 | |
| Pipette tip TipOne 200 μL | Starlab | S1111-0206 | |
| Sodium deuteroxide solution, 40 wt. % in D2O, 99.5 atom % D | Sigma-Aldrich | 372072 |
Riferimenti
- Jacrot, B. Des neutrons pour la science: Histoire de l’Institut Laue-Langevin. Des neutrons pour la science. EDP Sciences. , (2021).
- Mahieu, E., Gabel, F. Biological small-angle neutron scattering: recent results and development. Acta Crystallographica Section D. 74 (8), 715-726 (2018).
- Grimaldo, M., Roosen-Runge, F., Zhang, F., Schreiber, F., Seydel, T. Dynamics of proteins in solution. Quarterly Reviews of Biophysics. 52, 7 (2019).
- Martel, A., et al. Membrane permeation versus amyloidogenicity: A multitechnique study of islet amyloid polypeptide interaction with model membranes. Journal of the American Chemical Society. 139 (1), 137-148 (2017).
- Pounot, K., et al. Tracking internal and global diffusive dynamics during protein aggregation by high-resolution neutron spectroscopy. The Journal of Physical Chemistry Letters. 11 (15), 6299-6304 (2020).
- Grimaldo, M., et al. Protein short-time diffusion in a naturally crowded environment. The Journal of Physical Chemistry Letters. 10 (8), 1709-1715 (2019).
- Jasnin, M., Stadler, A., Tehei, M., Zaccai, G. Specific cellular water dynamics observed in vivo by neutron scattering and NMR. Physical Chemistry Chemical Physics. 12 (35), 10154-10160 (2010).
- Frick, B. The neutron backscattering spectrometer IN16 at ILL-high energy resolution with high intensity and excellent signal-to-noise ratio. Neutron News. 13 (2), 15-22 (2002).
- Frick, B., Mamontov, E., van Eijck, L., Seydel, T. Recent backscattering instrument developments at the ILL and SNS. Zeitschrift für Physikalische Chemie. 224 (1-2), 33-60 (2010).
- Frick, B., Combet, J., van Eijck, L. New possibilities with inelastic fixed window scans and linear motor Doppler drives on high resolution neutron backscattering spectrometers. Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 669, 7-13 (2012).
- Appel, M., Frick, B., Magerl, A. A flexible high speed pulse chopper system for an inverted neutron time-of-flight option on backscattering spectrometers. Scientific Reports. 8 (1), 13580 (2018).
- Squires, G. L. . Introduction to the theory of thermal neutron scattering. , (1996).
- Singwi, K. S., Sjölander, A. Diffusive motions in water and cold neutron scattering. Physical Review. 119 (3), 863-871 (1960).
- Sears, V. F. Theory of cold neutron scattering by homonuclear diatomic liquids: i. free rotation. Canadian Journal of Physics. 44 (6), 1279-1297 (1966).
- Sears, V. F. Theory of cold neutron scattering by homonuclear liquid: ii. hindered rotation. Canadian Journal of Physics. 44 (6), 1299-1311 (1966).
- Schirò, G., et al. Translational diffusion of hydration water correlates with functional motions in folded and intrinsically disordered proteins. Nature Communications. 6, 6490 (2015).
- Grimaldo, M., et al. Hierarchical molecular dynamics of bovine serum albumin in concentrated aqueous solution below and above thermal denaturation. Physical Chemistry Chemical Physics. 17 (6), 4645-4655 (2015).
- Eanes, E. D., Glenner, G. G. X-ray diffraction studies on amyloid filaments. Journal of Histochemistry & Cytochemistry. 16 (11), 673-677 (1968).
- Bonar, L., Cohen, A. S., Skinner, M. M. Characterization of the Amyloid Fibril as a Cross-β Protein. Proceedings of the Society for Experimental Biology and Medicine. 131 (4), 1373-1375 (1969).
- Chiti, F., Dobson, C. M. Protein Misfolding, Amyloid Formation, and Human Disease: A Summary of Progress Over the Last Decade. Annual Review of Biochemistry. 86 (1), 27-68 (2017).
- Knowles, T. P. J., Vendruscolo, M., Dobson, C. M. The amyloid state and its association with protein misfolding diseases. Nature Reviews Molecular Cell Biology. 15 (6), 384-396 (2014).
- Maji, S. K., et al. Functional amyloids as natural storage of peptide hormones in pituitary secretory granules. Science. 325 (5938), 328-332 (2009).
- Li, J., et al. The RIP1/RIP3 necrosome forms a functional amyloid signaling complex required for programmed necrosis. Cell. 150 (2), 339-350 (2012).
- Knowles, T. P. J., Mezzenga, R. Amyloid fibrils as building blocks for natural and artificial functional materials. Advanced Materials. 28 (31), 6546-6561 (2016).
- Stephens, A. D., Kaminski Schierle, G. S. The role of water in amyloid aggregation kinetics. Current Opinion in Structural Biology. 58, 115-123 (2019).
- Adamcik, J., Mezzenga, R. Amyloid polymorphism in the protein folding and aggregation energy landscape. Angewandte Chemie International Edition. 57 (28), 8370-8382 (2018).
- Liu, Z., et al. Entropic contribution to enhanced thermal stability in the thermostable P450 CYP119. Proceedings of the National Academy of Sciences of the United States of America. 115 (43), 10049-10058 (2018).
- Coquelle, N., et al. Chromophore twisting in the excited state of a photoswitchable fluorescent protein captured by time-resolved serial femtosecond crystallography. Nature Chemistry. 10 (1), 31-37 (2018).
- Henzler-Wildman, K. A., et al. A hierarchy of timescales in protein dynamics is linked to enzyme catalysis. Nature. 450 (7171), 913-916 (2007).
- Fichou, Y., et al. Hydration water mobility is enhanced around tau amyloid fibers. Proceedings of the National Academy of Sciences of the United States of America. 112 (20), 6365-6370 (2015).
- Burns, J., Pennock, C. A., Stoward, P. J. The specificity of the staining of amyloid deposits with thioflavine T. The Journal of Pathology and Bacteriology. 94 (2), 337-344 (1967).
- Iqbal, K., Liu, F., Gong, C. -. X., Grundke-Iqbal, I. Tau in Alzheimer disease and related tauopathies. Current Alzheimer Research. 7 (8), 656-664 (2010).
- Krȩżel, A., Bal, W. A formula for correlating pKa values determined in D2O and H2O. Journal of Inorganic Biochemistry. 98 (1), 161-166 (2004).
- Dolman, M., Halling, P. J., Moore, B. D., Waldron, S. How dry are anhydrous enzymes? Measurement of residual and buried 18O-labeled water molecules using mass spectrometry. Biopolymers. 41 (3), 313-321 (1997).
- Pounot, K. kpounotnPDyn: v3.0.0. Zenodo. , (2021).
- Yi, Z., Miao, Y., Baudry, J., Jain, N., Smith, J. C. Derivation of mean-square displacements for protein dynamics from elastic incoherent neutron scattering. Journal of Physical Chemistry B. 116 (16), 5028-5036 (2012).
- Peters, J., Kneller, G. R. Motional heterogeneity in human acetylcholinesterase revealed by a non-Gaussian model for elastic incoherent neutron scattering. The Journal of Chemical Physics. 139 (16), 165102 (2013).
- Zeller, D., Telling, M. T. F., Zamponi, M., García Sakai, V., Peters, J. Analysis of elastic incoherent neutron scattering data beyond the Gaussian approximation. The Journal of Chemical Physics. 149 (23), 234908 (2018).
- Roosen-Runge, F., Seydel, T. A generalized mean-squared displacement from inelastic fixed window scans of incoherent neutron scattering as a model-free indicator of anomalous diffusion confinement. EPJ Web of Conferences. 83, 02015 (2015).
- Ortega, A., Amorós, D., García de la Torre, J. Prediction of hydrodynamic and other solution properties of rigid proteins from atomic- and residue-level models. Biophysical Journal. 101 (4), 892-898 (2011).
- Hennig, M., Frick, B., Seydel, T. IUCr Optimum velocity of a phase-space transformer for cold-neutron backscattering spectroscopy. Journal of Applied Crystallography. 44 (3), 467-472 (2011).
- Paalman, H. H., Pings, C. J. Numerical evaluation of X-ray absorption factors for cylindrical samples and annular sample cells. Journal of Applied Physics. 33 (8), 2635-2639 (1962).
- Ow, S. -. Y., Dunstan, D. E. The effect of concentration, temperature and stirring on hen egg white lysozyme amyloid formation. Soft Matter. 9 (40), 9692-9701 (2013).
- Tominaga, T., Sahara, M., Kawakita, Y., Nakagawa, H., Yamada, T. Evaluation of sample cell materials for aqueous solutions used in quasi-elastic neutron scattering measurements. Journal of Applied Crystallography. 54 (6), 1631-1640 (2021).
- Beck, C., et al. Following protein dynamics in real time during crystallization. Crystal Growth & Design. 19 (12), 7036-7045 (2019).
- Smith, A. A., Testori, E., Cadalbert, R., Meier, B. H., Ernst, M. Characterization of fibril dynamics on three timescales by solid-state NMR. Journal of Biomolecular NMR. 65 (3-4), 171-191 (2016).
- Wang, T., Jo, H., DeGrado, W. F., Hong, M. Water distribution, dynamics, and interactions with Alzheimer’s β-amyloid fibrils investigated by solid-state NMR. Journal of the American Chemical Society. 139 (17), 6242-6252 (2017).
- Rezaei-Ghaleh, N., Giller, K., Becker, S., Zweckstetter, M. Effect of zinc dinding on β-amyloid structure and dynamics: Implications for Aβ aggregation. Biophysical Journal. 101 (5), 1202-1211 (2011).
- Vugmeyster, L., et al. Fast motions of key methyl groups in amyloid-β fibrils. Biophysical Journal. 111 (10), 2135-2148 (2016).
- Yang, X., Wang, B., Hoop, C. L., Williams, J. K., Baum, J. NMR unveils an N-terminal interaction interface on acetylated-α-synuclein monomers for recruitment to fibrils. Proceedings of the National Academy of Sciences of the United States of America. 118 (18), (2021).
- Tuttle, M. D., et al. Solid-state NMR structure of a pathogenic fibril of full-length human α-synuclein. Nature Structural & Molecular Biology. 23 (5), 409-415 (2016).
- Karamanos, T. K., Kalverda, A. P., Thompson, G. S., Radford, S. E. Mechanisms of amyloid formation revealed by solution NMR. Progress in Nuclear Magnetic Resonance Spectroscopy. 88-89, 86-104 (2015).
- Lai, Y. -. C., Kuo, Y. -. H., Chiang, Y. -. W. Identifying protein conformational dynamics using spin-label ESR. Chemistry – An Asian Journal. 14 (22), 3981-3991 (2019).
- Franck, J. M., Han, S. Overhauser dynamic nuclear polarization for the study of hydration dynamics, explained. Methods in Enzymology. 615, 131-175 (2019).
- Pavlova, A., et al. Protein structural and surface water rearrangement constitute major events in the earliest aggregation stages of tau. Proceedings of the National Academy of Sciences of the United States of America. 113 (2), 127-136 (2016).
- Lin, Y., et al. Liquid-liquid phase separation of tau driven by hydrophobic interaction facilitates fibrillization of tau. bioRxiv. , (2020).
- Decatur, S. M. Elucidation of residue-level structure and dynamics of polypeptides via isotope-edited infrared spectroscopy. Accounts of Chemical Research. 39 (3), 169-175 (2006).
- Chatani, E., Tsuchisaka, Y., Masuda, Y., Water Tsenkova, R. molecular system dynamics associated with amyloidogenic nucleation as revealed by real time near infrared spectroscopy and aquaphotomics. PLoS One. 9 (7), 101997 (2014).
- Goret, G., Aoun, B., Pellegrini, E. MDANSE: An interactive analysis environment for molecular dynamics simulations. Journal of Chemical Information and Modeling. 57 (1), 1-5 (2017).
- Fujiwara, S., et al. Internal dynamics of a protein that forms the amyloid fibrils observed by neutron scattering. Journal of the Physical Society of Japan. 82, (2013).
- Schiró, G., et al. Neutron scattering reveals enhanced protein dynamics in concanavalin a amyloid fibrils. Journal of Physical Chemistry Letters. 3 (8), 992-996 (2012).
- Pounot, K., et al. Zinc determines dynamical properties and aggregation kinetics of human insulin. Biophysical Journal. 120 (5), 886-898 (2021).
- Fujiwara, S., et al. Dynamic properties of human α-synuclein related to propensity to amyloid fibril formation. Journal of Molecular Biology. 431 (17), 3229-3245 (2019).
- Sanz, A., et al. High-pressure cell for simultaneous dielectric and neutron spectroscopy. Review of Scientific Instruments. 89 (2), 023904 (2018).
- Adams, M. A., et al. Simultaneous neutron scattering and Raman scattering. Applied Spectroscopy. 63 (7), 727-732 (2009).

