Hochauflösende Neutronenspektroskopie zur Untersuchung der Pikosekunden-Nanosekunden-Dynamik von Proteinen und Hydratationswasser
Summary
Die Neutronenrückstreuspektroskopie bietet einen zerstörungsfreien und markierungsfreien Zugang zur ps-ns-Dynamik von Proteinen und deren Hydratationswasser. Der Workflow wird anhand von zwei Studien zu Amyloid-Proteinen vorgestellt: zur zeitaufgelösten Dynamik von Lysozym während der Aggregation und zur Hydratationswasserdynamik von Tau bei der Faserbildung.
Abstract
Die Neutronenstreuung bietet die Möglichkeit, die Dynamik in Proben für einen weiten Energiebereich zerstörungsfrei und ohne andere Markierung als Deuterium zu untersuchen. Insbesondere die Neutronenrückstreuspektroskopie zeichnet die Streusignale bei mehreren Streuwinkeln gleichzeitig auf und eignet sich gut, um die Dynamik biologischer Systeme auf der ps-ns-Zeitskala zu untersuchen. Durch die Verwendung vonD2O– und möglicherweise deuterierten Pufferkomponenten ermöglicht die Methode die Überwachung sowohl der Massenschwerpunktdiffusion als auch der Rückgrat- und Seitenkettenbewegungen (interne Dynamik) von Proteinen im flüssigen Zustand.
Darüber hinaus kann die Dynamik des Hydratationswassers untersucht werden, indem Pulver aus perdeuterierten Proteinen verwendet werden, die mitH2Ohydratisiert sind. In diesem Artikel wird der Arbeitsablauf des Instruments IN16B am Institut Laue-Langevin (ILL) zur Untersuchung der Protein- und Hydratationswasserdynamik vorgestellt. Die Herstellung von Lösungsproben und hydratisierten Proteinpulverproben mittels Dampfaustausch wird erläutert. Das Datenanalyseverfahren sowohl für die Protein- als auch für die Hydratationswasserdynamik wird für verschiedene Arten von Datensätzen (quasielastische Spektren oder Fixed-Window-Scans) beschrieben, die mit einem Neutronenrückstreuspektrometer erhalten werden können.
Die Methode wird anhand von zwei Studien mit Amyloid-Proteinen veranschaulicht. Es wird gezeigt, dass die Aggregation von Lysozym in μm-große sphärische Aggregate – als Partikel bezeichnet – in einem einstufigen Prozess auf dem auf IN16B untersuchten Raum- und Zeitbereich erfolgt, während die interne Dynamik unverändert bleibt. Des Weiteren wurde die Dynamik des Hydratationswassers von Tau an hydratisierten Pulvern aus perdeuteriertem Protein untersucht. Es wird gezeigt, dass Translationsbewegungen von Wasser bei der Bildung von Amyloidfasern aktiviert werden. Abschließend werden kritische Schritte im Protokoll diskutiert, wie die Neutronenstreuung im Hinblick auf die Untersuchung der Dynamik im Vergleich zu anderen experimentellen biophysikalischen Methoden positioniert ist.
Introduction
Das Neutron ist ein ladungsloses und massereiches Teilchen, das im Laufe der Jahre erfolgreich zur Untersuchung von Proben in verschiedenen Bereichen von der Grundlagenphysik bis zur Biologieeingesetzt wurde 1. Für biologische Anwendungen werden Kleinwinkel-Neutronenstreuung, inelastische Neutronenstreuung sowie Neutronenkristallographie und Reflektometrie häufig eingesetzt 2,3,4. Die inelastische Neutronenstreuung ermöglicht eine ensemblegemittelte Messung der Dynamik, ohne dass eine spezifische Markierung an sich erforderlich ist, und eine Signalqualität, die nicht von der Größe oder dem Protein abhängt5. Die Messung kann in einer hochkomplexen Umgebung für das untersuchte Protein durchgeführt werden, die das intrazelluläre Medium nachahmt, wie z. B. ein deuteriertes bakterielles Lysat oder sogar in vivo 3,6,7. Verschiedene experimentelle Aufbauten können verwendet werden, um die Dynamik zu untersuchen, nämlich i) Flugzeit-gebender Zugang zu sub-ps-ps-Dynamik, ii) Rückstreuung-gebender Zugang zu ps-ns-Dynamik und iii) Spin-Echo-gebender Zugang zu Dynamik von ns bis zu Hunderten von ns. Die Neutronenrückstreuung nutzt das Braggsche Gesetz 2d sinθ = nλ, wobei d der Abstand zwischen Ebenen in einem Kristall, θ der Streuwinkel, n die Streuordnung und λ die Wellenlänge ist. Die Verwendung von Kristallen für die Rückstreuung zu den Detektoren ermöglicht es, eine hohe Energieauflösung von typischerweise ~0,8 μeV zu erreichen. Um den Energieaustausch zu messen, wird entweder ein Dopplerantrieb verwendet, der einen Kristall in der Rückstreuung trägt, um die einfallende Neutronenwellenlänge 8,9,10 zu definieren und einzustellen (Abbildung 1), oder es kann ein Time-of-Flight-Setup auf Kosten einer Verringerung der Energieauflösung 11 verwendet werden.
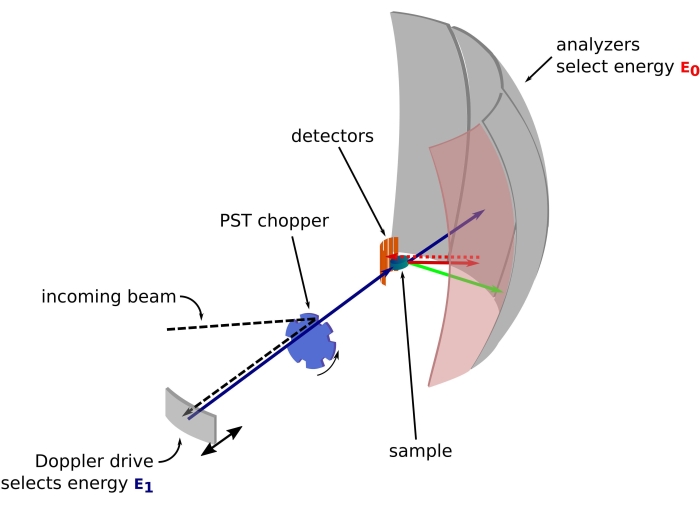
Abbildung 1: Skizze eines Neutronenrückstreuspektrometers mit Dopplerantrieb. Der einfallende Strahl trifft auf den Phasenraumtransformations-Chopper42 (PST), der den Fluss an der Probenposition erhöht. Es wird dann durch den Dopplerantrieb, der eine Energie E1 (cyanfarbener Pfeil) wählt, in Richtung der Probe zurückgestreut. Die Neutronen werden dann von der Probe gestreut (mit unterschiedlichen Energien, die durch die Farbe der Pfeile dargestellt werden) und die Analysatoren, die aus Si 111-Kristallen bestehen, streuen nur Neutronen mit einer spezifischen Energie E0 zurück (hier rote Pfeile). Daher wird der Impulstransfer q aus der detektierten Position des Neutrons auf dem Detektorarray und der Energietransfer aus der Differenz E1 – E0 erhalten. Die erwartete Flugzeit für den vom PST erzeugten Neutronenpuls wird verwendet, um das Signal der Neutronen zu verwerfen, die direkt in Richtung der Detektorröhren gestreut werden. Abkürzung: PST = Phasenraumtransformation. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Für die Rückstreuspektroskopie kommt der Hauptbeitrag zum Signal von protonenreichen Wasserstoffproben, wie z. B. Proteinen, aus der inkohärenten Streuung, für die die Streuintensität Sinc(q, ω) durch Gl (1)12 gezeigt wird
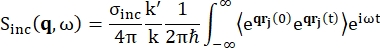 (1)
(1)
Dabei ist σinc der inkohärente Wirkungsquerschnitt des betrachteten Elements, k’ die Norm des gestreuten Wellenvektors, k die Norm des eingehenden Wellenvektors, q (= k – k’) die Impulsübertragung, r j(t) der Ortsvektor des Atoms j zum Zeitpunkt t und ω die Frequenz, die dem Energietransfer zwischen dem einfallenden Neutron und dem System entspricht. Die eckigen Klammern bezeichnen den Ensembledurchschnitt. Die inkohärente Streuung untersucht daher die ensemblegemittelte Einzelteilchen-Selbstkorrelation der Atompositionen mit der Zeit und liefert die Selbstdynamik gemittelt über alle Atome im System und verschiedene Zeitursprünge (Ensemble-Mittelwert). Die Streufunktion ist die zeitliche Fourier-Transformation der intermediären Streufunktion I(q, t), die als Fourier-Transformation im Raum der van-Hove-Korrelationsfunktion angesehen werden kann, die durch Gl (2) gezeigt wird:
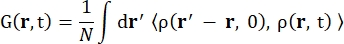 (2)
(2)
Wobei ρ(r,t) die Wahrscheinlichkeitsdichte ist, ein Atom an der Position r und der Zeit t 13 zu finden.
Für einen Fickschen Diffusionsprozess ergibt sich die Selbstdiffusionsfunktion (siehe Gl (3)) nach einer doppelten Fourier-Transformation in einer Streufunktion, die aus einem Lorentz-Operator mit Linienbreite besteht, der durch γ = Dq2 gegeben ist.
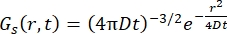 (3)
(3)
Ausgefeiltere Modelle wurden entwickelt und für nützlich befunden, wie z.B. das Sprungdiffusionsmodell von Singwi und Sjölander für die interne ps-ns-Proteindynamik14 oder das Rotationsmodell von Sears für Hydratationswasser15,16,17.
Auf dem Neutronenrückstreuinstrument IN16B 8,9 am ILL in Grenoble, Frankreich (Supplemental Figure S1), besteht ein bei Proteinen üblicherweise verwendeter Aufbau aus Si 111-Kristallen für die Analysatoren mit einem Dopplerantrieb zur Abstimmung der eingehenden Wellenlänge (Supplemental Figure S2A), wodurch der Impulsübertragungsbereich ~0,2 Å-1 < q < ~2 Å-1 und der Energieübertragungsbereich von –30 μeV < 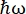 < 30 μeV, was Zeitskalen von wenigen ps bis einigen ns und Entfernungen von einigen Å entspricht. Darüber hinaus bietet IN16B die Möglichkeit, elastische und inelastische Fixed-Window-Scans (E/IFWS)10 durchzuführen, die die Datenerfassung bei einer festen Energieübertragung beinhalten. Da der Fluss bei der Arbeit mit Neutronen begrenzt ist, ermöglicht E/IFWS die Maximierung des Flusses für einen Energietransfer, wodurch die Erfassungszeit reduziert wird, die benötigt wird, um ein zufriedenstellendes Signal-Rausch-Verhältnis zu erhalten. Eine neuere Option ist das Rückstreu- und Flugzeitspektrometer (BATS) Mode11, das die Messung eines breiten Bereichs von Energietransfers (z. B. -150 μeV < <
< 30 μeV, was Zeitskalen von wenigen ps bis einigen ns und Entfernungen von einigen Å entspricht. Darüber hinaus bietet IN16B die Möglichkeit, elastische und inelastische Fixed-Window-Scans (E/IFWS)10 durchzuführen, die die Datenerfassung bei einer festen Energieübertragung beinhalten. Da der Fluss bei der Arbeit mit Neutronen begrenzt ist, ermöglicht E/IFWS die Maximierung des Flusses für einen Energietransfer, wodurch die Erfassungszeit reduziert wird, die benötigt wird, um ein zufriedenstellendes Signal-Rausch-Verhältnis zu erhalten. Eine neuere Option ist das Rückstreu- und Flugzeitspektrometer (BATS) Mode11, das die Messung eines breiten Bereichs von Energietransfers (z. B. -150 μeV < < 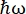 150 μeV) mit einem höheren Fluss als mit dem Dopplerantrieb, jedoch auf Kosten einer geringeren Energieauflösung ermöglicht (ergänzende Abbildung S2B).
150 μeV) mit einem höheren Fluss als mit dem Dopplerantrieb, jedoch auf Kosten einer geringeren Energieauflösung ermöglicht (ergänzende Abbildung S2B).
Eine wichtige Eigenschaft der Neutronenstreuung ist, dass der inkohärente Wirkungsquerschnitt σinc für Wasserstoff einen 40-mal höheren Wert als für Deuterium hat und für andere Elemente, die üblicherweise in biologischen Proben vorkommen, vernachlässigbar ist. Daher kann die Dynamik von Proteinen in einer flüssigen Umgebung unter Verwendung eines deuterierten Puffers untersucht werden, und der Pulverzustand ermöglicht die Untersuchung entweder der inneren Dynamik von Proteinen mit hydriertem Proteinpulver, das mit D2O hydratisiert ist, oder die Untersuchung von Hydratationswasser für perdeuteriertes Proteinpulver, das mitH2Ohydratisiert ist. Im flüssigen Zustand ermöglicht die Neutronenrückstreuung typischerweise den gleichzeitigen Zugriff auf die Selbstdiffusion des Massenschwerpunkts von Proteinen (Fickian-Typ-Diffusion) und deren interne Dynamik. Bei letzteren handelt es sich um Rückgrat- und Seitenkettenbewegungen, die in der Regel durch das sogenannte Sprungdiffusionsmodell oder andere beschrieben werden 3,18. In hydrierten Proteinpulvern fehlt die Proteindiffusion und es muss nur die interne Dynamik modelliert werden. Für Hydratationswasser weisen die Beiträge von Translations- und Rotationsbewegungen von Wassermolekülen eine andere Abhängigkeit vom Impulstransfer q auf, was ihre Unterscheidung im Datenanalyseprozess ermöglicht17.
Diese Arbeit veranschaulicht die Methode der Neutronenrückstreuung anhand der Untersuchung von Proteinen, die in der Lage sind, sich zu entfalten, zu einer kanonischen Form zu aggregieren, die aus Stapeln von β-Strängen besteht – dem sogenannten Kreuz-β-Muster19,20 – und längliche Fasern zu bilden. Dabei handelt es sich um die sogenannte Amyloid-Aggregation, die aufgrund ihrer zentralen Rolle bei neurodegenerativen Erkrankungen wie Alzheimer oder Parkinson ausgiebig untersucht wird21,22. Die Untersuchung der Amyloid-Proteine ist auch durch die funktionelle Rolle, die sie spielen können, motiviert 23,24 oder durch ihr hohes Potenzial für die Entwicklung neuartiger Biomaterialien25. Die physikalisch-chemischen Determinanten der Amyloid-Aggregation sind nach wie vor unklar, und es gibt keine allgemeine Theorie der Amyloid-Aggregation, trotz enormer Fortschritte in den letzten Jahren21,26.
Die Amyloid-Aggregation impliziert Veränderungen in der Proteinstruktur und -stabilität im Laufe der Zeit, deren Untersuchung natürlich eine Dynamik impliziert, die mit der Stabilität der Proteinkonformation, der Proteinfunktion und der Proteinenergielandschaft zusammenhängt27. Die Dynamik ist durch den entropischen Beitrag für die schnellsten Bewegungen28 direkt mit der Stabilität eines bestimmten Zustands verbunden, und die Proteinfunktion kann durch Bewegungen auf verschiedenen Zeitskalen von sub-ps für lichtempfindliche Proteine29 bis ms für Domänenbewegungen aufrechterhalten werden, was durch die Pikosekunden-Nanosekunden-Dynamik30 erleichtert werden kann.
Es werden zwei Beispiele für die Verwendung der Neutronenrückstreuspektroskopie zur Untersuchung von Amyloidproteinen vorgestellt, eines im flüssigen Zustand, um die Proteindynamik zu untersuchen, und eines im hydratisierten Pulverzustand, um die Dynamik des Hydratationswassers zu untersuchen. Das erste Beispiel betrifft die Aggregation von Lysozym in μm-große Kügelchen (Partikel genannt), gefolgt in Echtzeit5, und das zweite ein Vergleich der Wasserdynamik in nativen und aggregierten Zuständen des menschlichen Proteins Tau31.
Lysozym ist ein Enzym, das an der Immunabwehr beteiligt ist und aus 129 Aminosäureresten besteht. Lysozym kann in deuteriertem Puffer bei einem pD-Wert von 10,5 und einer Temperatur von 90 °C Partikel bilden. Mit Hilfe der Neutronenstreuung konnten wir zeigen, dass die zeitliche Entwicklung des Massenschwerpunkt-Diffusionskoeffizienten von Lysozym der einzelnen exponentiellen Kinetik der Thioflavin-T-Fluoreszenz folgt (eine Fluoreszenzsonde, die zur Überwachung der Bildung von Amyloid-Kreuz-β-Musternverwendet wird 32), was darauf hindeutet, dass die Bildung von partikulären Überstrukturen und Kreuz-β-Mustern in einem einzigen Schritt mit der gleichen Geschwindigkeit erfolgt. Darüber hinaus blieb die interne Dynamik während des gesamten Aggregationsprozesses konstant, was entweder durch eine schnelle Konformationsänderung erklärt werden kann, die mit NBS-Instrumenten nicht beobachtet werden kann, oder durch das Fehlen einer signifikanten Änderung der internen Proteinenergie bei der Aggregation.
Das menschliche Protein Tau ist ein intrinsisch ungeordnetes Protein (IDP), das aus 441 Aminosäuren für die sogenannte 2N4R-Isoform besteht, die insbesondere an der Alzheimer-Krankheit beteiligt ist33. Mit Hilfe der Neutronenrückstreuung an Pulvern aus perdeuteriertem Proteintau konnten wir zeigen, dass die Dynamik des Hydratationswassers im Faserzustand erhöht ist, wobei eine höhere Population von Wassermolekülen Translationsbewegungen durchläuft. Das Ergebnis deutet darauf hin, dass eine Erhöhung der Entropie des Hydratationswassers das Amyloid-Flimmern von Tau antreiben könnte.
Protocol
Representative Results
Discussion
Die Neutronenspektroskopie ist die einzige Methode, die es ermöglicht, die ensemblegemittelte ps-ns-Dynamik von Proteinproben unabhängig von der Größe des Proteins oder der Komplexität der Lösung bei Verwendung der Deuterierung zu untersuchen6. Insbesondere durch die Untersuchung der Selbstdiffusion von Proteinanordnungen in Lösung kann die hydrodynamische Größe solcher Anordnungen eindeutig bestimmt werden. Nichtsdestotrotz ist die Methode in der Regel durch den geringen Neutronenfluss b…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Die Autoren danken Michaela Zamponi vom Jülich Centre for Neutron Science am Heinz Maier-Leibnitz Zentrum, Garching, für einen Teil der Neutronenstreuexperimente, die mit dem Instrument SPHERES durchgeführt wurden. Diese Arbeit profitierte von den Aktivitäten des Konsortiums Deuteration Laboratory (DLAB), das von der Europäischen Union im Rahmen der Verträge HPRI-2001-50065 und RII3-CT-2003-505925 finanziert wurde, sowie von den vom UK Engineering and Physical Sciences Research Council (EPSRC) finanzierten Aktivitäten innerhalb des Institut Laue Langevin EMBL DLAB im Rahmen der Zuschüsse GR/R99393/01 und EP/C015452/1. Die Unterstützung durch die Europäische Kommission im Rahmen des 7. Rahmenprogramms im Rahmen der Leitaktion zur Stärkung des Europäischen Forschungsraums und der Forschungsinfrastrukturen wird anerkannt [Vertrag 226507 (NMI3)]. Kevin Pounot und Christian Beck danken dem Bundesministerium für Bildung und Forschung (BMBF, Förderkennzeichen 05K19VTB) für die Förderung ihrer Postdoc-Stipendien.
Materials
| Aluminum sample holder | Not commercially available. Either the local contact on the instrument can provide them or they can be manufactured based on a technical drawing that can be provided by the local contact. | ||
| Deuterium chloride, 35 wt. % in D2O, ≥99 atom % D | Sigma-Aldrich | 543047 |
|
| Deuterium oxide (D, 99.9%) | Eurisotop | DLM-4DR-PK | |
| Dow Corning high-vacuum silicone grease | Sigma-Aldrich | Z273554-1EA | |
| Ethanol 96%, EMSURE Reag. Ph Eur | Sigma-Aldrich | 1.5901 | |
| Glass dessicator | VWR | 75871-660 | |
| Glass dessicator plate, 140 mm | VWR | 89038-068 | |
| Indium wire, 1.0 mm (0.04 in) dia, Puratronic, 99.999% | Alfa Aesar | 00470.G1 | |
| Lysozyme from chicken egg white dialyzed, lyophilized, powder, ~100,000 U/mg | Sigma-Aldrich | 62970 | |
| nPDyn | v3.x | see github.com/kpounot/nPDyn, model functions fot fitting also included in the software | |
| OHAUS AX324 Adventurer balance, internal calibration | Dutscher | 92641 | |
| Phosphorus pentoxide, ReagentPlus, 99% | Sigma-Aldrich | 214701 | |
| Pipette ErgoOne 0.5-10 μL | Starlab | S7100-0510 | |
| Pipette ErgoOne 100-1,000 μL | Starlab | S7100-1000 | |
| Pipette ErgoOne 20-200 μL | Starlab | S7100-2200 | |
| Pipette tip TipOne 1,000 μL | Starlab | S1111-6001 | |
| Pipette tip TipOne 10 μL | Starlab | S1111-3200 | |
| Pipette tip TipOne 200 μL | Starlab | S1111-0206 | |
| Sodium deuteroxide solution, 40 wt. % in D2O, 99.5 atom % D | Sigma-Aldrich | 372072 |
Riferimenti
- Jacrot, B. Des neutrons pour la science: Histoire de l’Institut Laue-Langevin. Des neutrons pour la science. EDP Sciences. , (2021).
- Mahieu, E., Gabel, F. Biological small-angle neutron scattering: recent results and development. Acta Crystallographica Section D. 74 (8), 715-726 (2018).
- Grimaldo, M., Roosen-Runge, F., Zhang, F., Schreiber, F., Seydel, T. Dynamics of proteins in solution. Quarterly Reviews of Biophysics. 52, 7 (2019).
- Martel, A., et al. Membrane permeation versus amyloidogenicity: A multitechnique study of islet amyloid polypeptide interaction with model membranes. Journal of the American Chemical Society. 139 (1), 137-148 (2017).
- Pounot, K., et al. Tracking internal and global diffusive dynamics during protein aggregation by high-resolution neutron spectroscopy. The Journal of Physical Chemistry Letters. 11 (15), 6299-6304 (2020).
- Grimaldo, M., et al. Protein short-time diffusion in a naturally crowded environment. The Journal of Physical Chemistry Letters. 10 (8), 1709-1715 (2019).
- Jasnin, M., Stadler, A., Tehei, M., Zaccai, G. Specific cellular water dynamics observed in vivo by neutron scattering and NMR. Physical Chemistry Chemical Physics. 12 (35), 10154-10160 (2010).
- Frick, B. The neutron backscattering spectrometer IN16 at ILL-high energy resolution with high intensity and excellent signal-to-noise ratio. Neutron News. 13 (2), 15-22 (2002).
- Frick, B., Mamontov, E., van Eijck, L., Seydel, T. Recent backscattering instrument developments at the ILL and SNS. Zeitschrift für Physikalische Chemie. 224 (1-2), 33-60 (2010).
- Frick, B., Combet, J., van Eijck, L. New possibilities with inelastic fixed window scans and linear motor Doppler drives on high resolution neutron backscattering spectrometers. Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 669, 7-13 (2012).
- Appel, M., Frick, B., Magerl, A. A flexible high speed pulse chopper system for an inverted neutron time-of-flight option on backscattering spectrometers. Scientific Reports. 8 (1), 13580 (2018).
- Squires, G. L. . Introduction to the theory of thermal neutron scattering. , (1996).
- Singwi, K. S., Sjölander, A. Diffusive motions in water and cold neutron scattering. Physical Review. 119 (3), 863-871 (1960).
- Sears, V. F. Theory of cold neutron scattering by homonuclear diatomic liquids: i. free rotation. Canadian Journal of Physics. 44 (6), 1279-1297 (1966).
- Sears, V. F. Theory of cold neutron scattering by homonuclear liquid: ii. hindered rotation. Canadian Journal of Physics. 44 (6), 1299-1311 (1966).
- Schirò, G., et al. Translational diffusion of hydration water correlates with functional motions in folded and intrinsically disordered proteins. Nature Communications. 6, 6490 (2015).
- Grimaldo, M., et al. Hierarchical molecular dynamics of bovine serum albumin in concentrated aqueous solution below and above thermal denaturation. Physical Chemistry Chemical Physics. 17 (6), 4645-4655 (2015).
- Eanes, E. D., Glenner, G. G. X-ray diffraction studies on amyloid filaments. Journal of Histochemistry & Cytochemistry. 16 (11), 673-677 (1968).
- Bonar, L., Cohen, A. S., Skinner, M. M. Characterization of the Amyloid Fibril as a Cross-β Protein. Proceedings of the Society for Experimental Biology and Medicine. 131 (4), 1373-1375 (1969).
- Chiti, F., Dobson, C. M. Protein Misfolding, Amyloid Formation, and Human Disease: A Summary of Progress Over the Last Decade. Annual Review of Biochemistry. 86 (1), 27-68 (2017).
- Knowles, T. P. J., Vendruscolo, M., Dobson, C. M. The amyloid state and its association with protein misfolding diseases. Nature Reviews Molecular Cell Biology. 15 (6), 384-396 (2014).
- Maji, S. K., et al. Functional amyloids as natural storage of peptide hormones in pituitary secretory granules. Science. 325 (5938), 328-332 (2009).
- Li, J., et al. The RIP1/RIP3 necrosome forms a functional amyloid signaling complex required for programmed necrosis. Cell. 150 (2), 339-350 (2012).
- Knowles, T. P. J., Mezzenga, R. Amyloid fibrils as building blocks for natural and artificial functional materials. Advanced Materials. 28 (31), 6546-6561 (2016).
- Stephens, A. D., Kaminski Schierle, G. S. The role of water in amyloid aggregation kinetics. Current Opinion in Structural Biology. 58, 115-123 (2019).
- Adamcik, J., Mezzenga, R. Amyloid polymorphism in the protein folding and aggregation energy landscape. Angewandte Chemie International Edition. 57 (28), 8370-8382 (2018).
- Liu, Z., et al. Entropic contribution to enhanced thermal stability in the thermostable P450 CYP119. Proceedings of the National Academy of Sciences of the United States of America. 115 (43), 10049-10058 (2018).
- Coquelle, N., et al. Chromophore twisting in the excited state of a photoswitchable fluorescent protein captured by time-resolved serial femtosecond crystallography. Nature Chemistry. 10 (1), 31-37 (2018).
- Henzler-Wildman, K. A., et al. A hierarchy of timescales in protein dynamics is linked to enzyme catalysis. Nature. 450 (7171), 913-916 (2007).
- Fichou, Y., et al. Hydration water mobility is enhanced around tau amyloid fibers. Proceedings of the National Academy of Sciences of the United States of America. 112 (20), 6365-6370 (2015).
- Burns, J., Pennock, C. A., Stoward, P. J. The specificity of the staining of amyloid deposits with thioflavine T. The Journal of Pathology and Bacteriology. 94 (2), 337-344 (1967).
- Iqbal, K., Liu, F., Gong, C. -. X., Grundke-Iqbal, I. Tau in Alzheimer disease and related tauopathies. Current Alzheimer Research. 7 (8), 656-664 (2010).
- Krȩżel, A., Bal, W. A formula for correlating pKa values determined in D2O and H2O. Journal of Inorganic Biochemistry. 98 (1), 161-166 (2004).
- Dolman, M., Halling, P. J., Moore, B. D., Waldron, S. How dry are anhydrous enzymes? Measurement of residual and buried 18O-labeled water molecules using mass spectrometry. Biopolymers. 41 (3), 313-321 (1997).
- Pounot, K. kpounotnPDyn: v3.0.0. Zenodo. , (2021).
- Yi, Z., Miao, Y., Baudry, J., Jain, N., Smith, J. C. Derivation of mean-square displacements for protein dynamics from elastic incoherent neutron scattering. Journal of Physical Chemistry B. 116 (16), 5028-5036 (2012).
- Peters, J., Kneller, G. R. Motional heterogeneity in human acetylcholinesterase revealed by a non-Gaussian model for elastic incoherent neutron scattering. The Journal of Chemical Physics. 139 (16), 165102 (2013).
- Zeller, D., Telling, M. T. F., Zamponi, M., García Sakai, V., Peters, J. Analysis of elastic incoherent neutron scattering data beyond the Gaussian approximation. The Journal of Chemical Physics. 149 (23), 234908 (2018).
- Roosen-Runge, F., Seydel, T. A generalized mean-squared displacement from inelastic fixed window scans of incoherent neutron scattering as a model-free indicator of anomalous diffusion confinement. EPJ Web of Conferences. 83, 02015 (2015).
- Ortega, A., Amorós, D., García de la Torre, J. Prediction of hydrodynamic and other solution properties of rigid proteins from atomic- and residue-level models. Biophysical Journal. 101 (4), 892-898 (2011).
- Hennig, M., Frick, B., Seydel, T. IUCr Optimum velocity of a phase-space transformer for cold-neutron backscattering spectroscopy. Journal of Applied Crystallography. 44 (3), 467-472 (2011).
- Paalman, H. H., Pings, C. J. Numerical evaluation of X-ray absorption factors for cylindrical samples and annular sample cells. Journal of Applied Physics. 33 (8), 2635-2639 (1962).
- Ow, S. -. Y., Dunstan, D. E. The effect of concentration, temperature and stirring on hen egg white lysozyme amyloid formation. Soft Matter. 9 (40), 9692-9701 (2013).
- Tominaga, T., Sahara, M., Kawakita, Y., Nakagawa, H., Yamada, T. Evaluation of sample cell materials for aqueous solutions used in quasi-elastic neutron scattering measurements. Journal of Applied Crystallography. 54 (6), 1631-1640 (2021).
- Beck, C., et al. Following protein dynamics in real time during crystallization. Crystal Growth & Design. 19 (12), 7036-7045 (2019).
- Smith, A. A., Testori, E., Cadalbert, R., Meier, B. H., Ernst, M. Characterization of fibril dynamics on three timescales by solid-state NMR. Journal of Biomolecular NMR. 65 (3-4), 171-191 (2016).
- Wang, T., Jo, H., DeGrado, W. F., Hong, M. Water distribution, dynamics, and interactions with Alzheimer’s β-amyloid fibrils investigated by solid-state NMR. Journal of the American Chemical Society. 139 (17), 6242-6252 (2017).
- Rezaei-Ghaleh, N., Giller, K., Becker, S., Zweckstetter, M. Effect of zinc dinding on β-amyloid structure and dynamics: Implications for Aβ aggregation. Biophysical Journal. 101 (5), 1202-1211 (2011).
- Vugmeyster, L., et al. Fast motions of key methyl groups in amyloid-β fibrils. Biophysical Journal. 111 (10), 2135-2148 (2016).
- Yang, X., Wang, B., Hoop, C. L., Williams, J. K., Baum, J. NMR unveils an N-terminal interaction interface on acetylated-α-synuclein monomers for recruitment to fibrils. Proceedings of the National Academy of Sciences of the United States of America. 118 (18), (2021).
- Tuttle, M. D., et al. Solid-state NMR structure of a pathogenic fibril of full-length human α-synuclein. Nature Structural & Molecular Biology. 23 (5), 409-415 (2016).
- Karamanos, T. K., Kalverda, A. P., Thompson, G. S., Radford, S. E. Mechanisms of amyloid formation revealed by solution NMR. Progress in Nuclear Magnetic Resonance Spectroscopy. 88-89, 86-104 (2015).
- Lai, Y. -. C., Kuo, Y. -. H., Chiang, Y. -. W. Identifying protein conformational dynamics using spin-label ESR. Chemistry – An Asian Journal. 14 (22), 3981-3991 (2019).
- Franck, J. M., Han, S. Overhauser dynamic nuclear polarization for the study of hydration dynamics, explained. Methods in Enzymology. 615, 131-175 (2019).
- Pavlova, A., et al. Protein structural and surface water rearrangement constitute major events in the earliest aggregation stages of tau. Proceedings of the National Academy of Sciences of the United States of America. 113 (2), 127-136 (2016).
- Lin, Y., et al. Liquid-liquid phase separation of tau driven by hydrophobic interaction facilitates fibrillization of tau. bioRxiv. , (2020).
- Decatur, S. M. Elucidation of residue-level structure and dynamics of polypeptides via isotope-edited infrared spectroscopy. Accounts of Chemical Research. 39 (3), 169-175 (2006).
- Chatani, E., Tsuchisaka, Y., Masuda, Y., Water Tsenkova, R. molecular system dynamics associated with amyloidogenic nucleation as revealed by real time near infrared spectroscopy and aquaphotomics. PLoS One. 9 (7), 101997 (2014).
- Goret, G., Aoun, B., Pellegrini, E. MDANSE: An interactive analysis environment for molecular dynamics simulations. Journal of Chemical Information and Modeling. 57 (1), 1-5 (2017).
- Fujiwara, S., et al. Internal dynamics of a protein that forms the amyloid fibrils observed by neutron scattering. Journal of the Physical Society of Japan. 82, (2013).
- Schiró, G., et al. Neutron scattering reveals enhanced protein dynamics in concanavalin a amyloid fibrils. Journal of Physical Chemistry Letters. 3 (8), 992-996 (2012).
- Pounot, K., et al. Zinc determines dynamical properties and aggregation kinetics of human insulin. Biophysical Journal. 120 (5), 886-898 (2021).
- Fujiwara, S., et al. Dynamic properties of human α-synuclein related to propensity to amyloid fibril formation. Journal of Molecular Biology. 431 (17), 3229-3245 (2019).
- Sanz, A., et al. High-pressure cell for simultaneous dielectric and neutron spectroscopy. Review of Scientific Instruments. 89 (2), 023904 (2018).
- Adams, M. A., et al. Simultaneous neutron scattering and Raman scattering. Applied Spectroscopy. 63 (7), 727-732 (2009).

