प्रोटीन और हाइड्रेशन पानी के पिकोसेकंड-नैनोसेकंड डायनामिक्स का अध्ययन करने के लिए उच्च-रिज़ॉल्यूशन न्यूट्रॉन स्पेक्ट्रोस्कोपी
Summary
न्यूट्रॉन बैकस्कैटरिंग स्पेक्ट्रोस्कोपी प्रोटीन और उनके हाइड्रेशन पानी के पीएस-एनएस गतिशीलता के लिए एक गैर-विनाशकारी और लेबल-मुक्त पहुंच प्रदान करता है। वर्कफ़्लो को एमिलॉयड प्रोटीन पर दो अध्ययनों के साथ प्रस्तुत किया गया है: एकत्रीकरण के दौरान लाइसोजाइम की समय-हल गतिशीलता पर और फाइबर गठन पर ताऊ के जलयोजन जल गतिशीलता पर।
Abstract
न्यूट्रॉन प्रकीर्णन एक गैर-विनाशकारी तरीके से और ड्यूटेरियम के अलावा अन्य लेबलिंग के बिना ऊर्जा की एक विस्तृत श्रृंखला के लिए नमूनों के भीतर गतिशीलता की जांच करने की संभावना प्रदान करता है। विशेष रूप से, न्यूट्रॉन बैकस्कैटरिंग स्पेक्ट्रोस्कोपी एक साथ कई प्रकीर्णन कोणों पर प्रकीर्णन संकेतों को रिकॉर्ड करता है और पीएस-एनएस टाइमस्केल पर जैविक प्रणालियों की गतिशीलता का अध्ययन करने के लिए अच्छी तरह से अनुकूल है। डी2ओ-और संभवतः ड्यूरेटेड बफर घटकों को नियोजित करके- विधि तरल अवस्था में प्रोटीन के केंद्र-द्रव्यमान प्रसार और रीढ़ और साइड-चेन गति (आंतरिक गतिशीलता) दोनों की निगरानी की अनुमति देती है।
इसके अतिरिक्त, हाइड्रेशन पानी की गतिशीलता का अध्ययन एच2ओ के साथ हाइड्रेटेड परड्यूरेटेड प्रोटीन के पाउडर को नियोजित करके किया जा सकता है। यह पेपर प्रोटीन और हाइड्रेशन पानी की गतिशीलता की जांच के लिए इंस्टीट्यूट लाउ-लैंगविन (आईएल) में उपकरण आईएन 16 बी पर नियोजित वर्कफ़्लो प्रस्तुत करता है। वाष्प विनिमय का उपयोग करके समाधान नमूने और हाइड्रेटेड प्रोटीन पाउडर के नमूने तैयार करने को समझाया गया है। प्रोटीन और हाइड्रेशन पानी की गतिशीलता दोनों के लिए डेटा विश्लेषण प्रक्रिया विभिन्न प्रकार के डेटासेट (क्वासिइलास्टिक स्पेक्ट्रा या फिक्स्ड-विंडो स्कैन) के लिए वर्णित है जिसे न्यूट्रॉन बैकस्कैटरिंग स्पेक्ट्रोमीटर पर प्राप्त किया जा सकता है।
विधि को अमाइलॉइड प्रोटीन से जुड़े दो अध्ययनों के साथ चित्रित किया गया है। लाइसोजाइम का एकत्रीकरण μm आकार के गोलाकार समुच्चय-निरूपित कणों में होता है- IN16B पर जांच की गई अंतरिक्ष और समय सीमा पर एक-चरण यी प्रक्रिया में होता है, जबकि आंतरिक गतिशीलता अपरिवर्तित रहती है। इसके अलावा, ताऊ के हाइड्रेशन पानी की गतिशीलता का अध्ययन परड्यूरेटेड प्रोटीन के हाइड्रेटेड पाउडर पर किया गया था। यह दिखाया गया है कि अमाइलॉइड फाइबर के गठन पर पानी की ट्रांसलेशनल गतियां सक्रिय होती हैं। अंत में, प्रोटोकॉल में महत्वपूर्ण चरणों पर चर्चा की जाती है कि अन्य प्रयोगात्मक बायोफिज़िकल विधियों के संबंध में गतिशीलता के अध्ययन के संबंध में न्यूट्रॉन प्रकीर्णन कैसे तैनात किया जाता है।
Introduction
न्यूट्रॉन एक चार्ज-लेस और विशाल कण है जिसका उपयोग मौलिक भौतिकी से जीव विज्ञान1 तक विभिन्न क्षेत्रों में नमूनों की जांच के लिए वर्षों से सफलतापूर्वक किया गया है। जैविक अनुप्रयोगों के लिए, छोटे-कोण न्यूट्रॉन प्रकीर्णन, इनलेस्टिक न्यूट्रॉन प्रकीर्णन, और न्यूट्रॉन क्रिस्टलोग्राफी और रिफ्लेक्टोमेट्री का बड़े पैमानेपर उपयोग किया जाता है2,3,4। इनलेस्टिक न्यूट्रॉन प्रकीर्णन विशिष्ट लेबलिंग की आवश्यकता के बिना गतिशीलता का एक पहनावा-औसत माप प्रदान करता है, और एक संकेत गुणवत्ता जो आकार या प्रोटीन5 पर निर्भर नहीं करती है। माप अध्ययन के तहत प्रोटीन के लिए एक अत्यधिक जटिल वातावरण का उपयोग करके किया जा सकता है जो इंट्रासेल्युलर माध्यम की नकल करता है, जैसे कि ड्यूरेटेड बैक्टीरियल लाइसेट या यहां तक कि विवो 3,6,7 में भी। गतिशीलता का अध्ययन करने के लिए विभिन्न प्रयोगात्मक सेटअपों का उपयोग किया जा सकता है, अर्थात् i) उड़ान का समय-उप-पीएस-पीएस गतिशीलता तक पहुंच प्रदान करना, ii) बैकस्कैटरिंग-पीएस-एनएस गतिशीलता तक पहुंच प्रदान करना, और iii) स्पिन-इको-एनएस से सैकड़ों एनएस तक गतिशीलता तक पहुंच प्रदान करना। न्यूट्रॉन बैकस्कैटरिंग ब्रैग के नियम 2 d sinø = n’ का उपयोग करता है, जहां d एक क्रिस्टल में विमानों के बीच की दूरी है, प्रकीर्णन कोण, n प्रकीर्णन क्रम और o तरंग दैर्ध्य है। डिटेक्टरों की ओर बैकस्कैटरिंग के लिए क्रिस्टल का उपयोग ऊर्जा में उच्च रिज़ॉल्यूशन प्राप्त करने की अनुमति देता है, आमतौर पर ~ 0.8 μeV। ऊर्जा विनिमय को मापने के लिए, या तो बैकस्कैटरिंग में एक क्रिस्टल ले जाने वाले डॉपलर ड्राइव का उपयोग आने वाले न्यूट्रॉन तरंग दैर्ध्य 8,9,10 (चित्रा 1) को परिभाषित करने और ट्यून करने के लिए किया जाता है, या ऊर्जा रिज़ॉल्यूशन11 में कमी की कीमत पर टाइम-ऑफ-फ्लाइट सेटअप का उपयोग किया जा सकता है।
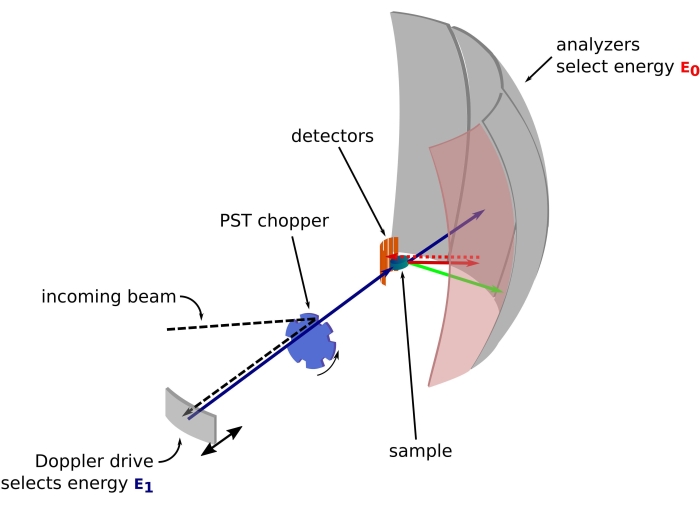
चित्रा 1: डॉपलर ड्राइव के साथ न्यूट्रॉन बैकस्कैटरिंग स्पेक्ट्रोमीटर का स्केच। आने वाली बीम फेज स्पेस ट्रांसफॉर्मेशन (पीएसटी) हेलिकॉप्टर42 से टकराती है, जो सैंपल पोजिशन पर फ्लक्स को बढ़ा देती है। फिर इसे डॉपलर ड्राइव द्वारा नमूने की ओर वापस बिखेर दिया जाता है, जो एक ऊर्जा ई1 (सियान तीर) का चयन करता है। न्यूट्रॉन तब नमूने द्वारा बिखरे हुए होते हैं (तीर ों के रंग द्वारा दर्शाए गए विभिन्न ऊर्जाओं के साथ) और एसआई 111 क्रिस्टल से बने विश्लेषक, केवल एक विशिष्ट ऊर्जा ई0 (लाल रंग के तीर यहां) के साथ न्यूट्रॉन को बैकस्कैटर करेंगे। इसलिए, संवेग स्थानांतरण क्यू डिटेक्टर सरणी पर न्यूट्रॉन की पता लगाई गई स्थिति से प्राप्त किया जाता है, और ऊर्जा हस्तांतरण अंतर ई1– ई0 से प्राप्त किया जाता है। पीएसटी द्वारा उत्पादित न्यूट्रॉन पल्स के लिए अपेक्षित उड़ान के समय का उपयोग डिटेक्टर ट्यूबों की ओर सीधे बिखरे न्यूट्रॉन से सिग्नल को त्यागने के लिए किया जाता है। संक्षिप्त नाम: पीएसटी = चरण अंतरिक्ष परिवर्तन। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
बैकस्कैटरिंग स्पेक्ट्रोस्कोपी के लिए, हाइड्रोजन प्रोटॉन युक्त नमूने, जैसे प्रोटीन से संकेत में मुख्य योगदान असंगत प्रकीर्णन से आता है, जिसके लिए प्रकीर्णन तीव्रता एसइंक (क्यू, ) को ईक्यू (1)12 द्वारा दिखाया गया है।
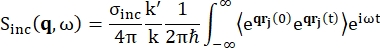 (1)
(1)
जहाँ σइंक तत्व का असंगत क्रॉस-सेक्शन माना जाता है, k बिखरे हुए वेववेक्टर का आदर्श है, k आने वाले वेववेक्टर का आदर्श है, q (= k – k’) संवेग अंतरण, r j(t) समय t पर परमाणु j का स्थिति वेक्टर है, और आने वाले न्यूट्रॉन और सिस्टम के बीच ऊर्जा हस्तांतरण के अनुरूप आवृत्ति है। कोणीय कोष्ठक पहनावा औसत को दर्शाता है। इसलिए, असंगत प्रकीर्णन समय के साथ परमाणु स्थितियों के समरूप-औसत एकल-कण आत्म-सहसंबंध की जांच करता है और सिस्टम में सभी परमाणुओं और विभिन्न समय उत्पत्ति (पहनावा औसत) पर औसत आत्म-गतिशीलता देता है। प्रकीर्णन फ़ंक्शन मध्यवर्ती प्रकीर्णन फ़ंक्शन I (q, t) के समय में फूरियर ट्रांसफॉर्म है, जिसे Eq (2) द्वारा दिखाए गए वैन होव सहसंबंध फ़ंक्शन के स्थान में फूरियर ट्रांसफॉर्म के रूप में देखा जा सकता है:
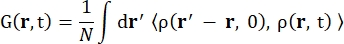 (2)
(2)
जहां स्थिति r और समय t13 पर एक परमाणु को खोजने की संभाव्यता घनत्व है।
एक फिकियन प्रसार प्रक्रिया के लिए, स्व-प्रसार फ़ंक्शन का परिणाम (Eq (3)) एक प्रकीर्णन फ़ंक्शन में डबल फूरियर ट्रांसफॉर्म के बाद होता है जिसमें γ = Dq2 द्वारा दी गई लाइन चौड़ाई का लोरेंत्ज़ियन होता है।
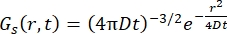 (3)
(3)
अधिक परिष्कृत मॉडल विकसित किए गए और उपयोगी पाए गए जैसे कि पीएस-एनएस आंतरिक प्रोटीन गतिशीलता14 के लिए सिंगवी और स्जोलैंडर द्वारा कूद प्रसार मॉडल या हाइड्रेशन पानी15,16,17 के लिए सियर्स द्वारा रोटेशन मॉडल।
आईएल, ग्रेनोबल, फ्रांस (पूरक चित्रा एस 1) में न्यूट्रॉन बैकस्कैटरिंग (एनबीएस) उपकरण आईएन 16 बी8,9 पर, आमतौर पर प्रोटीन के साथ उपयोग किए जाने वाले सेटअप में आने वाली तरंग दैर्ध्य (पूरक चित्रा एस 2 ए) को ट्यून करने के लिए डॉपलर ड्राइव के साथ विश्लेषक के लिए एसआई 111 क्रिस्टल होते हैं, जिससे गति हस्तांतरण सीमा ~ 0.2 A-1 < q < ~ 2 A-1 और –30 μeV की ऊर्जा हस्तांतरण सीमा तक पहुंच मिलती है< 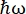 < 30 μeV- कुछ ps से लेकर कुछ ns तक के टाइमस्केल और कुछ A की दूरी के अनुरूप है। इसके अलावा, IN16B लोचदार और इनलेस्टिक फिक्स्ड-विंडो स्कैन (E / IFWS) 10 करने की संभावना प्रदान करता है, जिसमें एक निश्चित ऊर्जा हस्तांतरण पर डेटा अधिग्रहण शामिल है। चूंकि न्यूट्रॉन के साथ काम करते समय फ्लक्स सीमित होता है, इसलिए ई / आईएफडब्ल्यूएस एक ऊर्जा हस्तांतरण के लिए प्रवाह को अधिकतम करने की अनुमति देता है, इस प्रकार संतोषजनक सिग्नल-टू-शोर अनुपात प्राप्त करने के लिए आवश्यक अधिग्रहण समय को कम करता है। एक और हालिया विकल्प बैकस्कैटरिंग और टाइम-ऑफ-फ्लाइट स्पेक्ट्रोमीटर (बीएटीएस) मोड11 है, जो डॉपलर ड्राइव की तुलना में उच्च प्रवाह के साथ ऊर्जा हस्तांतरण की एक विस्तृत श्रृंखला (जैसे, -150 μeV <
< 30 μeV- कुछ ps से लेकर कुछ ns तक के टाइमस्केल और कुछ A की दूरी के अनुरूप है। इसके अलावा, IN16B लोचदार और इनलेस्टिक फिक्स्ड-विंडो स्कैन (E / IFWS) 10 करने की संभावना प्रदान करता है, जिसमें एक निश्चित ऊर्जा हस्तांतरण पर डेटा अधिग्रहण शामिल है। चूंकि न्यूट्रॉन के साथ काम करते समय फ्लक्स सीमित होता है, इसलिए ई / आईएफडब्ल्यूएस एक ऊर्जा हस्तांतरण के लिए प्रवाह को अधिकतम करने की अनुमति देता है, इस प्रकार संतोषजनक सिग्नल-टू-शोर अनुपात प्राप्त करने के लिए आवश्यक अधिग्रहण समय को कम करता है। एक और हालिया विकल्प बैकस्कैटरिंग और टाइम-ऑफ-फ्लाइट स्पेक्ट्रोमीटर (बीएटीएस) मोड11 है, जो डॉपलर ड्राइव की तुलना में उच्च प्रवाह के साथ ऊर्जा हस्तांतरण की एक विस्तृत श्रृंखला (जैसे, -150 μeV < 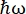 < 150 μeV) के माप की अनुमति देता है, फिर भी कम ऊर्जा रिज़ॉल्यूशन (पूरक चित्रा S2B) की लागत पर।
< 150 μeV) के माप की अनुमति देता है, फिर भी कम ऊर्जा रिज़ॉल्यूशन (पूरक चित्रा S2B) की लागत पर।
न्यूट्रॉन प्रकीर्णन का एक महत्वपूर्ण गुण यह है किइंक σ असंगत क्रॉस सेक्शन में ड्यूटेरियम की तुलना में हाइड्रोजन के लिए 40 गुना अधिक मूल्य होता है और आमतौर पर जैविक नमूनों में पाए जाने वाले अन्य तत्वों के लिए नगण्य होता है। इसलिए, एक तरल वातावरण में प्रोटीन की गतिशीलता का अध्ययन ड्यूरेटेड बफर का उपयोग करके किया जा सकता है, और पाउडर अवस्था डी 2 ओ के साथ हाइड्रेटेड हाइड्रोजनीकृत प्रोटीन पाउडर के साथ प्रोटीन आंतरिक गतिशीलता के अध्ययनकी अनुमति देती है, या एच2ओ के साथ हाइड्रेटेड प्रोटीन पाउडर के लिए हाइड्रेशन पानी का अध्ययन करती है। तरल अवस्था में, न्यूट्रॉन बैकस्कैटरिंग आमतौर पर प्रोटीन (फिकियन-प्रकार प्रसार) और उनकी आंतरिक गतिशीलता के केंद्र-द्रव्यमान आत्म-प्रसार तक पहुंचने की अनुमति देता है। उत्तरार्द्ध रीढ़ की हड्डी और साइड-चेन गतियां हैं जिन्हें आमतौर पर तथाकथित कूद प्रसार मॉडल या अन्य 3,18 द्वारा वर्णित किया जाता है। हाइड्रोजनीकृत प्रोटीन पाउडर में, प्रोटीन प्रसार अनुपस्थित है और केवल आंतरिक गतिशीलता को मॉडलिंग करने की आवश्यकता है। हाइड्रेशन पानी के लिए, पानी के अणुओं के ट्रांसलेशनल और घूर्णी गति का योगदान गति हस्तांतरण क्यू पर एक अलग निर्भरता प्रस्तुत करता है, जो डेटा विश्लेषण प्रक्रिया17 में उनके भेद की अनुमति देता है।
यह पेपर न्यूट्रॉन बैकस्कैटरिंग विधि को प्रोटीन के अध्ययन के साथ दिखाता है जो β-स्ट्रैंड के ढेर से युक्त एक कैननिकल रूप में एकत्रित होते हैं- तथाकथित क्रॉस-β पैटर्न19,20– और लम्बी फाइबर बनाते हैं। यह तथाकथित अमाइलॉइड एकत्रीकरण है, जिसका अल्जाइमर या पार्किंसंस रोग21,22 जैसे न्यूरोडीजेनेरेटिव विकारों में इसकी केंद्रीय भूमिका के कारण बड़े पैमाने पर अध्ययन किया जाता है। अमाइलॉइड प्रोटीन का अध्ययन उस कार्यात्मक भूमिका से भी प्रेरित है जो वे 23,24 या उपन्यास बायोमैटेरियल्स25 के विकास के लिए उनकी उच्च क्षमता निभा सकते हैं। अमाइलॉइड एकत्रीकरण के भौतिक रासायनिक निर्धारक अस्पष्ट रहते हैं, और पिछले वर्षों21,26 के दौरान जबरदस्त प्रगति के बावजूद अमाइलॉइड एकत्रीकरण का कोई सामान्य सिद्धांत उपलब्ध नहीं है।
अमाइलॉइड एकत्रीकरण का तात्पर्य समय के साथ प्रोटीन संरचना और स्थिरता में परिवर्तन से है, जिसका अध्ययन स्वाभाविक रूप से गतिशीलता का तात्पर्य है, जो प्रोटीन रचना स्थिरता, प्रोटीन फ़ंक्शन और प्रोटीन ऊर्जा परिदृश्य27 से जुड़ा हुआ है। डायनामिक्स को सबसे तेज गति28 के लिए एंट्रोपिक योगदान के माध्यम से एक विशिष्ट राज्य की स्थिरता से सीधे जोड़ा जाता है, और प्रोटीन फ़ंक्शन को डोमेन गतियों के लिए प्रकाश-संवेदनशील प्रोटीन29 से एमएस के लिए उप-पीएस से विभिन्न टाइमस्केल पर गति द्वारा बनाए रखा जा सकता है, जिसे पिकोसेकंड-नैनोसेकंड डायनामिक्स30 द्वारा सुविधाजनक बनाया जा सकता है।
अमाइलॉइड प्रोटीन का अध्ययन करने के लिए न्यूट्रॉन बैकस्कैटरिंग स्पेक्ट्रोस्कोपी का उपयोग करने के दो उदाहरण प्रस्तुत किए जाएंगे, एक प्रोटीन गतिशीलता का अध्ययन करने के लिए तरल अवस्था में और एक हाइड्रेशन पानी की गतिशीलता का अध्ययन करने के लिए हाइड्रेटेड पाउडर अवस्था में। पहला उदाहरण लाइसोजाइम के एकत्रीकरण को μm आकार के गोले (जिसे कण कहा जाता है) में वास्तविक समय5 में पालन किया जाता है, और दूसरा मानव प्रोटीन ताऊ31 के देशी और समेकित राज्यों में पानी की गतिशीलता की तुलना से संबंधित है।
लाइसोजाइम प्रतिरक्षा रक्षा में शामिल एक एंजाइम है और 129 अमीनो एसिड अवशेषों से बना है। लाइसोजाइम 10.5 के पीएच पर और 90 डिग्री सेल्सियस के तापमान पर ड्यूरेटेड बफर में कण बना सकता है। न्यूट्रॉन प्रकीर्णन के साथ, हमने दिखाया कि लाइसोजाइम के केंद्र-द्रव्यमान प्रसार गुणांक का समय विकास थियोफ्लेविन टी फ्लोरेसेंस (एक फ्लोरोसेंट जांच जिसका उपयोग एमिलॉयड क्रॉस-β पैटर्न32 के गठन की निगरानी के लिए किया जाता है) के एकल घातीय कैनेटीक्स का अनुसरण करता है, यह दर्शाता है कि गठन कण सुपरस्ट्रक्चर और क्रॉस-β पैटर्न एक ही दर के साथ एक ही चरण में होते हैं। इसके अलावा, एकत्रीकरण प्रक्रिया के दौरान आंतरिक गतिशीलता स्थिर रही, जिसे या तो एक तेजी से संवहन परिवर्तन द्वारा समझाया जा सकता है जिसे एनबीएस उपकरणों पर नहीं देखा जा सकता है, या एकत्रीकरण पर प्रोटीन आंतरिक ऊर्जा में महत्वपूर्ण परिवर्तन की अनुपस्थिति से।
मानव प्रोटीन ताऊ एक आंतरिक रूप से अव्यवस्थित प्रोटीन (आईडीपी) है जिसमें तथाकथित 2 एन 4 आर आइसोफॉर्म के लिए 441 अमीनो एसिड शामिल हैं, जो विशेष रूप से अल्जाइमर रोग33 में शामिल है। पर्ड्यूरेटेड प्रोटीन ताऊ के पाउडर पर न्यूट्रॉन बैकस्कैटरिंग का उपयोग करते हुए, हमने दिखाया कि फाइबर अवस्था में हाइड्रेशन पानी की गतिशीलता बढ़ जाती है, जिसमें ट्रांसलेशनल गति से गुजरने वाले पानी के अणुओं की उच्च आबादी होती है। परिणाम बताते हैं कि हाइड्रेशन वाटर एन्ट्रॉपी में वृद्धि ताऊ के एमिलॉयड फाइब्रिलेशन को चला सकती है।
Protocol
Representative Results
Discussion
न्यूट्रॉन स्पेक्ट्रोस्कोपी एकमात्र विधि है जो प्रोटीन के आकार या समाधान की जटिलता की परवाह किए बिना प्रोटीन नमूनों के पहनावा-औसत पीएस-एनएस गतिशीलता की जांच करने की अनुमति देतीहै। विशेष रूप ?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
लेखक उपकरण स्फीयर्स पर किए गए न्यूट्रॉन प्रकीर्णन प्रयोगों के हिस्से के लिए जर्मनी के गार्चिंग के हेंज मैयर-लीबनिट्ज जेंट्रम में जुलिच सेंटर फॉर न्यूट्रॉन साइंस में माइकला ज़म्पोनी के आभारी हैं। इस कार्य को अनुबंध एचपीआरआई-2001-50065 और आरआईआई3-सीटी-2003-505925 के तहत यूरोपीय संघ द्वारा वित्त पोषित ड्यूटेरेशन लेबोरेटरी (डीएलएबी) कंसोर्टियम की गतिविधियों और अनुदान जीआर/आर 99393/01 और ईपी/C015452/1 के तहत इंस्टीट्यूट लॉ लैंगविन ईएमबीएल डीएलएबी के भीतर यूके इंजीनियरिंग एंड फिजिकल साइंसेज रिसर्च काउंसिल (ईपीएसआरसी) द्वारा वित्त पोषित गतिविधि से लाभ हुआ है। प्रमुख कार्रवाई के माध्यम से 7 वें फ्रेमवर्क कार्यक्रम के तहत यूरोपीय आयोग द्वारा समर्थन: यूरोपीय अनुसंधान क्षेत्र को मजबूत करना, अनुसंधान बुनियादी ढांचे को स्वीकार किया जाता है [अनुबंध 226507 (एनएमआई 3)]। केविन पॉनोट और क्रिश्चियन बेक अपने पोस्टडॉक्टरल फैलोशिप के वित्तपोषण के लिए संघीय शिक्षा और अनुसंधान मंत्रालय (बीएमबीएफ, अनुदान संख्या 05के19वीटीबी) को धन्यवाद देते हैं।
Materials
| Aluminum sample holder | Not commercially available. Either the local contact on the instrument can provide them or they can be manufactured based on a technical drawing that can be provided by the local contact. | ||
| Deuterium chloride, 35 wt. % in D2O, ≥99 atom % D | Sigma-Aldrich | 543047 |
|
| Deuterium oxide (D, 99.9%) | Eurisotop | DLM-4DR-PK | |
| Dow Corning high-vacuum silicone grease | Sigma-Aldrich | Z273554-1EA | |
| Ethanol 96%, EMSURE Reag. Ph Eur | Sigma-Aldrich | 1.5901 | |
| Glass dessicator | VWR | 75871-660 | |
| Glass dessicator plate, 140 mm | VWR | 89038-068 | |
| Indium wire, 1.0 mm (0.04 in) dia, Puratronic, 99.999% | Alfa Aesar | 00470.G1 | |
| Lysozyme from chicken egg white dialyzed, lyophilized, powder, ~100,000 U/mg | Sigma-Aldrich | 62970 | |
| nPDyn | v3.x | see github.com/kpounot/nPDyn, model functions fot fitting also included in the software | |
| OHAUS AX324 Adventurer balance, internal calibration | Dutscher | 92641 | |
| Phosphorus pentoxide, ReagentPlus, 99% | Sigma-Aldrich | 214701 | |
| Pipette ErgoOne 0.5-10 μL | Starlab | S7100-0510 | |
| Pipette ErgoOne 100-1,000 μL | Starlab | S7100-1000 | |
| Pipette ErgoOne 20-200 μL | Starlab | S7100-2200 | |
| Pipette tip TipOne 1,000 μL | Starlab | S1111-6001 | |
| Pipette tip TipOne 10 μL | Starlab | S1111-3200 | |
| Pipette tip TipOne 200 μL | Starlab | S1111-0206 | |
| Sodium deuteroxide solution, 40 wt. % in D2O, 99.5 atom % D | Sigma-Aldrich | 372072 |
Riferimenti
- Jacrot, B. Des neutrons pour la science: Histoire de l’Institut Laue-Langevin. Des neutrons pour la science. EDP Sciences. , (2021).
- Mahieu, E., Gabel, F. Biological small-angle neutron scattering: recent results and development. Acta Crystallographica Section D. 74 (8), 715-726 (2018).
- Grimaldo, M., Roosen-Runge, F., Zhang, F., Schreiber, F., Seydel, T. Dynamics of proteins in solution. Quarterly Reviews of Biophysics. 52, 7 (2019).
- Martel, A., et al. Membrane permeation versus amyloidogenicity: A multitechnique study of islet amyloid polypeptide interaction with model membranes. Journal of the American Chemical Society. 139 (1), 137-148 (2017).
- Pounot, K., et al. Tracking internal and global diffusive dynamics during protein aggregation by high-resolution neutron spectroscopy. The Journal of Physical Chemistry Letters. 11 (15), 6299-6304 (2020).
- Grimaldo, M., et al. Protein short-time diffusion in a naturally crowded environment. The Journal of Physical Chemistry Letters. 10 (8), 1709-1715 (2019).
- Jasnin, M., Stadler, A., Tehei, M., Zaccai, G. Specific cellular water dynamics observed in vivo by neutron scattering and NMR. Physical Chemistry Chemical Physics. 12 (35), 10154-10160 (2010).
- Frick, B. The neutron backscattering spectrometer IN16 at ILL-high energy resolution with high intensity and excellent signal-to-noise ratio. Neutron News. 13 (2), 15-22 (2002).
- Frick, B., Mamontov, E., van Eijck, L., Seydel, T. Recent backscattering instrument developments at the ILL and SNS. Zeitschrift für Physikalische Chemie. 224 (1-2), 33-60 (2010).
- Frick, B., Combet, J., van Eijck, L. New possibilities with inelastic fixed window scans and linear motor Doppler drives on high resolution neutron backscattering spectrometers. Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 669, 7-13 (2012).
- Appel, M., Frick, B., Magerl, A. A flexible high speed pulse chopper system for an inverted neutron time-of-flight option on backscattering spectrometers. Scientific Reports. 8 (1), 13580 (2018).
- Squires, G. L. . Introduction to the theory of thermal neutron scattering. , (1996).
- Singwi, K. S., Sjölander, A. Diffusive motions in water and cold neutron scattering. Physical Review. 119 (3), 863-871 (1960).
- Sears, V. F. Theory of cold neutron scattering by homonuclear diatomic liquids: i. free rotation. Canadian Journal of Physics. 44 (6), 1279-1297 (1966).
- Sears, V. F. Theory of cold neutron scattering by homonuclear liquid: ii. hindered rotation. Canadian Journal of Physics. 44 (6), 1299-1311 (1966).
- Schirò, G., et al. Translational diffusion of hydration water correlates with functional motions in folded and intrinsically disordered proteins. Nature Communications. 6, 6490 (2015).
- Grimaldo, M., et al. Hierarchical molecular dynamics of bovine serum albumin in concentrated aqueous solution below and above thermal denaturation. Physical Chemistry Chemical Physics. 17 (6), 4645-4655 (2015).
- Eanes, E. D., Glenner, G. G. X-ray diffraction studies on amyloid filaments. Journal of Histochemistry & Cytochemistry. 16 (11), 673-677 (1968).
- Bonar, L., Cohen, A. S., Skinner, M. M. Characterization of the Amyloid Fibril as a Cross-β Protein. Proceedings of the Society for Experimental Biology and Medicine. 131 (4), 1373-1375 (1969).
- Chiti, F., Dobson, C. M. Protein Misfolding, Amyloid Formation, and Human Disease: A Summary of Progress Over the Last Decade. Annual Review of Biochemistry. 86 (1), 27-68 (2017).
- Knowles, T. P. J., Vendruscolo, M., Dobson, C. M. The amyloid state and its association with protein misfolding diseases. Nature Reviews Molecular Cell Biology. 15 (6), 384-396 (2014).
- Maji, S. K., et al. Functional amyloids as natural storage of peptide hormones in pituitary secretory granules. Science. 325 (5938), 328-332 (2009).
- Li, J., et al. The RIP1/RIP3 necrosome forms a functional amyloid signaling complex required for programmed necrosis. Cell. 150 (2), 339-350 (2012).
- Knowles, T. P. J., Mezzenga, R. Amyloid fibrils as building blocks for natural and artificial functional materials. Advanced Materials. 28 (31), 6546-6561 (2016).
- Stephens, A. D., Kaminski Schierle, G. S. The role of water in amyloid aggregation kinetics. Current Opinion in Structural Biology. 58, 115-123 (2019).
- Adamcik, J., Mezzenga, R. Amyloid polymorphism in the protein folding and aggregation energy landscape. Angewandte Chemie International Edition. 57 (28), 8370-8382 (2018).
- Liu, Z., et al. Entropic contribution to enhanced thermal stability in the thermostable P450 CYP119. Proceedings of the National Academy of Sciences of the United States of America. 115 (43), 10049-10058 (2018).
- Coquelle, N., et al. Chromophore twisting in the excited state of a photoswitchable fluorescent protein captured by time-resolved serial femtosecond crystallography. Nature Chemistry. 10 (1), 31-37 (2018).
- Henzler-Wildman, K. A., et al. A hierarchy of timescales in protein dynamics is linked to enzyme catalysis. Nature. 450 (7171), 913-916 (2007).
- Fichou, Y., et al. Hydration water mobility is enhanced around tau amyloid fibers. Proceedings of the National Academy of Sciences of the United States of America. 112 (20), 6365-6370 (2015).
- Burns, J., Pennock, C. A., Stoward, P. J. The specificity of the staining of amyloid deposits with thioflavine T. The Journal of Pathology and Bacteriology. 94 (2), 337-344 (1967).
- Iqbal, K., Liu, F., Gong, C. -. X., Grundke-Iqbal, I. Tau in Alzheimer disease and related tauopathies. Current Alzheimer Research. 7 (8), 656-664 (2010).
- Krȩżel, A., Bal, W. A formula for correlating pKa values determined in D2O and H2O. Journal of Inorganic Biochemistry. 98 (1), 161-166 (2004).
- Dolman, M., Halling, P. J., Moore, B. D., Waldron, S. How dry are anhydrous enzymes? Measurement of residual and buried 18O-labeled water molecules using mass spectrometry. Biopolymers. 41 (3), 313-321 (1997).
- Pounot, K. kpounotnPDyn: v3.0.0. Zenodo. , (2021).
- Yi, Z., Miao, Y., Baudry, J., Jain, N., Smith, J. C. Derivation of mean-square displacements for protein dynamics from elastic incoherent neutron scattering. Journal of Physical Chemistry B. 116 (16), 5028-5036 (2012).
- Peters, J., Kneller, G. R. Motional heterogeneity in human acetylcholinesterase revealed by a non-Gaussian model for elastic incoherent neutron scattering. The Journal of Chemical Physics. 139 (16), 165102 (2013).
- Zeller, D., Telling, M. T. F., Zamponi, M., García Sakai, V., Peters, J. Analysis of elastic incoherent neutron scattering data beyond the Gaussian approximation. The Journal of Chemical Physics. 149 (23), 234908 (2018).
- Roosen-Runge, F., Seydel, T. A generalized mean-squared displacement from inelastic fixed window scans of incoherent neutron scattering as a model-free indicator of anomalous diffusion confinement. EPJ Web of Conferences. 83, 02015 (2015).
- Ortega, A., Amorós, D., García de la Torre, J. Prediction of hydrodynamic and other solution properties of rigid proteins from atomic- and residue-level models. Biophysical Journal. 101 (4), 892-898 (2011).
- Hennig, M., Frick, B., Seydel, T. IUCr Optimum velocity of a phase-space transformer for cold-neutron backscattering spectroscopy. Journal of Applied Crystallography. 44 (3), 467-472 (2011).
- Paalman, H. H., Pings, C. J. Numerical evaluation of X-ray absorption factors for cylindrical samples and annular sample cells. Journal of Applied Physics. 33 (8), 2635-2639 (1962).
- Ow, S. -. Y., Dunstan, D. E. The effect of concentration, temperature and stirring on hen egg white lysozyme amyloid formation. Soft Matter. 9 (40), 9692-9701 (2013).
- Tominaga, T., Sahara, M., Kawakita, Y., Nakagawa, H., Yamada, T. Evaluation of sample cell materials for aqueous solutions used in quasi-elastic neutron scattering measurements. Journal of Applied Crystallography. 54 (6), 1631-1640 (2021).
- Beck, C., et al. Following protein dynamics in real time during crystallization. Crystal Growth & Design. 19 (12), 7036-7045 (2019).
- Smith, A. A., Testori, E., Cadalbert, R., Meier, B. H., Ernst, M. Characterization of fibril dynamics on three timescales by solid-state NMR. Journal of Biomolecular NMR. 65 (3-4), 171-191 (2016).
- Wang, T., Jo, H., DeGrado, W. F., Hong, M. Water distribution, dynamics, and interactions with Alzheimer’s β-amyloid fibrils investigated by solid-state NMR. Journal of the American Chemical Society. 139 (17), 6242-6252 (2017).
- Rezaei-Ghaleh, N., Giller, K., Becker, S., Zweckstetter, M. Effect of zinc dinding on β-amyloid structure and dynamics: Implications for Aβ aggregation. Biophysical Journal. 101 (5), 1202-1211 (2011).
- Vugmeyster, L., et al. Fast motions of key methyl groups in amyloid-β fibrils. Biophysical Journal. 111 (10), 2135-2148 (2016).
- Yang, X., Wang, B., Hoop, C. L., Williams, J. K., Baum, J. NMR unveils an N-terminal interaction interface on acetylated-α-synuclein monomers for recruitment to fibrils. Proceedings of the National Academy of Sciences of the United States of America. 118 (18), (2021).
- Tuttle, M. D., et al. Solid-state NMR structure of a pathogenic fibril of full-length human α-synuclein. Nature Structural & Molecular Biology. 23 (5), 409-415 (2016).
- Karamanos, T. K., Kalverda, A. P., Thompson, G. S., Radford, S. E. Mechanisms of amyloid formation revealed by solution NMR. Progress in Nuclear Magnetic Resonance Spectroscopy. 88-89, 86-104 (2015).
- Lai, Y. -. C., Kuo, Y. -. H., Chiang, Y. -. W. Identifying protein conformational dynamics using spin-label ESR. Chemistry – An Asian Journal. 14 (22), 3981-3991 (2019).
- Franck, J. M., Han, S. Overhauser dynamic nuclear polarization for the study of hydration dynamics, explained. Methods in Enzymology. 615, 131-175 (2019).
- Pavlova, A., et al. Protein structural and surface water rearrangement constitute major events in the earliest aggregation stages of tau. Proceedings of the National Academy of Sciences of the United States of America. 113 (2), 127-136 (2016).
- Lin, Y., et al. Liquid-liquid phase separation of tau driven by hydrophobic interaction facilitates fibrillization of tau. bioRxiv. , (2020).
- Decatur, S. M. Elucidation of residue-level structure and dynamics of polypeptides via isotope-edited infrared spectroscopy. Accounts of Chemical Research. 39 (3), 169-175 (2006).
- Chatani, E., Tsuchisaka, Y., Masuda, Y., Water Tsenkova, R. molecular system dynamics associated with amyloidogenic nucleation as revealed by real time near infrared spectroscopy and aquaphotomics. PLoS One. 9 (7), 101997 (2014).
- Goret, G., Aoun, B., Pellegrini, E. MDANSE: An interactive analysis environment for molecular dynamics simulations. Journal of Chemical Information and Modeling. 57 (1), 1-5 (2017).
- Fujiwara, S., et al. Internal dynamics of a protein that forms the amyloid fibrils observed by neutron scattering. Journal of the Physical Society of Japan. 82, (2013).
- Schiró, G., et al. Neutron scattering reveals enhanced protein dynamics in concanavalin a amyloid fibrils. Journal of Physical Chemistry Letters. 3 (8), 992-996 (2012).
- Pounot, K., et al. Zinc determines dynamical properties and aggregation kinetics of human insulin. Biophysical Journal. 120 (5), 886-898 (2021).
- Fujiwara, S., et al. Dynamic properties of human α-synuclein related to propensity to amyloid fibril formation. Journal of Molecular Biology. 431 (17), 3229-3245 (2019).
- Sanz, A., et al. High-pressure cell for simultaneous dielectric and neutron spectroscopy. Review of Scientific Instruments. 89 (2), 023904 (2018).
- Adams, M. A., et al. Simultaneous neutron scattering and Raman scattering. Applied Spectroscopy. 63 (7), 727-732 (2009).

