Høyoppløselig nøytronspektroskopi for å studere picosekund-nanosekunddynamikk av proteiner og hydreringsvann
Summary
Nøytron-tilbakespredningsspektroskopi gir en ikke-destruktiv og etikettfri tilgang til ps-ns-dynamikken til proteiner og deres hydreringsvann. Arbeidsflyten presenteres med to studier på amyloidproteiner: på lysozymets tidsoppløste dynamikk under aggregering og på hydreringsvanndynamikken til tau ved fiberdannelse.
Abstract
Nøytronspredning gir mulighet til å undersøke dynamikken i prøver for et bredt spekter av energier på en ikke-destruktiv måte og uten annen merking enn deuterium. Spesielt registrerer nøytronbackspredningsspektroskopi spredningssignalene ved flere spredningsvinkler samtidig og er godt egnet til å studere dynamikken til biologiske systemer på ps-ns-tidsskalaen. Ved å benytte D2O – og muligens deutererte bufferkomponenter – tillater metoden overvåking av både massesenterdiffusjon og ryggrads- og sidekjedebevegelser (intern dynamikk) av proteiner i flytende tilstand.
I tillegg kan hydreringsvanndynamikk studeres ved å bruke pulver av perdeutererte proteiner hydrert med H2O. Denne artikkelen presenterer arbeidsflyten som brukes på instrumentet IN16B ved Institut Laue-Langevin (ILL) for å undersøke protein- og hydreringsvanndynamikk. Fremstilling av løsningsprøver og hydrerte proteinpulverprøver ved bruk av damputveksling blir forklart. Dataanalyseprosedyren for både protein- og hydreringsvanndynamikk er beskrevet for forskjellige typer datasett (kvasielastiske spektra eller fastvindusskanninger) som kan oppnås på et nøytron-tilbakespredningsspektrometer.
Metoden er illustrert med to studier som involverer amyloidproteiner. Aggregeringen av lysozym i μm størrelse sfæriske aggregater – betegnet partikler – er vist å forekomme i en ett-trinns prosess på rom- og tidsområdet undersøkt på IN16B, mens den interne dynamikken forblir uendret. Videre ble dynamikken i hydreringsvann av tau studert på hydrerte pulver av perdeuterert protein. Det er vist at translasjonsbevegelser av vann aktiveres ved dannelse av amyloidfibre. Til slutt diskuteres kritiske trinn i protokollen om hvordan nøytronspredning er posisjonert med hensyn til studiet av dynamikk i forhold til andre eksperimentelle biofysiske metoder.
Introduction
Nøytronet er en ladningsløs og massiv partikkel som har blitt brukt gjennom årene til å undersøke prøver på ulike felt fra grunnleggende fysikk til biologi1. For biologiske anvendelser er småvinklet nøytronspredning, uelastisk nøytronspredning og nøytronkrystallografi og reflektometri mye brukt 2,3,4. Uelastisk nøytronspredning gir en ensemble-gjennomsnittlig måling av dynamikken uten å kreve spesifikk merking i seg selv, og en signalkvalitet som ikke avhenger av størrelsen eller proteinet5. Målingen kan gjøres ved hjelp av et svært komplekst miljø for proteinet som studeres som etterligner det intracellulære mediet, for eksempel et deuterert bakterielt lysat eller til og med in vivo 3,6,7. Ulike eksperimentelle oppsett kan brukes til å studere dynamikken, nemlig i) time-of-flight-gi tilgang til sub-ps-ps-dynamikk, ii) backscattering-gi tilgang til ps-ns dynamikk, og iii) spin-echo-gi tilgang til dynamikk fra ns til hundrevis av ns. Nøytron-backscattering gjør bruk av Braggs lov 2d sinθ = nλ, hvor d er avstanden mellom plan i en krystall, θ spredningsvinkelen, n spredningsrekkefølgen og λ bølgelengden. Bruken av krystaller for tilbakespredning mot detektorene gjør det mulig å oppnå en høy oppløsning i energi, typisk ~0,8 μeV. For å måle energiutvekslingen brukes enten en Doppler-stasjon som bærer en krystall i tilbakespredning til å definere og justere den innkommende nøytronbølgelengden 8,9,10 (figur 1), eller et flytidsoppsett kan brukes på bekostning av en reduksjon i energioppløsning 11.
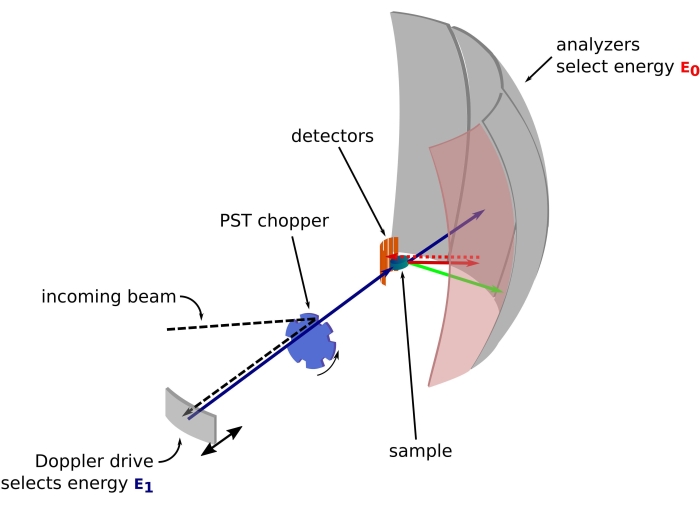
Figur 1: Skisse av et nøytron-tilbakespredningsspektrometer med dopplerdrift. Den innkommende strålen treffer faseromtransformasjonen (PST) helikopter42, noe som øker fluksen ved prøveposisjonen. Den blir deretter tilbakespredt mot prøven av Doppler-stasjonen, som velger en energi E1 (cyan pil). Nøytronene blir deretter spredt av prøven (med forskjellige energier representert ved pilens farge) og analysatorene, laget av Si 111-krystaller, vil bare tilbakespre nøytroner med en spesifikk energi E0 (rødfargede piler her). Derfor oppnås momentumoverføringen q fra den oppdagede posisjonen til nøytronet på detektormatrisen, og energioverføringen oppnås fra forskjellen E1– E0. Flytiden som forventes for nøytronpulsen produsert av PST, brukes til å forkaste signalet fra nøytronene spredt direkte mot detektorrørene. Forkortelse: PST = faseromtransformasjon. Klikk her for å se en større versjon av denne figuren.
For tilbakespredningsspektroskopi kommer hovedbidraget til signalet fra hydrogenprotonrike prøver, slik som proteiner, fra usammenhengende spredning, for hvilken spredningsintensiteten Sinc(q, ω) er vist ved Eq (1)12
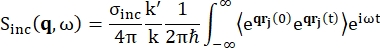 (1)
(1)
Hvor σinc er det usammenhengende tverrsnittet av elementet som vurderes, er k’ normen for den spredte bølgevektoren, k normen for den innkommende bølgevektoren, q (= k – k’) momentumoverføringen, r j (t) posisjonsvektoren til atom j på tidspunkt t, og ω frekvensen som tilsvarer energioverføringen mellom det innkommende nøytronet og systemet. Vinkelparentesene angir ensemblegjennomsnittet. Derfor sonderer inkoherent spredning ensemble-gjennomsnittlig enkeltpartikkel selvkorrelasjon av atomposisjoner med tiden og gir selvdynamikken gjennomsnittet over alle atomer i systemet og forskjellige tidsopprinnelser (ensemblegjennomsnitt). Spredningsfunksjonen er Fouriertransformasjonen i tid for den mellomliggende spredningsfunksjonen I (q, t), som kan sees på som Fourier-transformasjonen i rommet til van Hove-korrelasjonsfunksjonen vist ved Eq (2):
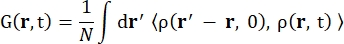 (2)
(2)
Hvor ρ(r,t) er sannsynlighetstettheten for å finne et atom i posisjon r og tid t 13.
For en Fickian diffusjonsprosess resulterer selvdiffusjonsfunksjonen (se Eq (3)) etter en dobbel Fourier-transformasjon i en spredningsfunksjon bestående av en Lorentzian med linjebredde gitt ved γ = Dq2.
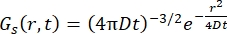 (3)
(3)
Mer sofistikerte modeller ble utviklet og funnet nyttige, for eksempel hoppdiffusjonsmodellen av Singwi og Sjölander for ps-ns intern proteindynamikk14 eller rotasjonsmodellen av Sears for hydreringsvann15,16,17.
På nøytronbackscattering-instrumentet (NBS) IN16B8,9 ved ILL, Grenoble, Frankrike (tilleggsfigur S1), består et oppsett som vanligvis brukes med proteiner av Si 111-krystaller for analysatorene med en Doppler-stasjon for innstilling av den innkommende bølgelengden (tilleggsfigur S2A), og gir dermed tilgang til momentumoverføringsområdet ~0,2 Å-1 < q < ~2 Å-1 og energioverføringsområde på –30 μeV < 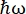 < 30 μeV-tilsvarende tidsskalaer fra noen få ps til noen få ns og avstander på noen få Å. I tillegg tilbyr IN16B muligheten til å utføre elastiske og uelastiske skanninger med faste vinduer (E/IFWS)10, som inkluderer datainnsamling ved en fast energioverføring. Siden fluksen er begrenset ved arbeid med nøytroner, tillater E / IFWS maksimering av fluksen for en energioverføring, og reduserer dermed innsamlingstiden som trengs for å oppnå et tilfredsstillende signal-støyforhold. Et nyere alternativ er backscattering and time-of-flight spectrometer (BATS) modus11, som tillater måling av et bredt spekter av energioverføringer, (f.eks. -150 μeV < <
< 30 μeV-tilsvarende tidsskalaer fra noen få ps til noen få ns og avstander på noen få Å. I tillegg tilbyr IN16B muligheten til å utføre elastiske og uelastiske skanninger med faste vinduer (E/IFWS)10, som inkluderer datainnsamling ved en fast energioverføring. Siden fluksen er begrenset ved arbeid med nøytroner, tillater E / IFWS maksimering av fluksen for en energioverføring, og reduserer dermed innsamlingstiden som trengs for å oppnå et tilfredsstillende signal-støyforhold. Et nyere alternativ er backscattering and time-of-flight spectrometer (BATS) modus11, som tillater måling av et bredt spekter av energioverføringer, (f.eks. -150 μeV < < 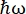 150 μeV), med en høyere fluks enn med Doppler-stasjonen, men på bekostning av en lavere energioppløsning (tilleggsfigur S2B).
150 μeV), med en høyere fluks enn med Doppler-stasjonen, men på bekostning av en lavere energioppløsning (tilleggsfigur S2B).
En viktig egenskap ved nøytronspredning er at det usammenhengende tverrsnittet σinc har en 40 ganger høyere verdi for hydrogen enn for deuterium og er ubetydelig for andre elementer som ofte finnes i biologiske prøver. Derfor kan dynamikken til proteiner i et flytende miljø studeres ved å bruke en deuterert buffer, og pulvertilstanden tillater studier av enten proteinintern dynamikk med hydrogenert proteinpulver hydrert med D 2 O, eller studiet av hydreringsvann for perdeuterert proteinpulver hydrert med H2O. I flytende tilstand tillater nøytron-backscattering vanligvis samtidig tilgang til massesenteret selvdiffusjon av proteiner (Fickian-type diffusjon) og deres indre dynamikk. Sistnevnte er ryggrads- og sidekjedebevegelser som vanligvis beskrives av den såkalte hoppdiffusjonsmodellen eller andre 3,18. I hydrogenerte proteinpulver er proteindiffusjonen fraværende, og bare intern dynamikk må modelleres. For hydreringsvann presenterer bidragene fra translasjons- og rotasjonsbevegelser av vannmolekyler en annen avhengighet av momentumoverføringen q, noe som gjør det mulig å skille dem i dataanalyseprosessen17.
Dette papiret illustrerer nøytron-backscattering-metoden med studiet av proteiner som ble funnet å kunne utfolde seg, aggregere til en kanonisk form bestående av stabler av β-tråder – det såkalte kryss-β mønsteret19,20 – og danne langstrakte fibre. Dette er den såkalte amyloidaggregeringen, som er grundig studert på grunn av sin sentrale rolle i nevrodegenerative lidelser som Alzheimers eller Parkinsons sykdommer21,22. Studien av amyloidproteinene er også motivert av den funksjonelle rollen de kan spille 23,24 eller deres høye potensial for utvikling av nye biomaterialer25. De fysisk-kjemiske determinantene for amyloidaggregeringen er fortsatt uklare, og ingen generell teori om amyloidaggregering er tilgjengelig, til tross for enorm fremgang de siste årene21,26.
Amyloidaggregering innebærer endringer i proteinstruktur og stabilitet med tiden, hvis studie naturlig innebærer dynamikk, knyttet til proteinkonformasjonsstabilitet, proteinfunksjon og proteinenergilandskap27. Dynamikk er direkte knyttet til stabiliteten til en bestemt tilstand gjennom det entropiske bidraget for de raskeste bevegelsene28, og proteinfunksjonen kan opprettholdes av bevegelser på forskjellige tidsskalaer fra sub-ps for lysfølsomme proteiner29 til ms for domenebevegelser, noe som kan tilrettelegges av picosekund-nanosekunddynamikk30.
To eksempler på bruk av nøytron-tilbakespredningsspektroskopi for å studere amyloidproteiner vil bli presentert, en i flytende tilstand for å studere proteindynamikk og en i hydrert pulvertilstand for å studere hydreringsvanndynamikk. Det første eksemplet gjelder aggregering av lysozym i μm størrelse sfærer (kalt partikler) fulgt i sanntid5, og den andre en sammenligning av vanndynamikk i innfødte og aggregerte tilstander av det humane protein tau31.
Lysozym er et enzym involvert i immunforsvar og består av 129 aminosyrerester. Lysozym kan danne partikler i deuterert buffer ved pD på 10,5 og ved en temperatur på 90 °C. Med nøytronspredning viste vi at tidsutviklingen av lysozymets senter-av-massediffusjonskoeffisient følger den enkle eksponentielle kinetikken til tioflavin T-fluorescens (en fluorescerende sonde som brukes til å overvåke dannelsen av amyloid kryss-β mønstre32), noe som indikerer at dannelsespartikkelformige overbygninger og kryss-β-mønstre forekommer i et enkelt trinn med samme hastighet. Videre forble den interne dynamikken konstant gjennom aggregeringsprosessen, noe som kan forklares enten ved en rask konformasjonsendring som ikke kan observeres på NBS-instrumenter, eller ved fravær av signifikant endring i proteinintern energi ved aggregering.
Det humane proteinet tau er et egenordnet protein (IDP) som består av 441 aminosyrer for den såkalte 2N4R isoformen, som er spesielt involvert i Alzheimers sykdom33. Ved å bruke nøytron-backscattering på pulver av perdeuterert protein tau, viste vi at hydreringsvanndynamikken økes i fibertilstanden, med en høyere populasjon av vannmolekyler som gjennomgår translasjonsbevegelser. Resultatet antyder at en økning i hydreringsvannentropi kan drive amyloidflimmer av tau.
Protocol
Representative Results
Discussion
Nøytronspektroskopi er den eneste metoden som gjør det mulig å undersøke ensemble-gjennomsnittlig ps-ns-dynamikk av proteinprøver uavhengig av størrelsen på proteinet eller kompleksiteten til løsningen når deuterasjon brukes6. Spesielt, ved å undersøke selvdiffusjon av proteinsammensetninger i løsning, kan den hydrodynamiske størrelsen på slike samlinger entydig bestemmes. Likevel er metoden vanligvis begrenset av den lave nøytronfluksen, noe som innebærer lange innsamlingstider og…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Forfatterne er takknemlige for Michaela Zamponi ved Jülich Centre for Neutron Science ved Heinz Maier-Leibnitz Zentrum, Garching, Tyskland, for en del av nøytronspredningseksperimentene som ble utført på instrumentet SPHERES. Dette arbeidet har dratt nytte av aktivitetene til Deuteration Laboratory (DLAB) konsortiet finansiert av EU under kontraktene HPRI-2001-50065 og RII3-CT-2003-505925, og fra UK Engineering and Physical Sciences Research Council (EPSRC) -finansiert aktivitet innenfor Institut Laue Langevin EMBL DLAB under Grants GR / R99393/01 og EP / C015452 / 1. Støtte fra EU-kommisjonen under det 7. rammeprogrammet gjennom Key Action: Strengthening the European Research Area, Research Infrastructures er anerkjent [Contract 226507 (NMI3)]. Kevin Pounot og Christian Beck takker det føderale utdannings- og forskningsdepartementet (BMBF, stipendnummer 05K19VTB) for finansiering av deres postdoktorale stipend.
Materials
| Aluminum sample holder | Not commercially available. Either the local contact on the instrument can provide them or they can be manufactured based on a technical drawing that can be provided by the local contact. | ||
| Deuterium chloride, 35 wt. % in D2O, ≥99 atom % D | Sigma-Aldrich | 543047 |
|
| Deuterium oxide (D, 99.9%) | Eurisotop | DLM-4DR-PK | |
| Dow Corning high-vacuum silicone grease | Sigma-Aldrich | Z273554-1EA | |
| Ethanol 96%, EMSURE Reag. Ph Eur | Sigma-Aldrich | 1.5901 | |
| Glass dessicator | VWR | 75871-660 | |
| Glass dessicator plate, 140 mm | VWR | 89038-068 | |
| Indium wire, 1.0 mm (0.04 in) dia, Puratronic, 99.999% | Alfa Aesar | 00470.G1 | |
| Lysozyme from chicken egg white dialyzed, lyophilized, powder, ~100,000 U/mg | Sigma-Aldrich | 62970 | |
| nPDyn | v3.x | see github.com/kpounot/nPDyn, model functions fot fitting also included in the software | |
| OHAUS AX324 Adventurer balance, internal calibration | Dutscher | 92641 | |
| Phosphorus pentoxide, ReagentPlus, 99% | Sigma-Aldrich | 214701 | |
| Pipette ErgoOne 0.5-10 μL | Starlab | S7100-0510 | |
| Pipette ErgoOne 100-1,000 μL | Starlab | S7100-1000 | |
| Pipette ErgoOne 20-200 μL | Starlab | S7100-2200 | |
| Pipette tip TipOne 1,000 μL | Starlab | S1111-6001 | |
| Pipette tip TipOne 10 μL | Starlab | S1111-3200 | |
| Pipette tip TipOne 200 μL | Starlab | S1111-0206 | |
| Sodium deuteroxide solution, 40 wt. % in D2O, 99.5 atom % D | Sigma-Aldrich | 372072 |
Riferimenti
- Jacrot, B. Des neutrons pour la science: Histoire de l’Institut Laue-Langevin. Des neutrons pour la science. EDP Sciences. , (2021).
- Mahieu, E., Gabel, F. Biological small-angle neutron scattering: recent results and development. Acta Crystallographica Section D. 74 (8), 715-726 (2018).
- Grimaldo, M., Roosen-Runge, F., Zhang, F., Schreiber, F., Seydel, T. Dynamics of proteins in solution. Quarterly Reviews of Biophysics. 52, 7 (2019).
- Martel, A., et al. Membrane permeation versus amyloidogenicity: A multitechnique study of islet amyloid polypeptide interaction with model membranes. Journal of the American Chemical Society. 139 (1), 137-148 (2017).
- Pounot, K., et al. Tracking internal and global diffusive dynamics during protein aggregation by high-resolution neutron spectroscopy. The Journal of Physical Chemistry Letters. 11 (15), 6299-6304 (2020).
- Grimaldo, M., et al. Protein short-time diffusion in a naturally crowded environment. The Journal of Physical Chemistry Letters. 10 (8), 1709-1715 (2019).
- Jasnin, M., Stadler, A., Tehei, M., Zaccai, G. Specific cellular water dynamics observed in vivo by neutron scattering and NMR. Physical Chemistry Chemical Physics. 12 (35), 10154-10160 (2010).
- Frick, B. The neutron backscattering spectrometer IN16 at ILL-high energy resolution with high intensity and excellent signal-to-noise ratio. Neutron News. 13 (2), 15-22 (2002).
- Frick, B., Mamontov, E., van Eijck, L., Seydel, T. Recent backscattering instrument developments at the ILL and SNS. Zeitschrift für Physikalische Chemie. 224 (1-2), 33-60 (2010).
- Frick, B., Combet, J., van Eijck, L. New possibilities with inelastic fixed window scans and linear motor Doppler drives on high resolution neutron backscattering spectrometers. Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 669, 7-13 (2012).
- Appel, M., Frick, B., Magerl, A. A flexible high speed pulse chopper system for an inverted neutron time-of-flight option on backscattering spectrometers. Scientific Reports. 8 (1), 13580 (2018).
- Squires, G. L. . Introduction to the theory of thermal neutron scattering. , (1996).
- Singwi, K. S., Sjölander, A. Diffusive motions in water and cold neutron scattering. Physical Review. 119 (3), 863-871 (1960).
- Sears, V. F. Theory of cold neutron scattering by homonuclear diatomic liquids: i. free rotation. Canadian Journal of Physics. 44 (6), 1279-1297 (1966).
- Sears, V. F. Theory of cold neutron scattering by homonuclear liquid: ii. hindered rotation. Canadian Journal of Physics. 44 (6), 1299-1311 (1966).
- Schirò, G., et al. Translational diffusion of hydration water correlates with functional motions in folded and intrinsically disordered proteins. Nature Communications. 6, 6490 (2015).
- Grimaldo, M., et al. Hierarchical molecular dynamics of bovine serum albumin in concentrated aqueous solution below and above thermal denaturation. Physical Chemistry Chemical Physics. 17 (6), 4645-4655 (2015).
- Eanes, E. D., Glenner, G. G. X-ray diffraction studies on amyloid filaments. Journal of Histochemistry & Cytochemistry. 16 (11), 673-677 (1968).
- Bonar, L., Cohen, A. S., Skinner, M. M. Characterization of the Amyloid Fibril as a Cross-β Protein. Proceedings of the Society for Experimental Biology and Medicine. 131 (4), 1373-1375 (1969).
- Chiti, F., Dobson, C. M. Protein Misfolding, Amyloid Formation, and Human Disease: A Summary of Progress Over the Last Decade. Annual Review of Biochemistry. 86 (1), 27-68 (2017).
- Knowles, T. P. J., Vendruscolo, M., Dobson, C. M. The amyloid state and its association with protein misfolding diseases. Nature Reviews Molecular Cell Biology. 15 (6), 384-396 (2014).
- Maji, S. K., et al. Functional amyloids as natural storage of peptide hormones in pituitary secretory granules. Science. 325 (5938), 328-332 (2009).
- Li, J., et al. The RIP1/RIP3 necrosome forms a functional amyloid signaling complex required for programmed necrosis. Cell. 150 (2), 339-350 (2012).
- Knowles, T. P. J., Mezzenga, R. Amyloid fibrils as building blocks for natural and artificial functional materials. Advanced Materials. 28 (31), 6546-6561 (2016).
- Stephens, A. D., Kaminski Schierle, G. S. The role of water in amyloid aggregation kinetics. Current Opinion in Structural Biology. 58, 115-123 (2019).
- Adamcik, J., Mezzenga, R. Amyloid polymorphism in the protein folding and aggregation energy landscape. Angewandte Chemie International Edition. 57 (28), 8370-8382 (2018).
- Liu, Z., et al. Entropic contribution to enhanced thermal stability in the thermostable P450 CYP119. Proceedings of the National Academy of Sciences of the United States of America. 115 (43), 10049-10058 (2018).
- Coquelle, N., et al. Chromophore twisting in the excited state of a photoswitchable fluorescent protein captured by time-resolved serial femtosecond crystallography. Nature Chemistry. 10 (1), 31-37 (2018).
- Henzler-Wildman, K. A., et al. A hierarchy of timescales in protein dynamics is linked to enzyme catalysis. Nature. 450 (7171), 913-916 (2007).
- Fichou, Y., et al. Hydration water mobility is enhanced around tau amyloid fibers. Proceedings of the National Academy of Sciences of the United States of America. 112 (20), 6365-6370 (2015).
- Burns, J., Pennock, C. A., Stoward, P. J. The specificity of the staining of amyloid deposits with thioflavine T. The Journal of Pathology and Bacteriology. 94 (2), 337-344 (1967).
- Iqbal, K., Liu, F., Gong, C. -. X., Grundke-Iqbal, I. Tau in Alzheimer disease and related tauopathies. Current Alzheimer Research. 7 (8), 656-664 (2010).
- Krȩżel, A., Bal, W. A formula for correlating pKa values determined in D2O and H2O. Journal of Inorganic Biochemistry. 98 (1), 161-166 (2004).
- Dolman, M., Halling, P. J., Moore, B. D., Waldron, S. How dry are anhydrous enzymes? Measurement of residual and buried 18O-labeled water molecules using mass spectrometry. Biopolymers. 41 (3), 313-321 (1997).
- Pounot, K. kpounotnPDyn: v3.0.0. Zenodo. , (2021).
- Yi, Z., Miao, Y., Baudry, J., Jain, N., Smith, J. C. Derivation of mean-square displacements for protein dynamics from elastic incoherent neutron scattering. Journal of Physical Chemistry B. 116 (16), 5028-5036 (2012).
- Peters, J., Kneller, G. R. Motional heterogeneity in human acetylcholinesterase revealed by a non-Gaussian model for elastic incoherent neutron scattering. The Journal of Chemical Physics. 139 (16), 165102 (2013).
- Zeller, D., Telling, M. T. F., Zamponi, M., García Sakai, V., Peters, J. Analysis of elastic incoherent neutron scattering data beyond the Gaussian approximation. The Journal of Chemical Physics. 149 (23), 234908 (2018).
- Roosen-Runge, F., Seydel, T. A generalized mean-squared displacement from inelastic fixed window scans of incoherent neutron scattering as a model-free indicator of anomalous diffusion confinement. EPJ Web of Conferences. 83, 02015 (2015).
- Ortega, A., Amorós, D., García de la Torre, J. Prediction of hydrodynamic and other solution properties of rigid proteins from atomic- and residue-level models. Biophysical Journal. 101 (4), 892-898 (2011).
- Hennig, M., Frick, B., Seydel, T. IUCr Optimum velocity of a phase-space transformer for cold-neutron backscattering spectroscopy. Journal of Applied Crystallography. 44 (3), 467-472 (2011).
- Paalman, H. H., Pings, C. J. Numerical evaluation of X-ray absorption factors for cylindrical samples and annular sample cells. Journal of Applied Physics. 33 (8), 2635-2639 (1962).
- Ow, S. -. Y., Dunstan, D. E. The effect of concentration, temperature and stirring on hen egg white lysozyme amyloid formation. Soft Matter. 9 (40), 9692-9701 (2013).
- Tominaga, T., Sahara, M., Kawakita, Y., Nakagawa, H., Yamada, T. Evaluation of sample cell materials for aqueous solutions used in quasi-elastic neutron scattering measurements. Journal of Applied Crystallography. 54 (6), 1631-1640 (2021).
- Beck, C., et al. Following protein dynamics in real time during crystallization. Crystal Growth & Design. 19 (12), 7036-7045 (2019).
- Smith, A. A., Testori, E., Cadalbert, R., Meier, B. H., Ernst, M. Characterization of fibril dynamics on three timescales by solid-state NMR. Journal of Biomolecular NMR. 65 (3-4), 171-191 (2016).
- Wang, T., Jo, H., DeGrado, W. F., Hong, M. Water distribution, dynamics, and interactions with Alzheimer’s β-amyloid fibrils investigated by solid-state NMR. Journal of the American Chemical Society. 139 (17), 6242-6252 (2017).
- Rezaei-Ghaleh, N., Giller, K., Becker, S., Zweckstetter, M. Effect of zinc dinding on β-amyloid structure and dynamics: Implications for Aβ aggregation. Biophysical Journal. 101 (5), 1202-1211 (2011).
- Vugmeyster, L., et al. Fast motions of key methyl groups in amyloid-β fibrils. Biophysical Journal. 111 (10), 2135-2148 (2016).
- Yang, X., Wang, B., Hoop, C. L., Williams, J. K., Baum, J. NMR unveils an N-terminal interaction interface on acetylated-α-synuclein monomers for recruitment to fibrils. Proceedings of the National Academy of Sciences of the United States of America. 118 (18), (2021).
- Tuttle, M. D., et al. Solid-state NMR structure of a pathogenic fibril of full-length human α-synuclein. Nature Structural & Molecular Biology. 23 (5), 409-415 (2016).
- Karamanos, T. K., Kalverda, A. P., Thompson, G. S., Radford, S. E. Mechanisms of amyloid formation revealed by solution NMR. Progress in Nuclear Magnetic Resonance Spectroscopy. 88-89, 86-104 (2015).
- Lai, Y. -. C., Kuo, Y. -. H., Chiang, Y. -. W. Identifying protein conformational dynamics using spin-label ESR. Chemistry – An Asian Journal. 14 (22), 3981-3991 (2019).
- Franck, J. M., Han, S. Overhauser dynamic nuclear polarization for the study of hydration dynamics, explained. Methods in Enzymology. 615, 131-175 (2019).
- Pavlova, A., et al. Protein structural and surface water rearrangement constitute major events in the earliest aggregation stages of tau. Proceedings of the National Academy of Sciences of the United States of America. 113 (2), 127-136 (2016).
- Lin, Y., et al. Liquid-liquid phase separation of tau driven by hydrophobic interaction facilitates fibrillization of tau. bioRxiv. , (2020).
- Decatur, S. M. Elucidation of residue-level structure and dynamics of polypeptides via isotope-edited infrared spectroscopy. Accounts of Chemical Research. 39 (3), 169-175 (2006).
- Chatani, E., Tsuchisaka, Y., Masuda, Y., Water Tsenkova, R. molecular system dynamics associated with amyloidogenic nucleation as revealed by real time near infrared spectroscopy and aquaphotomics. PLoS One. 9 (7), 101997 (2014).
- Goret, G., Aoun, B., Pellegrini, E. MDANSE: An interactive analysis environment for molecular dynamics simulations. Journal of Chemical Information and Modeling. 57 (1), 1-5 (2017).
- Fujiwara, S., et al. Internal dynamics of a protein that forms the amyloid fibrils observed by neutron scattering. Journal of the Physical Society of Japan. 82, (2013).
- Schiró, G., et al. Neutron scattering reveals enhanced protein dynamics in concanavalin a amyloid fibrils. Journal of Physical Chemistry Letters. 3 (8), 992-996 (2012).
- Pounot, K., et al. Zinc determines dynamical properties and aggregation kinetics of human insulin. Biophysical Journal. 120 (5), 886-898 (2021).
- Fujiwara, S., et al. Dynamic properties of human α-synuclein related to propensity to amyloid fibril formation. Journal of Molecular Biology. 431 (17), 3229-3245 (2019).
- Sanz, A., et al. High-pressure cell for simultaneous dielectric and neutron spectroscopy. Review of Scientific Instruments. 89 (2), 023904 (2018).
- Adams, M. A., et al. Simultaneous neutron scattering and Raman scattering. Applied Spectroscopy. 63 (7), 727-732 (2009).

