Analyse du type de fibre et de la teneur en gouttelettes lipidiques dans le muscle squelettique
Summary
De plus en plus de preuves indiquent qu’une infiltration excessive de lipides à l’intérieur du muscle squelettique entraîne une lipotoxicité et un diabète. Ici, nous présentons un protocole complet, y compris le traitement des tissus, la coloration avec Bodipy, l’acquisition d’images et l’analyse, pour quantifier la taille, la densité et la distribution subcellulaire des gouttelettes lipidiques d’une manière spécifique au type de fibre.
Abstract
L’infiltration lipidique des muscles squelettiques, connue sous le nom de myostéatose, augmente avec l’obésité et le vieillissement. La myostéatose a également été récemment découverte comme facteur pronostique négatif pour plusieurs autres troubles tels que les maladies cardiovasculaires et le cancer. Une infiltration lipidique excessive diminue la masse musculaire et la force. Il en résulte également une lipotoxicité et une résistance à l’insuline en fonction de la teneur totale en lipides intramyocellulaires, de la morphologie des gouttelettes lipidiques (LD) et de la distribution subcellulaire. Le type de fibre (oxydatif vs glycolytique) est également important, car les fibres oxydatives ont une plus grande capacité à utiliser les lipides. En raison de leurs implications cruciales en physiopathologie, des études approfondies sur la dynamique et la fonction des TA d’une manière spécifique au type de fibre sont justifiées.
Ici, un protocole complet est présenté pour la quantification de la teneur en lipides intramyocellulaires et l’analyse de la morphologie de la LD et de la distribution subcellulaire d’une manière spécifique au type de fibre. À cette fin, des cryosections musculaires en série ont été colorées avec le colorant fluorescent Bodipy et des anticorps contre les isoformes de chaîne lourde de myosine. Ce protocole permet le traitement simultané de différents muscles, ce qui permet de gagner du temps et d’éviter d’éventuels artefacts et, grâce à une macro personnalisée créée aux Fidji, l’automatisation de l’analyse LD est également possible.
Introduction
L’infiltration lipidique des muscles squelettiques, connue sous le nom de myostéatose, augmente avec l’obésité et le vieillissement. La myostéatose est négativement corrélée à la masse musculaire et à la force et à la sensibilité à l’insuline1. De plus, des études récentes indiquent que le degré de myostéatose pourrait être utilisé comme facteur pronostique pour d’autres affections telles que lesmaladies cardiovasculaires 2, la stéatose hépatique non alcoolique3 ou le cancer4. Les lipides peuvent s’accumuler dans le muscle squelettique entre les fibres musculaires sous forme de lipides extramyocellulaires ou dans les fibres, sous forme de lipides intramyocellulaires (IMCL). Les IMCL sont principalement stockés sous forme de triglycérides dans des gouttelettes lipidiques (LD) qui sont utilisées comme carburant métabolique pendant l’exercice physique 5,6. Cependant, lorsque l’offre de lipides dépasse la demande ou lorsque les mitochondries deviennent dysfonctionnelles, les IMCL seront impliqués dans la résistance musculaire à l’insuline, comme on le voit chez les personnes métaboliquement malsaines, obèses et chez les patients diabétiques de type 27. Curieusement, les athlètes d’endurance ont des niveaux similaires, sinon plus élevés, de MCMC que ceux trouvés chez les patients obèses atteints de diabète sucré de type 2, tout en maintenant une sensibilité élevée à l’insuline. Ce phénomène est décrit comme le « paradoxe de l’athlète »8,9, et s’explique par une évaluation plus nuancée des TA musculaires, liée à leur taille, leur densité, leur localisation, leur dynamique et la composition des espèces lipidiques.
Tout d’abord, la taille de la LD est inversement corrélée à la sensibilité à l’insuline et à la forme physique10,11. En fait, les LD plus petites présentent une surface relativement plus grande pour l’action de la lipase et, par conséquent, ont potentiellement une plus grande capacité à mobiliser les lipides12. Deuxièmement, la densité LD (nombre/surface) joue un rôle controversé dans l’actionde l’insuline 8,10; pourtant, il semble être augmenté chez les athlètes. Troisièmement, la localisation subcellulaire des LD est importante, car les LD situées juste sous la membrane superficielle (sous-sarmateuse ou périphérique) exercent un effet plus délétère sur la sensibilité à l’insuline que les LD centrales 8,9,13. Ces dernières fournissent du carburant aux mitochondries centrales, qui ont une plus grande activité respiratoire et sont plus spécialisées pour répondre à la forte demande d’énergie requise pour la contraction14. En revanche, les TA périphériques fournissent des mitochondries sous-sarmateuses, qui sont impliquées dans les processus liés à la membrane8. Enfin, au-delà des triglycérides, des lipides complexes spécifiques dans le muscle peuvent être plus délétères que d’autres. Par exemple, le diacylglycérol, l’acyl-CoA à longue chaîne et les céramides peuvent s’accumuler dans les muscles lorsque le taux de renouvellement des triglycérides est faible, altérant ainsi la signalisation de l’insuline 9,15. Pour en revenir au « paradoxe de l’athlète », les athlètes d’endurance ont un nombre élevé de TA centrales plus petites avec des taux de renouvellement élevés dans les fibres de type I (oxydatives), tandis que les patients obèses et diabétiques ont des TA périphériques plus importants avec de faibles taux de renouvellement dans les fibres de type II (glycolytiques) 8,15,16. En plus de leur rôle dans le stockage et la libération de l’énergie, les LD via des acides gras dérivés (FA) et une protéine de pelage (périlamine 5) pourraient également fonctionner comme des acteurs critiques impliqués dans la régulation transcriptionnelle de l’oxydation de l’AF et de la biogenèse mitochondriale8. En raison de leurs implications cruciales en physiologie et en physiopathologie, des études approfondies sur la dynamique et les fonctions des TA sont justifiées.
Bien qu’il existe plusieurs techniques pour étudier les IMCL, elles ne sont pas toutes adaptées pour quantifier avec précision la taille, la densité et la distribution des DA DL d’une manière spécifique à la fibre. Par exemple, l’évaluation des NML par spectroscopie par résonance magnétique, tout en étant non invasive, offre un niveau de résolution qui n’est pas suffisant pour étudier la taille et l’emplacement précis des LD dans la fibre, et ce n’est pas spécifique au type de fibre17,18. De même, les techniques biochimiques effectuées sur des homogénats musculaires entiers19 ne peuvent pas évaluer l’emplacement et la taille des lipides. Par conséquent, la méthode la plus adéquate pour analyser la morphologie et l’emplacement de la LD est la microscopie électronique à transmission quantitative13, mais cette technique est coûteuse et prend beaucoup de temps. Par conséquent, l’imagerie par fluorescence confocale sur des préparations avec des colorants tels que Oil Red O (ORO)20,21, monodansylpentane (MDH)22 ou Bodipy 23,24,25, est apparue comme le meilleur outil pour ces études.
Ici, un protocole complet est décrit, y compris l’échantillonnage et le traitement des tissus, la coloration corporelle et l’acquisition et l’analyse d’images confocales pour quantifier la taille, le nombre et la localisation des TA dans les cryosections musculaires de souris. Étant donné que les IMCL ne sont pas répartis uniformément entre les fibres oxydatives et glycolytiques, et que chaque type de fibre régule différemment la dynamique de la LD, l’étude des IMCL doit être spécifique au type de fibre 16,25,26,27. Par conséquent, ce protocole utilise l’immunofluorescence sur des sections en série pour identifier les isoformes de chaîne lourde de myosine (MyHC) exprimées par chaque fibre. Un autre avantage de ce protocole est le traitement simultané d’un muscle glycolytique (extenseur digitorum longus, EDL) et d’un muscle oxydatif (soléaire) placé côte à côte avant la congélation (Figure 1). Ce traitement simultané permet non seulement de gagner du temps, mais aussi d’éviter la variabilité due au traitement séparé des échantillons.
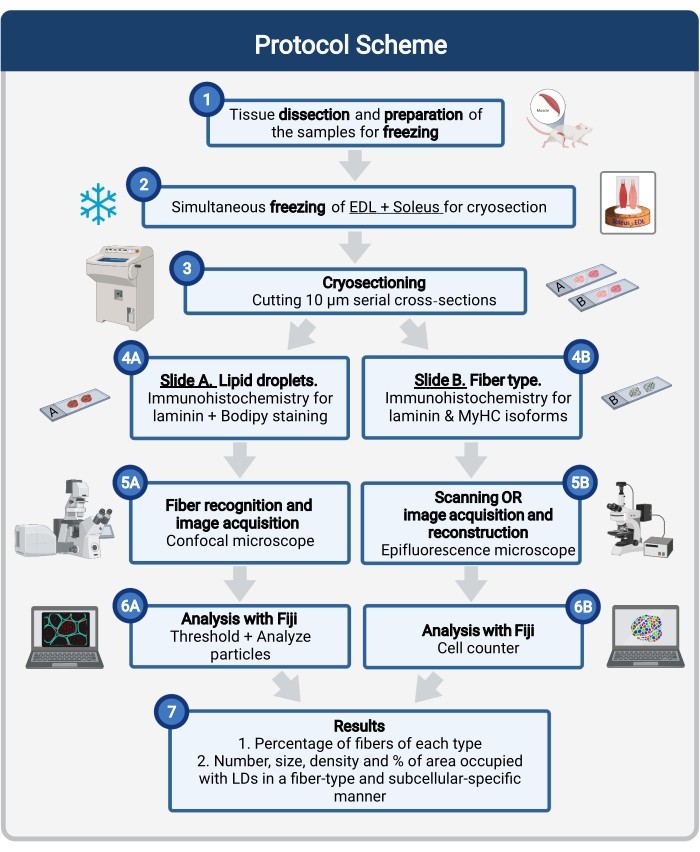
Figure 1 : Vue d’ensemble schématique de la procédure. Après la dissection musculaire (1), des muscles sélectionnés de taille similaire sont préparés et congelés ensemble (2). Les sections transversales en série de 10 μm sont obtenues à l’aide d’un cryostat et directement montées sur des lames d’adhérence (3). À partir de deux diapositives en série, la première (4A) est immunomarquée pour la laminine et colorée avec Bodipy pour reconnaître les LD et la seconde (4B) est immunocolorée avec des anticorps contre les MyHC pour la reconnaissance des types de fibres musculaires. Les images sont acquises à l’aide d’un microscope confocal pour Bodipy (5A) et d’un microscope à épifluorescence pour les types de fibres musculaires (5B). Les images sont analysées aux Fidji en appliquant un seuil et en quantifiant les particules (6A) pour obtenir le nombre, la taille moyenne, la densité et le pourcentage de la surface totale occupée par les TA (7) ou en comptant les cellules (6B) pour obtenir le pourcentage de fibres de chaque type dans la section (7). Abréviations : LD = gouttelettes lipidiques ; EDL = extenseur digitorum longus; MyHC = isoformes de chaîne lourde de myosine. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocol
Representative Results
Discussion
Le protocole détaillé ici décrit une méthode efficace pour quantifier les LD marquées avec Bodipy sur une base spécifique au type de fibre et au subcellulaire. Au cours des dernières années, les colorants lipidiques classiques, tels que l’ORO ou le Sudan Black B, ont été remplacés par une nouvelle gamme de colorants fluorescents lipophiles perméables aux cellules qui se lient aux lipides neutres (par exemple, Bodipy). Disponible sous différents conjugués, Bodipy s’est avéré très efficace pour marquer…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Ce travail a été soutenu par des subventions du Fonds National de la Recherche Scientifique (FNRS-Crédit de Recherche J.0022.20) et de la Société Francophone du Diabète (SFD-Roche Diabetes Care).C.M.S. est titulaire d’une bourse de doctorat du FRIA (FNRS). M.A.D.-L.d.C. a reçu une bourse du Programme d’Excellence Internationale Wallonie-Bruxelles.
Les auteurs remercient Alice Monnier pour sa contribution au développement de ce protocole et Caroline Bouzin pour son expertise et son aide technique dans le processus d’acquisition d’images. Nous remercions également la plateforme d’imagerie 2IP-IREC pour l’accès au cryostat et aux microscopes (2IP-IREC Imaging Platform, Institut de recherche expérimentale et clinique, Université Catholique de Louvain, 1200 Bruxelles, Belgique). Enfin, les auteurs tiennent à remercier Nicolas Dubuisson, Romain Versele et Michel Abou-Samra pour leur critique constructive du manuscrit. Certaines des figures de cet article ont été créées avec BioRender.com.
Materials
| Equipment | |||
| AxioCam 506 mono 6 Mpix camera | Zeiss | ||
| AxioCam MRm 1.4MPix CCD camera | Zeiss | ||
| Chemical hood | Potteau Labo | EN-14175 | |
| Confocal microscope | Zeiss | LSM800 | |
| Cork discs (ø 20 mm, 3 mm thick) | Electron Microscopy Sciences | 63305 | |
| Cryo-Gloves | Tempshield | 16072252 | |
| Cryostat | Thermo Scientific | Microm Cryo Star HM 560 | |
| Dissecting Stereo Microscope SMZ745 | Nikon | ||
| Dry Ice | |||
| Dumont Forceps | F.S.T | 11295-10 | |
| Epifluorescence microscope | Zeiss | AxioImage-Apotome Z1 | |
| Extra Fine Bonn Scissors | F.S.T | 14084-08 | |
| FisherBrand Disposable Base Molds (0.7 x 0.7 cm) | ThermoFisher | 22-363-552 | Used to cut a piece to hold the muscle on the cork for freezing |
| Glass petri dish (H 25 mm, ø 150 mm) | BRAND Petri dish, MERK | BR455751 | Used to place the muscles on ice during dissection |
| ImmEdge Hydrophobic barrier PAP Pen | Vector Labs | H-4000 | Used to create an hidrophobic barrier around the muscle sections |
| Incubator | MMM Medcenter | Incucell 707 | |
| Microscope Cover Glasses (24×50 mm) | Assistent | 40990151 | |
| Microscope Slide Boxes | Kartell | 278 | Used as humid chambers for immunohistochemistry |
| Neck holder | Linie zwo | SB-035X-02 | Used as strap to hold the stainless steel tumbler |
| No 15 Sterile Carbon Steel Scalpel Blade | Swann-Morton | 0205 | |
| Paint brushes | Van Bleiswijck | Amazon B07W7KJQ2X | Used to handle cryosections |
| Permanent Marker Pen Black | Klinipath/VWR | 98307-R | Used to label slides |
| Pierce Fixation Forceps | F.S.T | 18155-13 | |
| Polystyrene Box | H 12 cm x L 25 cm x W 18 cm, used as a liquid nitrogen container and to transport the samples to the cryostat | ||
| Scalpel Handle, 125 mm (5"), No. 3 | Aesculap | BB073R | |
| Stainless Steel Cup 10oz | Eboxer | B07GFCBPFH | Tumbler to fill with isopentene for muscle freezing |
| Superfrost Ultra Plus slides | ThermoFisher | J1800AMNZ | |
| Surgical tweezers 1/2 teeth | Medische Vakhandel | 1303152 | Also called "Rat teeth tweezers" |
| Vannas Spring Scissors – 3 mm Cutting Edge | F.S.T | 15000-00 | |
| Weighing boats | VWR international | 611-2249 | |
| Whole-Slide Scanner for Fluorescence | Zeiss | Axio Scan.Z1 | |
| Reagents | |||
| Alexa Fluor 405 Goat Anti-Mouse IgG2b | Sigma-Aldrich | SAB4600477 | Used at a final concentration of 1:500 |
| Alexa Fluor 488 Goat Anti-Mouse IgG1 | ThermoFisher | A-21121 | Used at a final concentration of 1:500 |
| Alexa Fluor 568 Goat Anti-Mouse IgM | Abcam | ab175702 | Used at a final concentration of 1:1,000 |
| Alexa Fluor 647 goat anti rat-IgG (H+L) secondary antibody | ThermoFisher | A-21247 | Used at a final concentration of 1:500 |
| BODIPY-493/503 (4,4-difluoro-1,3,5,7,8-pentametil-4-bora-3a,4a-diaza-s-indaceno) | ThermoFisher | D3922 | Used at a final concentration of 1 µg/mL |
| BODIPY-558/568 C12 (4,4-Difluoro-5-(2-Thienyl)-4-Bora-3a,4a-Diaza-s-Indacene-3-Dodecanoic Acid) | ThermoFisher | D3835 | Used at a final concentration of 1 µg/mL |
| DAPI (4',6-diamidino-2-phenylindole) | ThermoFisher | D1306 | Used at a final concentration of 0.5 µg/mL |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | D-8418 | Used to solve Bodipy for the 1 mg/mL stock solution. CAUTION: Toxic and flammable. Vapors may cause irritation. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Formaldehyde solution 4%, buffered, pH 6.9 | Sigma-Aldrich | 1004969011 | CAUTION: May cause an allergic skin reaction. Suspected of causing genetic defects. May cause cancer. Manipulate in a fume hood. Avoid direct contact with skin. Wear rubber gloves, protective eye goggles. |
| Isopentane GPR RectaPur | VWR international | 24872.298 | CAUTION: Extremely flammable liquid and vapor. May be fatal if swallowed and enters airways. May cause drowsiness or dizziness. Repeated exposure may cause skin dryness or cracking. Wear protective gloves/protective clothing/eye protection/face protection. |
| Liquid Nitrogen | CAUTION: Extremely cold. Wear gloves. Handle slowly to minimize boiling and splashing and in well ventilated areas. Use containers designed for low-temperature liquids. | ||
| Mouse on mouse Blocking Reagent | Vector Labs | MKB-2213-1 | Used at concentration of 1:30 |
| Myosin heavy chain Type I (BA-D5-s Primary Antibody) Gene: MYH7, monoclonal bovine anti mouse IgG2b | DSHB University of Iowa | BA-D5-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIA (SC-71-s Primary Antibody) Gene: MYH2, Monoclonal bovine anti mouse IgG1 | DSHB University of Iowa | SC-71-supernatant | Used at a final concentration of 1:10 |
| Myosin heavy chain Type IIX (6H1-s Primary Antibody), Gene: MYH1, Monoclonal rabbit anti mouse IgM | Developmental Studies Hybridoma Bank, University of Iowa | 6H1-supernatant | Used at a final concentration of 1:5 |
| Normal Goat Serum (NGS) | Vector Labs | S-1000 | |
| PBS 0.1 M | Commonly used on histology laboratories | ||
| ProLong Gold Antifade Mountant | Invitrogen | P36930 | |
| Rat anti-Laminin-2 (α-2 Chain) primary antibody (monoclonal) | Sigma-Aldrich | L0663 | Used at a final concentration of 1:1,000 |
| Tissue-Tek O.C.T compound | Sakura | 4583 | |
| Software | |||
| Adobe Illustrator CC | Adobe Inc. | Used to design the figures | |
| Adobe Photoshop | Adobe Inc. | Confocal software | |
| BioRender | https://biorender.com/ | Used to design the figures | |
| Fiji/ImageJ | https://imagej.net/software/fiji/ | Used to analyse the acquired images | |
| Microsoft PowerPoint | Microsoft | Used to reconstruct the histology of the whole muscle after scanning the fiber types | |
| Zen Blue 2.6 | Zeiss | Used to reconstruct the histology of the whole muscle after scanning the fiber types |
Riferimenti
- Correa-de-Araujo, R., et al. Myosteatosis in the context of skeletal muscle function deficit: an interdisciplinary workshop at the National Institute on Aging. Frontiers in Physiology. 11, 963 (2020).
- Miljkovic, I., et al. Greater skeletal muscle fat infiltration is associated with higher all-cause and cardiovascular mortality in older men. Journals of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (9), 1133-1140 (2015).
- Nachit, M., et al. Myosteatosis rather than sarcopenia associates with non-alcoholic steatohepatitis in non-alcoholic fatty liver disease preclinical models. Journal of Cachexia, Sarcopenia, and Muscle. 12 (1), 144-158 (2021).
- Aleixo, G. F. P., et al. Myosteatosis and prognosis in cancer: Systematic review and meta-analysis. Critical Reviews in Oncology/Hematolgoy. 145, 102839 (2020).
- Gemmink, A., Schrauwen, P., Hesselink, M. K. C. Exercising your fat (metabolism) into shape: a muscle-centred view. Diabetologia. 63 (8), 1453-1463 (2020).
- van Loon, L. J. Use of intramuscular triacylglycerol as a substrate source during exercise in humans. Journal of Applied Physiology. 97 (4), 1170-1187 (2004).
- Coen, P. M., Goodpaster, B. H. Role of intramyocelluar lipids in human health. Trends in Endocrinology and Metabolism. 23 (8), 391-398 (2012).
- Seibert, J. T., Najt, C. P., Heden, T. D., Mashek, D. G., Chow, L. S. Muscle lipid droplets: cellular signaling to exercise physiology and beyond. Trends in Endocrinology and Metabolism. 31 (12), 928-938 (2020).
- Bergman, B. C., Goodpaster, B. H. Exercise and muscle lipid content, composition, and localization: influence on muscle insulin sensitivity. Diabetes. 69 (5), 848-858 (2020).
- Nielsen, J., Christensen, A. E., Nellemann, B., Christensen, B. Lipid droplet size and location in human skeletal muscle fibers are associated with insulin sensitivity. American Journal of Physiology-Endocrinology and Metabolism. 313 (6), 721-730 (2017).
- Covington, J. D., et al. Intramyocellular lipid droplet size rather than total lipid content is related to insulin sensitivity after 8 weeks of overfeeding. Obesity (Silver Spring). 25 (12), 2079-2087 (2017).
- Bosma, M. Lipid droplet dynamics in skeletal muscle). Experimental Cell Research. 340 (2), 180-186 (2016).
- Nielsen, J., et al. Increased subsarcolemmal lipids in type 2 diabetes: effect of training on localization of lipids, mitochondria, and glycogen in sedentary human skeletal muscle. American Journal of Physiology-Endocrinology and Metabolism. 298 (3), 706-713 (2010).
- Ferreira, R., et al. Subsarcolemmal and intermyofibrillar mitochondria proteome differences disclose functional specializations in skeletal muscle. Proteomics. 10 (17), 3142-3154 (2010).
- Barrett, J. S., Whytock, K. L., Strauss, J. A., Wagenmakers, A. J. M., Shepherd, S. O. High intramuscular triglyceride turnover rates and the link to insulin sensitivity: influence of obesity, type 2 diabetes and physical activity. Applied Physiology, Nutrition and Metabolism. , 1-14 (2022).
- Daemen, S., et al. Distinct lipid droplet characteristics and distribution unmask the apparent contradiction of the athlete’s paradox. Molecular Metabolism. 17, 71-81 (2018).
- Bredella, M. A., Ghomi, R. H., Thomas, B. J., Miller, K. K., Torriani, M. Comparison of 3.0 T proton magnetic resonance spectroscopy short and long echo-time measures of intramyocellular lipids in obese and normal-weight women. Journal of Magnetic Resonance Imaging. 32 (2), 388-393 (2010).
- Schrauwen-Hinderling, V. B., Hesselink, M. K., Schrauwen, P., Kooi, M. E. Intramyocellular lipid content in human skeletal muscle. Obesity (Silver Spring). 14 (3), 357-367 (2006).
- De Bock, K., et al. Evaluation of intramyocellular lipid breakdown during exercise by biochemical assay, NMR spectroscopy, and Oil Red O staining. American Journal of Physiology-Endocrinology and Metabolism. 293 (1), 428-434 (2007).
- Koopman, R., Schaart, G., Hesselink, M. K. Optimisation of oil red O staining permits combination with immunofluorescence and automated quantification of lipids. Histochemistry and Cell Biology. 116 (1), 63-68 (2001).
- Gueugneau, M., et al. Skeletal muscle lipid content and oxidative activity in relation to muscle fiber type in aging and metabolic syndrome. Journal of Gerontology Series A: Biomedical Sciences and Medical Sciences. 70 (5), 566-576 (2015).
- Gemmink, A., et al. Super-resolution microscopy localizes perilipin 5 at lipid droplet-mitochondria interaction sites and at lipid droplets juxtaposing to perilipin 2. Biochimica et Biophysica Acta-Molecular and Cell Biology of Lipids. 1863 (11), 1423-1432 (2018).
- Spangenburg, E. E., Pratt, S. J. P., Wohlers, L. M., Lovering, R. M. Use of BODIPY (493/503) to visualize intramuscular lipid droplets in skeletal muscle. Journal of Biomedicine and Biotechnology. 598358, (2011).
- Prats, C., et al. An optimized histochemical method to assess skeletal muscle glycogen and lipid stores reveals two metabolically distinct populations of type I muscle fibers. PLoS One. 8 (10), 77774 (2013).
- Strauss, J. A., Shepherd, D. A., Macey, M., Jevons, E. F. P., Shepherd, S. O. Divergence exists in the subcellular distribution of intramuscular triglyceride in human skeletal muscle dependent on the choice of lipid dye. Histochemistry and Cell Biology. 154 (4), 369-382 (2020).
- Shepherd, S. O., et al. Sprint interval and traditional endurance training increase net intramuscular triglyceride breakdown and expression of perilipin 2 and 5. Journal of Physiology. 591 (3), 657-675 (2013).
- Whytock, K. L., et al. A 7-day high-fat, high-calorie diet induces fibre-specific increases in intramuscular triglyceride and perilipin protein expression in human skeletal muscle. Journal of Physiology. 598 (6), 1151-1167 (2020).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using h&e staining and muscle fiber type classification using immunofluorescence staining. Bio-Protocol. 7 (10), (2017).
- Meng, H., et al. Tissue triage and freezing for models of skeletal muscle disease. Journal of Visualized Experiments: JoVE. (89), e51586 (2014).
- Kumar, A., Accorsi, A., Rhee, Y., Girgenrath, M. Do’s and don’ts in the preparation of muscle cryosections for histological analysis. Journal of Visualized Experiments: JoVE. (99), e52793 (2015).
- Leiva-Cepas, F., et al. Laboratory methodology for the histological study of skeletal muscle. Archivos de Medicina del Deporte. 35 (186), 254-262 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Schiaffino, S., et al. Three myosin heavy chain isoforms in type 2 skeletal muscle fibres. Journal of Muscle Research & Cell Motility. 10 (3), 197-205 (1989).
- Komiya, Y., et al. Mouse soleus (slow) muscle shows greater intramyocellular lipid droplet accumulation than EDL (fast) muscle: fiber type-specific analysis. Journal of Muscle Research & Cell Motility. 38 (2), 163-173 (2017).
- Andrich, D. E., et al. Altered lipid metabolism impairs skeletal muscle force in young rats submitted to a short-term high-fat diet. Frontiers in Physiology. 9, 1327 (2018).
- Schiaffino, S. Fibre types in skeletal muscle: a personal account. Acta Physiologica. 199 (4), 451-463 (2010).
- Bloemberg, D., Quadrilatero, J. Rapid determination of myosin heavy chain expression in rat, mouse, and human skeletal muscle using multicolor immunofluorescence analysis. PLoS One. 7 (4), 35273 (2012).
- Gemmink, A., et al. Decoration of intramyocellular lipid droplets with PLIN5 modulates fasting-induced insulin resistance and lipotoxicity in humans. Diabetologia. 59 (5), 1040-1048 (2016).
- Askinas, C., et al. . Biophotonics Congress: Biomedical Optics Congress 2018 (Microscopy/Translational/Brain/OTS). , (2018).
- Morén, B., et al. EHD2 regulates adipocyte function and is enriched at cell surface-associated lipid droplets in primary human adipocytes. Molecular Biology of the Cell. 30 (10), 1147-1159 (2019).
- Benador, I. Y., et al. Mitochondria bound to lipid droplets have unique bioenergetics, composition, and dynamics that support lipid droplet expansion. Cell Metabolism. 27 (4), 869-885 (2018).
- de la Rosa Rodriguez, M. A., et al. Hypoxia-inducible lipid droplet-associated induces DGAT1 and promotes lipid storage in hepatocytes. Molecular Metabolism. 47, 101168 (2021).
- Jevons, E. F. P., Gejl, K. D., Strauss, J. A., Ørtenblad, N., Shepherd, S. O. Skeletal muscle lipid droplets are resynthesized before being coated with perilipin proteins following prolonged exercise in elite male triathletes. American Journal of Physiology-Endocrinology and Metabolism. 318 (3), 357-370 (2020).
- Ohsaki, Y., Maeda, T., Fujimoto, T. Fixation and permeabilization protocol is critical for the immunolabeling of lipid droplet proteins. Histochemistry and Cell Biology. 124 (5), 445-452 (2005).
- Prats, C., et al. Decrease in intramuscular lipid droplets and translocation of HSL in response to muscle contraction and epinephrine. Journal of Lipid Research. 47 (11), 2392-2399 (2006).
- Listenberger, L. L., Brown, D. A. Fluorescent detection of lipid droplets and associated proteins. Current Protocols in Cell Biology. , (2007).
- Xue, Y., Lim, S., Bråkenhielm, E., Cao, Y. Adipose angiogenesis: quantitative methods to study microvessel growth, regression and remodeling in vivo. Nature Protocols. 5 (5), 912-920 (2010).
- Muliyil, S., et al. ADAM17-triggered TNF signalling protects the ageing Drosophila retina from lipid droplet-mediated degeneration. The EMBO Journal. 39 (17), 104415 (2020).
- Yan, Q., et al. Autophagy activation contributes to lipid accumulation in tubular epithelial cells during kidney fibrosis. Cell Death Discovery. 4, 2 (2018).
- Coassin, S., et al. Investigation and functional characterization of rare genetic variants in the adipose triglyceride lipase in a large healthy working population. PLoS Genetics. 6 (12), 1001239 (2010).
- Daemen, S., van Zandvoort, M., Parekh, S. H., Hesselink, M. K. C. Microscopy tools for the investigation of intracellular lipid storage and dynamics. Molecular Metabolism. 5 (3), 153-163 (2016).
- Chen, Q., et al. Rab8a deficiency in skeletal muscle causes hyperlipidemia and hepatosteatosis by impairing muscle lipid uptake and storage. Diabetes. 66 (9), 2387-2399 (2017).
- Gemmink, A., et al. Decoration of myocellular lipid droplets with perilipins as a marker for in vivo lipid droplet dynamics: A super-resolution microscopy study in trained athletes and insulin resistant individuals. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids. 1866 (2), 158852 (2021).
- Bergman, B. C., Hunerdosse, D. M., Kerege, A., Playdon, M. C., Perreault, L. Localisation and composition of skeletal muscle diacylglycerol predicts insulin resistance in humans. Diabetologia. 55 (4), 1140-1150 (2012).

