मानव अग्नाशय के ऊतकों से एन-ग्लाइकोपेप्टाइड्स और फॉस्फोपेप्टाइड्स के एक साथ विश्लेषण के लिए एक स्पिन-टिप संवर्धन रणनीति
Summary
पोस्ट-ट्रांसलेशनल संशोधन (पीटीएम) प्रोटीन संरचनाओं और कार्यों को बदलते हैं। कई पीटीएम प्रकारों के एक साथ संवर्धन के तरीके विश्लेषण में कवरेज को अधिकतम कर सकते हैं। हम अग्नाशयी ऊतकों में प्रोटीन एन-ग्लाइकोसिलेशन और फॉस्फोराइलेशन के एक साथ संवर्धन और विश्लेषण के लिए मास स्पेक्ट्रोमेट्री के बाद दोहरी कार्यात्मक टीआई (चतुर्थ) -स्थिर धातु आत्मीयता क्रोमैटोग्राफी का उपयोग करके एक प्रोटोकॉल प्रस्तुत करते हैं।
Abstract
मास स्पेक्ट्रोमेट्री पोस्ट-ट्रांसलेशनल संशोधनों (पीटीएम) का गहरा कवरेज प्रदान कर सकता है, हालांकि जटिल जैविक मैट्रिक्स से इन संशोधनों का संवर्धन अक्सर गैर-संशोधित विश्लेषणों की तुलना में उनके कम स्टोइकोमेट्री के कारण आवश्यक होता है। बॉटम-अप प्रोटिओमिक्स वर्कफ़्लो में पेप्टाइड्स पर पीटीएम के अधिकांश संवर्धन वर्कफ़्लो, जहां परिणामस्वरूप पेप्टाइड्स का विश्लेषण करने से पहले प्रोटीन एंजाइमेटिक रूप से पच जाते हैं, केवल एक प्रकार के संशोधन को समृद्ध करते हैं। हालांकि, यह पीटीएम का पूरा पूरक है, जो जैविक कार्यों की ओर जाता है, और एक प्रकार के पीटीएम का संवर्धन पीटीएम के इस तरह के क्रॉसस्टॉक को याद कर सकता है पीटीएम क्रॉसस्टॉक प्रोटीन ग्लाइकोसिलेशन और फॉस्फोराइलेशन के बीच देखा गया है, मानव प्रोटीन में दो सबसे आम पीटीएम और मास स्पेक्ट्रोमेट्री वर्कफ़्लो का उपयोग करके दो सबसे अधिक अध्ययन किए गए पीटीएम भी। यहां वर्णित एक साथ संवर्धन रणनीति का उपयोग करते हुए, दोनों पीटीएम पोस्टमार्टम मानव अग्नाशयी ऊतक, एक जटिल जैविक मैट्रिक्स से समृद्ध हैं। दोहरी कार्यात्मक टीआई (चतुर्थ) -स्थिर धातु आत्मीयता क्रोमैटोग्राफी का उपयोग एक सुविधाजनक स्पिन टिप-आधारित विधि में कई अंशों में एक साथ ग्लाइकोसिलेशन और फॉस्फोराइलेशन के विभिन्न रूपों को अलग करने के लिए किया जाता है, जिससे संभावित पीटीएम क्रॉसस्टॉक इंटरैक्शन के डाउनस्ट्रीम विश्लेषण की अनुमति मिलती है। ग्लाइको- और फॉस्फोपेप्टाइड्स के लिए यह संवर्धन वर्कफ़्लो कई पीटीएम की गहरी प्रोफाइलिंग प्राप्त करने और भविष्य के अध्ययनों के लिए संभावित लक्ष्य अणुओं की पहचान करने के लिए विभिन्न नमूना प्रकारों पर लागू किया जा सकता है।
Introduction
प्रोटीन पोस्ट-ट्रांसलेशनल संशोधन (पीटीएम) प्रोटीन संरचनाओं और परिणामस्वरूप उनके कार्यों और डाउनस्ट्रीम जैविक प्रक्रियाओं को संशोधित करने में एक प्रमुख भूमिका निभाते हैं। विभिन्न पीटीएम द्वारा वहन की गई संयोजक परिवर्तनशीलता के कारण मानव प्रोटिओम की विविधता तेजी से बढ़ जाती है जीनोम द्वारा भविष्यवाणी की गई उनके विहित अनुक्रमों से प्रोटीन के विभिन्न रूपों को प्रोटियोफॉर्म के रूप में जाना जाता है, और कई प्रोटियोफॉर्म पीटीएम1 से उत्पन्न होते हैं। स्वास्थ्य और बीमारी में प्रोटियोफॉर्म विविधता का अध्ययन हाल के वर्षों में बहुत रुचि के अनुसंधान का एक क्षेत्र बन गया है 2,3.
मास स्पेक्ट्रोमेट्री (एमएस) आधारित प्रोटिओमिक्स विधियों के विकास के माध्यम से प्रोटिओफॉर्म और अधिक विशेष रूप से बड़ी गहराई वाले पीटीएम का अध्ययन अधिक आसान हो गया है। एमएस का उपयोग करके, विश्लेषणों को आयनित, खंडित और टुकड़ों के एम / जेड के आधार पर पहचाना जाता है। प्रोटीन के गैर-संशोधित रूपों की तुलना में पीटीएम की कम सापेक्ष बहुतायत के कारण संवर्धन विधियां अक्सर आवश्यक होती हैं। हालांकि बरकरार प्रोटीन और उनके पीटीएम का विश्लेषण, जिसे टॉप-डाउन विश्लेषण कहा जाता है, अधिक नियमित हो गए हैं, प्रोटीन के एंजाइमी पाचन और बॉटम-अप विश्लेषण में उनके घटक पेप्टाइड्स का विश्लेषण अभी भी पीटीएम विश्लेषण के लिए सबसे व्यापक रूप से उपयोग किया जाने वाला मार्ग है। दो सबसे व्यापक रूप से अध्ययन किए गए पीटीएम, और विवो में दो सबसे आम पीटीएम, ग्लाइकोसिलेशन और फॉस्फोराइलेशन4 हैं। ये दो पीटीएम सेल सिग्नलिंग और मान्यता में प्रमुख भूमिका निभाते हैं और इस प्रकार रोग अनुसंधान में विशेषता के लिए महत्वपूर्ण संशोधन हैं।
विभिन्न पीटीएम के रासायनिक गुण अक्सर विश्लेषण से पहले प्रोटीन और पेप्टाइड स्तरों पर इन पीटीएम के संवर्धन की दिशा में मार्ग प्रदान करते हैं। प्रत्येक मोनोसेकेराइड पर हाइड्रॉक्सिल समूहों की प्रचुरता के कारण ग्लाइकोसिलेशन एक हाइड्रोफिलिक पीटीएम है। इस संपत्ति का उपयोग हाइड्रोफिलिक इंटरैक्शन क्रोमैटोग्राफी (एचआईएलआईसी) में ग्लाइकोपेप्टाइड्स को समृद्ध करने के लिए किया जा सकता है, जो हाइड्रोफोबिक गैर-संशोधित पेप्टाइड्स5 से अधिक हाइड्रोफिलिक ग्लाइकोपेप्टाइड्स को अलग कर सकता है। फॉस्फोराइलेशन फॉस्फेट मॉइटी को जोड़ता है, जिसे अम्लीय पीएच को छोड़कर नकारात्मक रूप से चार्ज किया जाता है। इस चार्ज के कारण, टाइटेनियम सहित विभिन्न धातु उद्धरणों का उपयोग फॉस्फोपेप्टाइड्स को आकर्षित करने और बांधने के लिए किया जा सकता है जबकि गैर-फॉस्फोराइलेटेड प्रजातियां धोई जाती हैं। यह स्थिर धातु आत्मीयता क्रोमैटोग्राफी (आईएमएसी) का सिद्धांत है। ग्लाइकोसिलेशन और फॉस्फोराइलेशन के लिए इन और अन्य संवर्धन रणनीतियों की आगे की चर्चा हाल की समीक्षा 6,7 में पाई जा सकती है।
पेप्टाइड्स पर पीटीएम की कम स्टोइकोमेट्री के कारण संवर्धन प्रोटोकॉल के लिए पेप्टाइड सामग्री (0.5 मिलीग्राम या उससे अधिक) की तुलनात्मक रूप से बड़ी मात्रा में अक्सर आवश्यकता होती है। उन परिदृश्यों में जहां नमूने की यह मात्रा आसानी से प्राप्त नहीं की जा सकती है, जैसे कि ट्यूमर कोर बायोप्सी या मस्तिष्कमेरु द्रव विश्लेषण, आसान वर्कफ़्लो का उपयोग करना फायदेमंद है जिसके परिणामस्वरूप अधिकतम जैव आणविक जानकारी होती है। हमारी प्रयोगशाला और अन्य लोगों द्वारा विकसित हालिया रणनीतियों ने एक ही पीटीएम संवर्धन वर्कफ़्लो 8,9,10,11,12 का उपयोग करके ग्लाइकोसिलेशन और फॉस्फोराइलेशन के एक साथ और समानांतर विश्लेषण पर प्रकाश डाला है। यद्यपि इन दो पीटीएम के रासायनिक गुण भिन्न हो सकते हैं, लेकिन अभिनव पृथक्करण तकनीकों और उपयोग की जाने वाली सामग्रियों के कारण इन पीटीएम का विश्लेषण कई चरणों में किया जा सकता है। उदाहरण के लिए, इलेक्ट्रोस्टैटिक प्रतिकर्षण-हाइड्रोफिलिक इंटरैक्शन क्रोमैटोग्राफी (ईआरएलआईसी) विश्लेषणों और स्थिर चरण सामग्री 13,14,15,16 के बीच चार्ज-चार्ज इंटरैक्शन के साथ विश्लेषण और मोबाइल चरण के बीच हाइड्रोफिलिक इंटरैक्शन के आधार पर पृथक्करण को ओवरले करता है। अम्लीय पीएच पर, स्थिर चरण में फॉस्फोराइलेटेड पेप्टाइड्स का आकर्षण गैर-संशोधित पेप्टाइड्स से उनके प्रतिधारण और पृथक्करण में सुधार कर सकता है। हाइड्रोफिलिक माइक्रोस्फीयर पर स्थिर टीआई (चतुर्थ) से युक्त सामग्री का उपयोग फॉस्फोपेप्टाइड्स और तटस्थ, अम्लीय और मैनोज -6-फॉस्फोराइलेटेड ग्लाइकोपेप्टाइड्स17,18 को अलग करने के लिए एचआईएलआईसी और आईएमएसी-आधारित क्षालन के लिए किया जा सकता है। इस रणनीति को दोहरे कार्यात्मक टीआई (चतुर्थ) -आईएमएसी के रूप में जाना जाता है। एक ही वर्कफ़्लो में कई पीटीएम को समृद्ध करने के लिए इन रणनीतियों का उपयोग संभावित पीटीएम क्रॉसस्टॉक इंटरैक्शन के विश्लेषण को अधिक सुलभ बना सकता है। इसके अतिरिक्त, कुल नमूना राशि और समय की आवश्यकताएं पारंपरिक संवर्धन विधियों से कम होती हैं जब समानांतर (यानी, अलग-अलग नमूना विभाज्य पर एचआईएलआईसी और आईएमएसी) में प्रदर्शन किया जाता है।
प्रोटीन ग्लाइकोसिलेशन और फॉस्फोराइलेशन के एक साथ विश्लेषण के लिए दोहरी कार्यात्मक टीआई (चतुर्थ) -आईएमएसी रणनीति का प्रदर्शन करने के लिए, हमने इसे पोस्टमार्टम मानव अग्नाशयी ऊतकों का विश्लेषण करने के लिए लागू किया है। अग्न्याशय इंसुलिन और ग्लूकागन सहित पाचन एंजाइम और नियामक हार्मोन दोनों का उत्पादन करता है। अग्नाशयी रोग में अग्नाशयी कार्य बिगड़ा हुआ है। मधुमेह में, रक्त शर्करा का विनियमन प्रभावित होता है, जिससे रक्त में ग्लूकोज का स्तर अधिक होता है। अग्नाशयशोथ में, अंग के ऑटो-पाचन से सूजन होती है3. ग्लाइकोसिलेशन और फॉस्फोराइलेशन सहित पीटीएम प्रोफाइल में परिवर्तन, अन्य बीमारियों में अक्सर होता है, जैसा कि अक्सर होता है।
यहां, हम अग्नाशयी ऊतक से निकाले गए प्रोटीन से प्राप्त एन-ग्लाइकोपेप्टाइड्स और फॉस्फोपेप्टाइड्स के लिए दोहरी कार्यात्मक टीआई (चतुर्थ) -आईएमएसी रणनीति के आधार पर स्पिन-टिप आधारित एक साथ संवर्धन विधि के लिए एक प्रोटोकॉल का वर्णन करते हैं। प्रोटोकॉल में प्रोटीन निष्कर्षण और पाचन, संवर्धन, एमएस डेटा संग्रह और डेटा प्रोसेसिंग शामिल हैं, जैसा कि चित्रा 1 में देखा जा सकता है। इस अध्ययन से प्रतिनिधि डेटा पहचानकर्ता पीएक्सडी 033065 के साथ प्रोटिओमएक्सचेंज कंसोर्टियम के माध्यम से उपलब्ध हैं।
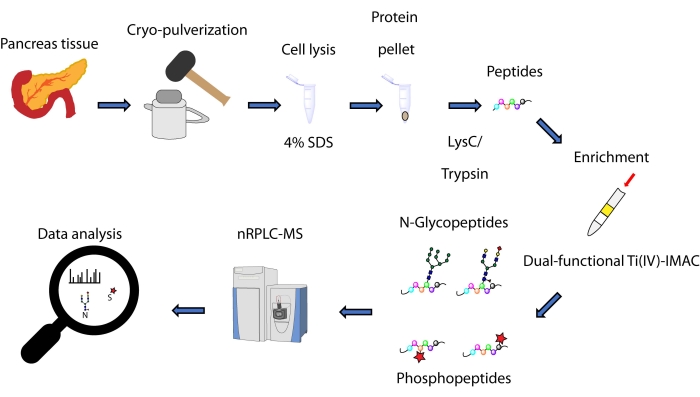
चित्रा 1: मानव अग्नाशयी ऊतकों से एन-ग्लाइकोपेप्टाइड्स और फॉस्फोपेप्टाइड्स के एक साथ विश्लेषण के लिए वर्कफ़्लो। डिटर्जेंट सोडियम डोडेसिल सल्फेट (एसडीएस) का उपयोग करके प्रोटीन निष्कर्षण से पहले ऊतकों को पहले एक महीन पाउडर में क्रायो-चूर्णित किया जाता है। प्रोटीन तब एंजाइमी पाचन के अधीन होते हैं। परिणामी पेप्टाइड्स को दोहरे कार्यात्मक टीआई (चतुर्थ) -आईएमएसी का उपयोग करके संवर्धन से पहले विभाज्य किया जाता है। कच्चे डेटा को नैनोस्केल रिवर्स फेज लिक्विड क्रोमैटोग्राफी-मास स्पेक्ट्रोमेट्री (एनआरपीएलसी-एमएस) का उपयोग करके एकत्र किया जाता है और डेटाबेस खोज सॉफ्टवेयर का उपयोग करके विश्लेषण किया जाता है। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
इस प्रोटोकॉल का उद्देश्य पीटीएम विश्लेषण को अधिक सुलभ बनाना और एक ही वर्कफ़्लो में कई पीटीएम के अधिक व्यापक विश्लेषण को सक्षम करना है। इस प्रोटोकॉल को कोशिकाओं और बायोफ्लुइड्स सहित अन्य जटिल जैविक मैट्रिक्स पर लागू किया जा सकता है।
Protocol
Representative Results
Discussion
दोहरी कार्यात्मक टीआई (चतुर्थ) -आईएमएसी रणनीति एक एकल नमूना तैयारी वर्कफ़्लो में एक ही नमूने से एन-ग्लाइकोपेप्टाइड्स और फॉस्फोपेप्टाइड्स के एक साथ विश्लेषण के लिए उपयोगी है। पीटीएम के एक साथ संवर्धन ?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
इस शोध को एनआईएच (आर 01 डीके 071801, आरएफ 1 एजी 052324, पी 01 सीए 250 9 72, और आर 21 एजी 065728), और किशोर मधुमेह अनुसंधान फाउंडेशन (1-पीएनएफ -2016-250-एस-बी और एसआरए -2016-168-एस-बी) से अनुदान वित्त पोषण द्वारा भाग में समर्थित किया गया था। यहां प्रस्तुत डेटा विस्कॉन्सिन इंस्टीट्यूट फॉर क्लिनिकल एंड ट्रांसलेशनल रिसर्च विश्वविद्यालय के माध्यम से एनआईएच / एनसीएटीएस यूएल 1 टीआर 002373 पुरस्कार से समर्थन के माध्यम से प्राप्त किया गया था। ऑर्बिट्रेप उपकरणों को एनआईएच साझा साधन अनुदान (एनआईएच-एनसीआरआर एस 10आरआर 029531) और विस्कॉन्सिन-मैडिसन विश्वविद्यालय में अनुसंधान और स्नातक शिक्षा के लिए कुलपति के कार्यालय के समर्थन के माध्यम से खरीदा गया था। हम विस्कॉन्सिन अंग और ऊतक दान संगठन विश्वविद्यालय के उदार समर्थन को भी स्वीकार करना चाहते हैं जिन्होंने अनुसंधान के लिए मानव अग्न्याशय प्रदान किया और हमारी प्रयोगशाला में नमूने प्रदान करने के लिए डैन ट्रेमेल, डॉ सारा डी सैकेट और प्रोफेसर जॉन ओडोरिको की मदद की। हमारी शोध टीम उन परिवारों को विशेष धन्यवाद देना चाहती है जिन्होंने इस अध्ययन के लिए ऊतकों को दान किया। एलएल एनआईएच अनुदान एस 10 ओडी025084, विस्कॉन्सिन कार्बोन कैंसर सेंटर (233-एएआई 9 632) विश्वविद्यालय से एक अग्न्याशय कैंसर पायलट अनुदान, साथ ही एक विलास प्रतिष्ठित उपलब्धि प्रोफेसरशिप और चार्ल्स मेलबोर्न जॉनसन प्रतिष्ठित चेयर प्रोफेसरशिप को विस्कॉन्सिन पूर्व छात्र अनुसंधान फाउंडेशन और विस्कॉन्सिन विश्वविद्यालय-मैडिसन स्कूल ऑफ फार्मेसी द्वारा प्रदान किए गए धन के साथ स्वीकार करता है।
Materials
| Acetic Acid, Glacial (Certified ACS) | Fisher Scientific | A38S-500 | |
| Acetone (Certified ACS) | Fisher Scientific | A18-1 | |
| Acetonitrile, Optima LC/MS Grade | Fisher Scientific | A955-4 | |
| Ammonium Acetate (Crystalline/Certified ACS) | Fisher Scientific | A637-500 | |
| Ammonium Hydroxide (Certified ACS Plus) | Fisher Scientific | A669-212 | |
| Byonic software | Protein Metrics | n/a | Commercial software used for glycoproteomic analysis (https://proteinmetrics.com/byos/) |
| C18 BEH material | Waters | 186002353 | Material removed from column and used to pack nano capillaries (pulledto integrate tip used directly in line with instrument inlet) |
| CAE-Ti-IMAC, 100% | J&K Scientific | 2749380-1G | Material used for dual-functional Ti(IV)-IMAC; can also be used for conventional IMAC/conventional phosphopeptide enrichment |
| Cellcrusher kit | Cellcrusher | n/a | Used for grinding tissue samples into powder before extraction |
| Eppendorf 5424R Microcentrifuge | Fisher Scientific | 05-401-205 | For temperature-controlled centrifugation |
| cOmplete protease inhibitor cocktail tablets | Sigma | 11697498001 | |
| DTT, Molecular Grade (DL-Dithiothreitol) | Promega | V3151 | Protein reducing agent |
| Ethanol, 200 proof (100%), USP | Fisher | 22-032-601 | |
| Fisherbrand Analog Vortex Mixer | Fisher Scientific | 02-215-414 | |
| Fisherbrand Low-Retention Microcentrifuge Tubes (1.5 mL) | Fisher Scientific | 02-681-320 | |
| Fisherbrand Low-Retention Microcentrifuge Tubes (2 mL) | Fisher Scientific | 02-681-321 | |
| Fisherbrand Model 120 Sonic Dismembrator | Fisher Scientific | FB120110 | For sample lysis using ultrasonication |
| Formic Acid, 99.0+%, Optima LC/MS Grade | Fisher Scientific | A117-50 | |
| Fused silica capillary (75 μm inner diameter, 360 μm outer diameter) | Polymicro Technologies LLC | 100 m TSP075375 | For in-house pulled and packed columns with integrated emitter |
| Hydrofluoric acid (48 wt. % in H2O) | Sigma-Aldrich | 339261-100ML | Used for opening emitter of pulled capillary column |
| Iodoacetamide, BioUltra | Sigma | I1149-5G | Protein reducing reagent |
| MaxQuant software | n/a | n/a | Free software used for phosphoproteomic analysis (https://www.maxquant.org/) |
| Multi-therm Shaker with heating and cooling | Benchmark Scientific | H5000-HC | Heating block |
| Oasis HLB 1 cc Vac Cartridge, 10 mg Sorbent per Cartridge, 30 µm, 100/pk | Waters | 186000383 | Larger-scale cartridge desalting for tryptic digests (loading capacity approximately up to 1 mg each) |
| OMIX C18 pipette tips, 100 µL tip, 10 – 100 μL elution volume, 1 x 96 tips | Agilent | A57003100 | Smaller-scale packed pipette tip for desalting for enrichment elutions |
| P-2000 Micropipette Puller | Sutter Instrument Co. | P-2000/F | For pulling nano-capillary columns for LC-MS |
| PhosSTOP phosphatase inhibitor tablets | Sigma | 4906845001 | |
| Pierce BCA Protein Assay Kit | Thermo Fisher Scientific | 23225 | |
| Pierce Quantitative Colorimetric Peptide Assay | Thermo Fisher Scientific | 23275 | |
| PolySAX LP (12 μm, pore size 300 Å) | PolyLC | BMSX1203 | Material for strong anion-exchange chromatography used for ERLIC/conventional glycopeptide enrichment |
| Potassium Phosphate Monobasic (Crystalline/Certified ACS) | Fisher Scientific | P285-500 | |
| Pressure injection cell with integrated magnetic stirplate | Next Advance | PC77-MAG | For packing nano-capillary columns with stationary phase up to 2500 psi limit |
| Proteome Discoverer software | Thermo Fisher Scientific | n/a | Commercial software for proteomics anaysis (with integrated database searching software nodes) and data visualization (https://www.thermofisher.com/us/en/home/industrial/mass-spectrometry/liquid-chromatography-mass-spectrometry-lc-ms/lc-ms-software/multi-omics-data-analysis/proteome-discoverer-software.html) |
| SpeedVac SC110 Vacuum Concentrator Model SC110-120 | Savant | n/a | Centrifugal vacuum concentrator for drying samples (under heat) |
| SDS Solution, 10% Sodium Dodecyl Sulfate Solution, Molecular Biology/Electrophoresis | Fisher Scientific | BP2436200 | |
| Sequencing Grade Modified Trypsin | Promega | V5111 | |
| Sodium Chloride (Crystalline/Certified ACS) | Fisher Scientific | S271-500 | |
| TopTip, Empty, 10-200 µL, Pack of 96 | Glygen Corporation | TT2EMT.96 | Empty pipette tip with micron-sized hole used that can be used to pack chromatographic materials for enrichments, bundled with tube adapters |
| Triethylammonium bicarbonate buffer (TEAB, 1 M, pH 8.5 (volatile)) | Sigma | 90360-100ML | |
| Trifluoroacetic acid, Reagent Grade, 99% | Fisher Scientific | 60-017-61 | |
| Tris Base (White Crystals or Crystalline Powder/Molecular Biology) | Fisher Scientific | BP152-500 | |
| Trypsin/Lys-C Mix, Mass Spec Grade | Promega | V5071 | |
| Urea (Certified ACS) | Fisher Scientific | U15-500 | |
| Water, Optima LC/MS Grade | Fisher Scientific | W64 |
Riferimenti
- Smith, L. M., Kelleher, N. L. Proteoform: a single term describing protein complexity. Nature Methods. 10 (3), 186-187 (2013).
- Pan, S., Brentnall, T. A., Chen, R. Glycoproteins and glycoproteomics in pancreatic cancer. World Journal of Gastroenterology. 22 (42), 9288-9299 (2016).
- Tabang, D. N., Ford, M., Li, L. Recent advances in mass spectrometry-based glycomic and glycoproteomic studies of pancreatic diseases. Frontiers in Chemistry. 9, 707387 (2021).
- Khoury, G. A., Baliban, R. C., Floudas, C. A. Proteome-wide post-translational modification statistics: frequency analysis and curation of the swiss-prot database. Scientific Reports. 1, 90 (2011).
- Alpert, A. J. Hydrophilic-interaction chromatography for the separation of peptides, nucleic acids and other polar compounds. Journal of Chromatography A. 499, 177-196 (1990).
- Riley, N. M., Bertozzi, C. R., Pitteri, S. J. A pragmatic guide to enrichment strategies for mass spectrometry-based glycoproteomics. Molecular & Cellular Proteomics. 20, 100029 (2020).
- Low, T. Y., et al. Widening the bottleneck of phosphoproteomics: Evolving strategies for phosphopeptide enrichment. Mass Spectrometry Reviews. 40 (4), 309-333 (2021).
- Cho, K. C., Chen, L., Hu, Y., Schnaubelt, M., Zhang, H. Developing workflow for simultaneous analyses of phosphopeptides and glycopeptides. ACS Chemical Biology. 14 (1), 58-66 (2019).
- Zhou, Y., et al. An integrated workflow for global, glyco-, and phospho-proteomic analysis of tumor tissues. Analytical Chemistry. 92 (2), 1842-1849 (2020).
- Tang, R., et al. Facile preparation of bifunctional adsorbents for efficiently enriching N-glycopeptides and phosphopeptides. Analytica Chimica Acta. 1144, 111-120 (2021).
- Wang, Z., Wang, J., Sun, N., Deng, C. A promising nanoprobe based on hydrophilic interaction liquid chromatography and immobilized metal affinity chromatography for capture of glycopeptides and phosphopeptides. Analytica Chimica Acta. 1067, 1-10 (2019).
- Glover, M. S., et al. Characterization of intact sialylated glycopeptides and phosphorylated glycopeptides from IMAC enriched samples by EThcD fragmentation: Toward combining phosphoproteomics and glycoproteomics. International Journal of Mass Spectrometry. 427, 35-42 (2018).
- Alpert, A. J. Electrostatic repulsion hydrophilic interaction chromatography for isocratic separation of charged solutes and selective isolation of phosphopeptides. Analytical Chemistry. 80 (1), 62-76 (2008).
- Cui, Y., et al. Counterion optimization dramatically improves selectivity for phosphopeptides and glycopeptides in electrostatic repulsion-hydrophilic interaction chromatography. Analytical Chemistry. 93 (22), 7908-7916 (2021).
- Cui, Y., et al. Finding the sweet spot in ERLIC mobile phase for simultaneous enrichment of N-Glyco and phosphopeptides. Journal of the American Society for Mass Spectrometry. 30 (12), 2491-2501 (2019).
- Tabang, D. N., et al. Analysis of pancreatic extracellular matrix protein post-translational modifications via electrostatic repulsion-hydrophilic interaction chromatography coupled with mass spectrometry. Molecular Omics. 17 (5), 652-664 (2021).
- Huang, J., et al. Dual-functional Titanium(IV) immobilized metal affinity chromatography approach for enabling large-scale profiling of protein Mannose-6-Phosphate glycosylation and revealing its predominant substrates. Analytical Chemistry. 91 (18), 11589-11597 (2019).
- Huang, J., et al. Dual-functional Ti(IV)-IMAC material enables simultaneous enrichment and separation of diverse glycopeptides and phosphopeptides. Analytical Chemistry. 93 (24), 8568-8576 (2021).
- Jami-Alahmadi, Y., Pandey, V., Mayank, A. K., Wohlschlegel, J. A. A robust method for packing high resolution C18 RP-nano-HPLC columns. Journal of Visualized Experiments: JoVE. (171), e62380 (2021).
- Bern, M., Kil, Y. J., Becker, C. Byonic: advanced peptide and protein identification software. Current Protocols in Bioinformatics. , (2012).
- Tyanova, S., Temu, T., Cox, J. The MaxQuant computational platform for mass spectrometry-based shotgun proteomics. Nature Protocols. 11 (12), 2301-2319 (2016).
- Perez-Riverol, Y., et al. The PRIDE database and related tools and resources in 2019: improving support for quantification data. Nucleic Acids Research. 47, 442-450 (2019).
- Zhou, Y., et al. Metascape provides a biologist-oriented resource for the analysis of systems-level datasets. Nature Communications. 10 (1), 1523 (2019).
- Zacharias, L. G., et al. HILIC and ERLIC enrichment of glycopeptides derived from breast and brain cancer cells. Journal of Proteome Research. 15 (10), 3624-3634 (2016).
- Yang, W., et al. Comparison of enrichment methods for intact N- and O-linked glycopeptides using strong anion exchange and hydrophilic interaction liquid chromatography. Analytical Chemistry. 89 (21), 11193-11197 (2017).
- Toghi Eshghi, S., Shah, P., Yang, W., Li, X., Zhang, H. GPQuest: A spectral library matching algorithm for site-specific assignment of tandem mass spectra to intact N-glycopeptides. Analytical Chemistry. 87 (10), 5181-5188 (2015).
- Liu, M. -. Q., et al. pGlyco 2.0 enables precision N-glycoproteomics with comprehensive quality control and one-step mass spectrometry for intact glycopeptide identification. Nature Communications. 8 (1), 438 (2017).
- Lu, L., Riley, N. M., Shortreed, M. R., Bertozzi, C. R., Smith, L. M. O-Pair Search with MetaMorpheus for O-glycopeptide characterization. Nature Methods. 17 (11), 1133-1138 (2020).
- Caval, T., Heck, A. J. R., Reiding, K. R. Meta-heterogeneity: Evaluating and describing the diversity in glycosylation between sites on the same glycoprotein. Molecular & Cellular Proteomics. 20, 100010 (2021).
- Lee, J. S., Smith, E., Shilatifard, A. The language of histone crosstalk. Cell. 142 (5), 682-685 (2010).
- Leutert, M., Entwisle, S. W., Villén, J. Decoding post-translational modification crosstalk with proteomics. Molecular & Cellular Proteomics. 20, 100129 (2021).
- Hart, G. W., Slawson, C., Ramirez-Correa, G., Lagerlof, O. Cross talk between O-GlcNAcylation and phosphorylation: Roles in signaling, transcription, and chronic disease. Annual Review of Biochemistry. 80 (1), 825-858 (2011).

