चिक कपाल तंत्रिका शिखा सेल संस्कृतियों की तैयारी और रूपात्मक विश्लेषण
Summary
यह बहुमुखी प्रोटोकॉल चूजा भ्रूण से कपाल तंत्रिका सिलवटों के छांटना के माध्यम से प्रीमाइग्रेटरी तंत्रिका शिखा कोशिकाओं (एनसीसी) के अलगाव का वर्णन करता है। चढ़ाना और इनक्यूबेशन पर, प्रवासी एनसीसी तंत्रिका गुना एक्सप्लांट्स से उभरते हैं, जिससे सरलीकृत 2 डी वातावरण में सेल आकृति विज्ञान और प्रवास के आकलन की अनुमति मिलती है।
Abstract
कशेरुक विकास के दौरान, तंत्रिका शिखा कोशिकाएं (एनसीसी) बड़े पैमाने पर पलायन करती हैं और विभिन्न कोशिका प्रकारों में अंतर करती हैं जो क्रानियोफेशियल कंकाल और परिधीय तंत्रिका तंत्र जैसी संरचनाओं में योगदान करती हैं। जबकि 3 डी भ्रूण के संदर्भ में एनसीसी माइग्रेशन को समझना महत्वपूर्ण है, 2 डी संस्कृति में प्रवासी कोशिकाओं को अलग करना भ्रूण के अध्ययन के पूरक, दृश्य और कार्यात्मक लक्षण वर्णन की सुविधा प्रदान करता है। वर्तमान प्रोटोकॉल प्राथमिक एनसीसी संस्कृतियों को उत्पन्न करने के लिए चिक कपाल तंत्रिका सिलवटों को अलग करने के लिए एक विधि प्रदर्शित करता है। प्रवासी एनसीसी एक फाइब्रोनेक्टिन-लेपित सब्सट्रेट पर चढ़ाया गया तंत्रिका गुना एक्सप्लांट्स से निकलते हैं। इसके परिणामस्वरूप छितरे हुए, अनुयायी एनसीसी आबादी होती है जिसका आकलन धुंधला और मात्रात्मक रूपात्मक विश्लेषण द्वारा किया जा सकता है। यह सरलीकृत संस्कृति दृष्टिकोण अत्यधिक अनुकूलनीय है और इसे अन्य तकनीकों के साथ जोड़ा जा सकता है। उदाहरण के लिए, एनसीसी उत्प्रवास और प्रवासी व्यवहार का मूल्यांकन समय-चूक इमेजिंग द्वारा किया जा सकता है या जीन अभिव्यक्ति (जैसे, डीएनए, मॉर्फोलिनो, या सीआरआईएसपीआर इलेक्ट्रोपोरेशन) के अवरोधकों या प्रयोगात्मक जोड़तोड़ को शामिल करके कार्यात्मक रूप से पूछताछ की जा सकती है। इसकी बहुमुखी प्रतिभा के कारण, यह विधि कपाल एनसीसी विकास की जांच के लिए एक शक्तिशाली प्रणाली प्रदान करती है।
Introduction
तंत्रिका शिखा कोशिकाएं (एनसीसी) कशेरुक भ्रूण में एक क्षणिक कोशिका आबादी हैं। एनसीसी तंत्रिका प्लेट की सीमाओं पर निर्दिष्ट किए जाते हैं और पृष्ठीय तंत्रिका ट्यूबसे पलायन करने के लिए एक उपकला-से-मेसेनकाइमल संक्रमण (ईएमटी) से गुजरते हैं 1. ईएमटी के बाद, एनसीसी पूरे भ्रूण में बड़े पैमाने पर फैलते हैं, अंततः विभिन्न संरचनाओं में अंतर और योगदान देते हैं, जिसमें क्रैनियोफेशियल कंकाल, हृदय का बहिर्वाह पथ और परिधीय तंत्रिका तंत्र का बहुमतशामिल है। सेल ध्रुवीयता, साइटोस्केलेटन और आसंजन गुणों में परिवर्तन एक प्रीमाइग्रेटरी से प्रवासी सेल आबादी में इस बदलाव को रेखांकित करता है3. एनसीसी ईएमटी और माइग्रेशन का अध्ययन सेल गतिशीलता के मौलिक तंत्र में अंतर्दृष्टि प्रदान करता है और जन्म दोषों और कैंसर मेटास्टेसिस को रोकने और इलाज के प्रयासों को सूचित करता है।
जबकि विवो विश्लेषण भ्रूण के संदर्भ में एनसीसी विकास प्रक्रियाओं को समझने के लिए महत्वपूर्ण है, इन विट्रो विधियां दृश्य और भौतिक पहुंच प्रदान करती हैं जो अतिरिक्त प्रयोगात्मक मार्गों की सुविधा प्रदान करती हैं। एक सरलीकृत 2 डी वातावरण में, एनसीसी आकृति विज्ञान, साइटोस्केलेटल संरचनाएं और पलायन की दूरी का मूल्यांकन किया जा सकता है। इसके अलावा, गतिशील एनसीसी के प्रवासी व्यवहार पर आनुवंशिक या घुलनशील कारक गड़बड़ी के प्रभावों का विश्लेषण 4,5,6,7,8,9,10 किया जा सकता है। इसके अलावा, पृथक प्रीमिग्रेटरी या प्रवासी एनसीसी को प्रोटिओमिक, ट्रांसक्रिप्टोमिक और एपिजेनोमिक प्रोफाइलिंग 7,11 के माध्यम से एनसीसी के विकासात्मक विनियमन का अध्ययन करने के लिए उच्च-थ्रूपुट पद्धतियों के लिए एकत्र, पूल और उपयोग किया जा सकता है। जबकि विभिन्न विकासात्मक मॉडल जीवों 12,13,14 से कपाल एनसीसी तैयार करने के तरीके उपलब्ध हैं, यह लेख उन लोगों के लिए दृष्टिकोण के यांत्रिकी को प्रदर्शित करता है जो पहले चिकी भ्रूण से कपाल एनसीसी संस्कृति सीखते हैं।
वर्तमान प्रोटोकॉल लड़की कपाल एनसीसी संस्कृतियों (चित्रा 1) तैयार करने के लिए एक बहुमुखी तकनीक का वर्णन करता है। क्योंकि एनसीसी एक संस्कृति सब्सट्रेट पर प्रत्यारोपित तंत्रिका सिलवटों से आसानी से पलायन करते हैं, चूजा एनसीसी स्वाभाविक रूप से भ्रूण के ऊतकों से अलग हो जाते हैं, और प्राथमिक संस्कृतियां आसानी से उत्पन्न होती हैं। जैसा कि मिडब्रेन एनसीसी कपाल तंत्रिका सिलवटों (ट्रंक15 में लंबे, सेल-बाय-सेल डेलेमिनेशन के विपरीत) से बड़े पैमाने पर पलायन करते हैं, इन संस्कृतियों में मुख्य रूप से प्रवासी कपाल तंत्रिका शिखा कोशिकाएं होती हैं, प्रारंभिक तंत्रिका गुना छांटना प्रीमाइग्रेटरी एनसीसी के लिए एक संग्रह विधि प्रदान करता है। चिक कपाल तंत्रिका सिलवटों को विच्छेदन और संवर्धन के लिए एक बुनियादी विधि विस्तृत है, और इस विधि पर विभिन्न अनुप्रयोगों और विविधताओं के लिए सुझाव दिए जाते हैं।
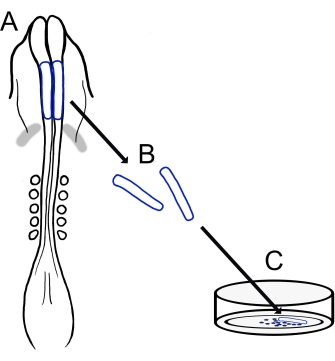
चित्रा 1: लड़की कपाल तंत्रिका गुना संस्कृति प्रोटोकॉल का योजनाबद्ध अवलोकन (ए, बी) कपाल तंत्रिका सिलवटों (नीले रंग में उल्लिखित) पांच सोमाइट्स (ए में पृष्ठीय दृश्य में दिखाया गया है) के साथ एक लड़की भ्रूण से उत्पादित कर रहे हैं। ग्रे बैंड, कार्डियक अर्धचंद्र। (सी) जब फाइब्रोनेक्टिन पर चढ़ाया जाता है, तो प्रवासी तंत्रिका शिखा कोशिकाएं तंत्रिका सिलवटों से निकलती हैं और सब्सट्रेट पर फैल जाती हैं। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
Protocol
Representative Results
Discussion
यहां वर्णित तकनीक चिक तंत्रिका सिलवटों को अलग करने और प्रवासी कपाल एनसीसी की संस्कृतियों को बनाने के लिए उन्हें चढ़ाने की एक अनुकूलनीय विधि प्रदान करती है। ये संस्कृतियां चूजा एनसीसी माइग्रेशन और आक…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
हम कोरिन ए फेयरचाइल्ड और केटी एल वर्मिलियन को धन्यवाद देते हैं, जिन्होंने चिक कपाल तंत्रिका गुना संस्कृति प्रोटोकॉल के हमारे संस्करण को विकसित करने में भाग लिया।
Materials
| AxioObserver equipped with an LSM710 confocal scan head controlled by ZEN 3.0 SR software | Zeiss | Used alpha Plan-Apochromat 100x/1.46 Oil DIC M27 objective | |
| CaCl2 | Sigma-Aldrich | C3306 | |
| Chamber dishes (glass bottom, single or divided) | MatTek; Cell Vis | P35G-1.5-14-C (MatTek) X000NOJQGX (Cellvis) X000NOK1OJ (Cellvis) |
Single chamber 35 mm or 4 chamber 35 mm |
| Cover glass | Carolina Biological Supply Company | 633029, 633031, 633033, 633035, 633037 | circles, 0.13–0.17 mm thickness, available in 12-25 mm diameter |
| DMEM/F12 | ThermoFisher Scientific | 11320033 | Alternative for L15 media |
| Egg incubator | Sportsman | 1502 | |
| FBS | Life Technologies | 10437-028 | |
| Fibronectin | Fisher Scientific | CB-40008A | |
| Filter paper | Whatman | grade 3MM chromatography | |
| Forceps (blunt) | Fisher Scientific; Thomas Scientific | 08-890 (Fisher);1141W97 (Thomas) | |
| Forceps (fine) | Fine Science Tools | 11252-20 | Dumont #5 |
| Image J | https://fiji.sc/ | Free image analysis software | |
| KCl | Sigma-Aldrich | P3911 | |
| KH2PO4 | Sigma-Aldrich | P0662 | |
| L15 media | Invitrogen | 11415064 | |
| L-glutamine | Invitrogen | 25030 | |
| Mounting Media (Vectashield or ProLong Gold) | Vector Laboratories; Thermofisher Scientific | H-1700 (Vectashield); P36930 (ProLong Gold) | |
| Na2HPO4 | Sigma-Aldrich | S9638 | |
| NaCl | Sigma-Aldrich | S9888 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Penicillin/streptomycin | Life Technologies | 15140-148 | 10,000 Units/mL Penicillin; 10,000 mg/mL Streptomycin |
| Petri Dishes | VWR (or similar) | 60 mm, 100 mm | |
| Phalloidin | Sigma-Aldrich | P1951 | multiple flurophores available |
| Pin holder | Fine Science Tools | 26016-12 | For tungsten needle (alternative for spring scissors) |
| Scissors (dissection) | Fine Science Tools | 14061-10 | |
| Spring Scissors | Fine Science Tools | 15000-08 | 2.5 mm cutting edge (alternative for tungsten needle) |
| Sylgard | Krayden | Sylgard 184 | |
| Syringe Filters | Sigma-Aldrich | SLGVM33RS | Millex-GV Syringe Filter Unit, 0.22 µm, PVDF, 33 mm, gamma sterilized |
| Tissue culture dishes | Sarstedt | 83-3900 | 35 mm culture dishes for bulk neural fold cultures |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Tungsten wire | Variety of sources | 0.01" diameter for tungsten needle (alternative for spring scissors) |
Riferimenti
- Pla, P., Monsoro-Burq, A. H. The neural border: Induction, specification and maturation of the territory that generates neural crest cells. Biologia dello sviluppo. 444, 36-46 (2018).
- Tang, W., Bronner, M. E. Neural crest lineage analysis: From past to future trajectory. Development. 147 (20), (2021).
- Piacentino, M. L., Li, Y., Bronner, M. E. Epithelial-to-mesenchymal transition and different migration strategies as viewed from the neural crest. Current Opinion in Cell Biology. 66, 43-50 (2020).
- McLennan, R., et al. Neural crest cells bulldoze through the microenvironment using Aquaporin 1 to stabilize filopodia. Development. 147 (1), 185231 (2020).
- Carmona-Fontaine, C., et al. Complement fragment C3a controls mutual cell attraction during collective cell migration. Developmental Cell. 21 (6), 1026-1037 (2011).
- Giovannone, D., et al. Slits affect the timely migration of neural crest cells via robo receptor. Developmental Dynamics. 241 (8), 1274-1288 (2012).
- Vermillion, K. L., Lidberg, K. A., Gammill, L. S. Cytoplasmic protein methylation is essential for neural crest migration. Journal of Cell Biology. 204 (1), 95-109 (2014).
- Yang, X., Li, J., Zeng, W., Li, C., Mao, B. Elongator Protein 3 (Elp3) stabilizes Snail1 and regulates neural crest migration in Xenopus. Scientific Reports. 6 (1), 1-9 (2016).
- Gonzalez Malagon, S. G., et al. Glycogen synthase kinase 3 controls migration of the neural crest lineage in mouse and Xenopus. Nature Communications. 9 (1), 1-15 (2018).
- Bhattacharya, D., Azambuja, A. P., Simoes-Costa, M. Metabolic reprogramming promotes neural crest migration via yap/tead signaling. Developmental Cell. 53 (2), 199-211 (2020).
- Jacques-Fricke, B. T., et al. Profiling NSD3-dependent neural crest gene expression reveals known and novel candidate regulatory factors. Biologia dello sviluppo. 475, 118-130 (2021).
- Bronner-Fraser, M., García-Castro, M. Chapter 4 manipulations of neural crest cells or their migratory pathways. Methods in Cell Biology. 87, 75-96 (2008).
- Milet, C., Monsoro-Burq, A. H. Dissection of xenopus laevis neural crest for in vitro explant culture or in vivo transplantation. Journal of Visualized Experiments. (85), e51118 (2014).
- Malagon, S. G. G., et al. Dissection, culture and analysis of primary cranial neural crest cells from mouse for the study of neural crest cell delamination and migration. Journal of Visualized Experiments. (152), e60051 (2019).
- Theveneau, E., Mayor, R. Neural crest delamination and migration: From epithelium-to-mesenchyme transition to collective cell migration. Biologia dello sviluppo. 366 (1), 34-54 (2012).
- Conrad, G. W., Bee, J. A., Roche, S. M., Teillet, M. A. Fabrication of microscalpels by electrolysis of tungsten wire in a meniscus. Journal of Neuroscience Methods. 50 (1), 123-127 (1993).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88 (1), 49-92 (1951).
- Gammill, L. S., Jacques-Fricke, B., Roffers-Agarwal, J. Embryological and genetic manipulation of chick development. Methods in Molecular Biology. 1920, 75-97 (2019).
- Vandekerckhove, J., Deboben, A., Nassal, M., Wieland, T. The phalloidin binding site of F-actin. The EMBO Journal. 4 (11), 2815-2818 (1985).
- Bronner-Fraser, M. Analysis of the early stages of trunk neural crest migration in avian embryos using monoclonal antibody HNK-1. Biologia dello sviluppo. 115 (1), 44-55 (1986).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Soille, P., Vincent, L. Determining watersheds in digital pictures via flooding simulations. Visual Communications and Image Processing ’90: Fifth in a Series. (1360), 240-250 (1990).
- Haupt, A., Minc, N. How cells sense their own shape – mechanisms to probe cell geometry and their implications in cellular organization and function. Journal of Cell Science. 131 (6), (2018).
- Ezin, M., Fraser, S. Chapter 11 time-lapse imaging of the early avian embryo. Methods in Cell Biology. 87, 211-236 (2008).
- Kulesa, P. M., Bailey, C. M., Cooper, C., Fraser, S. E. In ovo live imaging of avian embryos. Cold Spring Harbor Protocols. 5 (6), (2010).
- McKinney, M. C., Kulesa, P. M. Live imaging of the neural crest cell epithelial-to-mesenchymal transition in the chick embryo. Methods in Molecular Biology. 2179, 107-114 (2021).
- Gustafson, C. M., Roffers-Agarwal, J., Gammill, L. S. Chick cranial neural crest cells release extracellular vesicles that are critical for their migration. Journal of Cell Science. , (2022).
- Williams, R., Sauka-Spengler, T. Ex ovo electroporation of early chicken embryos. STAR Protocols. 2 (2), 100424 (2021).
- Moulton, J. D. Using morpholinos to control gene expression. Current Protocols in Nucleic Acid Chemistry. 68 (1), 4-30 (2017).
- Gandhi, S., et al. A single-plasmid approach for genome editing coupled with long-term lineage analysis in chick embryos. Development. 148 (7), (2021).
- Williams, R. M., et al. Reconstruction of the Global Neural Crest Gene Regulatory Network In Vivo. Developmental Cell. 51 (2), 255-267 (2019).

