Forberedelse og morfologisk analyse av kyllingkraniale nevrale kamcellekulturer
Summary
Denne allsidige protokollen beskriver isoleringen av premigratoriske nevrale kamceller (NCC) gjennom eksisjon av kraniale nevrale folder fra kyllingembryoer. Ved plating og inkubasjon kommer migrerende NCCer fra nevrale foldeksplanter, noe som muliggjør vurdering av cellemorfologi og migrasjon i et forenklet 2D-miljø.
Abstract
Under vertebratutvikling migrerer nevrale kamceller (NCC) mye og differensierer til forskjellige celletyper som bidrar til strukturer som kraniofacialskjelettet og det perifere nervesystemet. Selv om det er avgjørende å forstå NCC-migrasjon i sammenheng med et 3D-embryo, letter isolering av migrerende celler i 2D-kultur visualisering og funksjonell karakterisering, som utfyller embryonale studier. Denne protokollen demonstrerer en metode for å isolere kyllingkraniale nevrale folder for å generere primære NCC-kulturer. Migrerende NCC kommer fra nevrale foldeplanter belagt på et fibronektinbelagt substrat. Dette resulterer i spredte, tilhørende NCC-populasjoner som kan vurderes ved farging og kvantitative morfologiske analyser. Denne forenklede kulturtilnærmingen er svært tilpasningsdyktig og kan kombineres med andre teknikker. For eksempel kan NCC-emigrasjon og migrasjonsadferd evalueres ved time-lapse-avbildning eller funksjonelt spørres ved å inkludere inhibitorer eller eksperimentelle manipulasjoner av genuttrykk (f.eks. DNA, morfolino eller CRISPR-elektroporering). På grunn av sin allsidighet gir denne metoden et kraftig system for å undersøke kranial NCC-utvikling.
Introduction
Nevrale kamceller (NCC) er en forbigående cellepopulasjon i virveldyrembryoer. NCC er spesifisert ved grensen til nevrale platen og gjennomgår en epithelial-til-mesenkymal overgang (EMT) for å migrere fra dorsal nevralerøret 1. Etter EMT sprer NCC seg mye gjennom hele embryoet, og differensierer og bidrar til ulike strukturer, inkludert kraniofacialskjelettet, utstrømningskanalen i hjertet og flertallet av det perifere nervesystemet2. Endringer i cellepolaritet, cytoskjelettet og adhesjonsegenskaper ligger under dette skiftet fra en premigratorisk til en migrerende cellepopulasjon3. Studier av NCC EMT og migrasjon gir innsikt i grunnleggende mekanismer for cellemotilitet og informerer innsats for å forebygge og behandle fødselsskader og kreftmetastase.
Mens in vivo-analyse er avgjørende for å forstå NCCs utviklingsprosesser i en embryonal kontekst, tilbyr in vitro-metoder visuell og fysisk tilgjengelighet som letter ytterligere eksperimentelle veier. I et forenklet 2D-miljø kan NCC-morfologi, cytoskeletale strukturer og avstand migreres evalueres. Videre kan effekten av genetisk eller løselig faktorforstyrrelse på migrerende oppførsel av motile NCC analyseres 4,5,6,7,8,9,10. I tillegg kan isolerte premigratoriske eller migrerende NCC-er samles inn, samles sammen og brukes til metoder med høy gjennomstrømning for å studere utviklingsreguleringen av NCC gjennom proteomisk, transkriptomisk og epigenomisk profilering 7,11. Mens metoder er tilgjengelige for å forberede kraniale NCCer fra ulike utviklingsmodellorganismer12,13,14, demonstrerer denne artikkelen mekanikken i tilnærmingen for de som først lærer å dyrke kranial NCC fra kyllingembryoer.
Den nåværende protokollen beskriver en allsidig teknikk for fremstilling av NCC-kulturer hos kyllinger (figur 1). Fordi NCC migrerer lett fra eksplanterte nevrale folder på et kultursubstrat, segregerer kylling-NCC-er naturlig fra embryonalt vev, og primære kulturer genereres lett. Ettersom midthjerne-NCC-er migrerer en masse fra kraniale nevrale folder (i motsetning til den langvarige, celle-for-celle-delamineringen i stammen15), består disse kulturene hovedsakelig av migrerende kraniale nevrale kamceller, med innledende nevralfoldeksisjon som gir en innsamlingsmetode for premigratoriske NCC-er. En grunnleggende metode for dissekering og dyrking av kyllingkraniale nevrale folder er detaljert, og forslag til forskjellige applikasjoner og variasjoner på denne metoden tilbys.
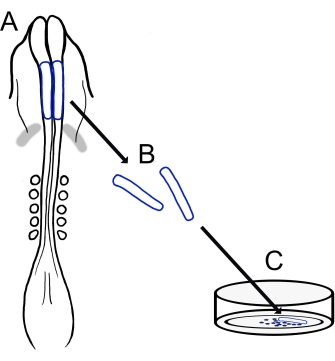
Figur 1: Skjematisk oversikt over kyllingkranial nevral foldekulturprotokoll. (A,B) Kraniale nevrale folder (skissert i blått) blir skåret ut fra et kyllingembryo med fem somitter (vist i dorsalvisning i A). Grå bånd, hjerte halvmåne. (C) Når de er belagt på fibronektin, kommer migrerende nevrale kamceller ut av nevrale folder og sprer seg på substratet. Klikk her for å se en større versjon av dette tallet.
Protocol
Representative Results
Discussion
Teknikken beskrevet her gir en tilpasningsdyktig metode for å isolere kyllingnevrale folder og plating dem for å skape kulturer av migrerende kraniale NCCer. Disse kulturene gir forenklede 2D-forhold for enkel analyse av kylling NCC-migrasjon og morfologi som kan supplere mer teknisk utfordrende i ovo-bildebehandlingsmetoder24,25,26. Selv om denne in vitro-metoden er relativt enkel, er konsistente resultater …
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Vi takker Corinne A. Fairchild og Katie L. Vermillion, som deltok i utviklingen av vår versjon av chick cranial neural fold culture protocol.
Materials
| AxioObserver equipped with an LSM710 confocal scan head controlled by ZEN 3.0 SR software | Zeiss | Used alpha Plan-Apochromat 100x/1.46 Oil DIC M27 objective | |
| CaCl2 | Sigma-Aldrich | C3306 | |
| Chamber dishes (glass bottom, single or divided) | MatTek; Cell Vis | P35G-1.5-14-C (MatTek) X000NOJQGX (Cellvis) X000NOK1OJ (Cellvis) |
Single chamber 35 mm or 4 chamber 35 mm |
| Cover glass | Carolina Biological Supply Company | 633029, 633031, 633033, 633035, 633037 | circles, 0.13–0.17 mm thickness, available in 12-25 mm diameter |
| DMEM/F12 | ThermoFisher Scientific | 11320033 | Alternative for L15 media |
| Egg incubator | Sportsman | 1502 | |
| FBS | Life Technologies | 10437-028 | |
| Fibronectin | Fisher Scientific | CB-40008A | |
| Filter paper | Whatman | grade 3MM chromatography | |
| Forceps (blunt) | Fisher Scientific; Thomas Scientific | 08-890 (Fisher);1141W97 (Thomas) | |
| Forceps (fine) | Fine Science Tools | 11252-20 | Dumont #5 |
| Image J | https://fiji.sc/ | Free image analysis software | |
| KCl | Sigma-Aldrich | P3911 | |
| KH2PO4 | Sigma-Aldrich | P0662 | |
| L15 media | Invitrogen | 11415064 | |
| L-glutamine | Invitrogen | 25030 | |
| Mounting Media (Vectashield or ProLong Gold) | Vector Laboratories; Thermofisher Scientific | H-1700 (Vectashield); P36930 (ProLong Gold) | |
| Na2HPO4 | Sigma-Aldrich | S9638 | |
| NaCl | Sigma-Aldrich | S9888 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Penicillin/streptomycin | Life Technologies | 15140-148 | 10,000 Units/mL Penicillin; 10,000 mg/mL Streptomycin |
| Petri Dishes | VWR (or similar) | 60 mm, 100 mm | |
| Phalloidin | Sigma-Aldrich | P1951 | multiple flurophores available |
| Pin holder | Fine Science Tools | 26016-12 | For tungsten needle (alternative for spring scissors) |
| Scissors (dissection) | Fine Science Tools | 14061-10 | |
| Spring Scissors | Fine Science Tools | 15000-08 | 2.5 mm cutting edge (alternative for tungsten needle) |
| Sylgard | Krayden | Sylgard 184 | |
| Syringe Filters | Sigma-Aldrich | SLGVM33RS | Millex-GV Syringe Filter Unit, 0.22 µm, PVDF, 33 mm, gamma sterilized |
| Tissue culture dishes | Sarstedt | 83-3900 | 35 mm culture dishes for bulk neural fold cultures |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Tungsten wire | Variety of sources | 0.01" diameter for tungsten needle (alternative for spring scissors) |
Riferimenti
- Pla, P., Monsoro-Burq, A. H. The neural border: Induction, specification and maturation of the territory that generates neural crest cells. Biologia dello sviluppo. 444, 36-46 (2018).
- Tang, W., Bronner, M. E. Neural crest lineage analysis: From past to future trajectory. Development. 147 (20), (2021).
- Piacentino, M. L., Li, Y., Bronner, M. E. Epithelial-to-mesenchymal transition and different migration strategies as viewed from the neural crest. Current Opinion in Cell Biology. 66, 43-50 (2020).
- McLennan, R., et al. Neural crest cells bulldoze through the microenvironment using Aquaporin 1 to stabilize filopodia. Development. 147 (1), 185231 (2020).
- Carmona-Fontaine, C., et al. Complement fragment C3a controls mutual cell attraction during collective cell migration. Developmental Cell. 21 (6), 1026-1037 (2011).
- Giovannone, D., et al. Slits affect the timely migration of neural crest cells via robo receptor. Developmental Dynamics. 241 (8), 1274-1288 (2012).
- Vermillion, K. L., Lidberg, K. A., Gammill, L. S. Cytoplasmic protein methylation is essential for neural crest migration. Journal of Cell Biology. 204 (1), 95-109 (2014).
- Yang, X., Li, J., Zeng, W., Li, C., Mao, B. Elongator Protein 3 (Elp3) stabilizes Snail1 and regulates neural crest migration in Xenopus. Scientific Reports. 6 (1), 1-9 (2016).
- Gonzalez Malagon, S. G., et al. Glycogen synthase kinase 3 controls migration of the neural crest lineage in mouse and Xenopus. Nature Communications. 9 (1), 1-15 (2018).
- Bhattacharya, D., Azambuja, A. P., Simoes-Costa, M. Metabolic reprogramming promotes neural crest migration via yap/tead signaling. Developmental Cell. 53 (2), 199-211 (2020).
- Jacques-Fricke, B. T., et al. Profiling NSD3-dependent neural crest gene expression reveals known and novel candidate regulatory factors. Biologia dello sviluppo. 475, 118-130 (2021).
- Bronner-Fraser, M., García-Castro, M. Chapter 4 manipulations of neural crest cells or their migratory pathways. Methods in Cell Biology. 87, 75-96 (2008).
- Milet, C., Monsoro-Burq, A. H. Dissection of xenopus laevis neural crest for in vitro explant culture or in vivo transplantation. Journal of Visualized Experiments. (85), e51118 (2014).
- Malagon, S. G. G., et al. Dissection, culture and analysis of primary cranial neural crest cells from mouse for the study of neural crest cell delamination and migration. Journal of Visualized Experiments. (152), e60051 (2019).
- Theveneau, E., Mayor, R. Neural crest delamination and migration: From epithelium-to-mesenchyme transition to collective cell migration. Biologia dello sviluppo. 366 (1), 34-54 (2012).
- Conrad, G. W., Bee, J. A., Roche, S. M., Teillet, M. A. Fabrication of microscalpels by electrolysis of tungsten wire in a meniscus. Journal of Neuroscience Methods. 50 (1), 123-127 (1993).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88 (1), 49-92 (1951).
- Gammill, L. S., Jacques-Fricke, B., Roffers-Agarwal, J. Embryological and genetic manipulation of chick development. Methods in Molecular Biology. 1920, 75-97 (2019).
- Vandekerckhove, J., Deboben, A., Nassal, M., Wieland, T. The phalloidin binding site of F-actin. The EMBO Journal. 4 (11), 2815-2818 (1985).
- Bronner-Fraser, M. Analysis of the early stages of trunk neural crest migration in avian embryos using monoclonal antibody HNK-1. Biologia dello sviluppo. 115 (1), 44-55 (1986).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Soille, P., Vincent, L. Determining watersheds in digital pictures via flooding simulations. Visual Communications and Image Processing ’90: Fifth in a Series. (1360), 240-250 (1990).
- Haupt, A., Minc, N. How cells sense their own shape – mechanisms to probe cell geometry and their implications in cellular organization and function. Journal of Cell Science. 131 (6), (2018).
- Ezin, M., Fraser, S. Chapter 11 time-lapse imaging of the early avian embryo. Methods in Cell Biology. 87, 211-236 (2008).
- Kulesa, P. M., Bailey, C. M., Cooper, C., Fraser, S. E. In ovo live imaging of avian embryos. Cold Spring Harbor Protocols. 5 (6), (2010).
- McKinney, M. C., Kulesa, P. M. Live imaging of the neural crest cell epithelial-to-mesenchymal transition in the chick embryo. Methods in Molecular Biology. 2179, 107-114 (2021).
- Gustafson, C. M., Roffers-Agarwal, J., Gammill, L. S. Chick cranial neural crest cells release extracellular vesicles that are critical for their migration. Journal of Cell Science. , (2022).
- Williams, R., Sauka-Spengler, T. Ex ovo electroporation of early chicken embryos. STAR Protocols. 2 (2), 100424 (2021).
- Moulton, J. D. Using morpholinos to control gene expression. Current Protocols in Nucleic Acid Chemistry. 68 (1), 4-30 (2017).
- Gandhi, S., et al. A single-plasmid approach for genome editing coupled with long-term lineage analysis in chick embryos. Development. 148 (7), (2021).
- Williams, R. M., et al. Reconstruction of the Global Neural Crest Gene Regulatory Network In Vivo. Developmental Cell. 51 (2), 255-267 (2019).

