リンタンパク質ホスファターゼとそのインターアクターを同定するための質量分析ベースのアプローチ
Summary
ここでは、細胞および組織からの内因性リンタンパク質ホスファターゼおよびそれらの相互作用タンパク質の濃縮、ならびに質量分析ベースのプロテオミクスによるそれらの同定および定量のためのプロトコルを提示する。
Abstract
ほとんどの細胞プロセスは、動的タンパク質リン酸化によって調節される。タンパク質の4分の3以上がリン酸化されており、リンプロテインホスファターゼ(PPP)はすべての細胞セリン/スレオニン脱リン酸化の90%以上をコーディネートしています。タンパク質リン酸化の調節解除は、癌および神経変性を含む様々な疾患の病態生理学に関与している。それらの広範な活性にもかかわらず、PPPsおよびPPPによって制御される分子機構は、ほとんど特徴付けられていない。ここでは、ホスファターゼ阻害剤ビーズおよび質量分析(PIB-MS)と呼ばれるプロテオミクスアプローチが、任意の細胞株または組織を使用してわずか12時間でPPP、それらの翻訳後修飾、およびそれらの相互作用因子を同定および定量するために記載されている。PIB-MSは、セファロースビーズに固定化された非選択的PPP阻害剤であるミクロシスチン-LR(MCLR)を利用して、内因性PPPおよびその関連タンパク質(PPPomeと呼ばれる)を捕捉および濃縮する。この方法は、PPPのタグ付きバージョンの外因性発現または特異的抗体の使用を必要としない。PIB-MSは、進化的に保存されたPPPを研究し、脱リン酸化シグナル伝達に関する現在の理解を広げる革新的な方法を提供します。
Introduction
タンパク質リン酸化は、DNA損傷に対する応答、成長因子シグナル伝達、および有糸分裂1,2,3の通過を含むがこれらに限定されない、ほとんどの細胞プロセスを制御する。哺乳動物細胞では、タンパク質の大部分は、ある時点で1つ以上のセリン、スレオニン、またはチロシン残基でリン酸化され、ホスホセリンおよびホスホスレオニンは、すべてのリン酸化部位の約98%を占める2,3。キナーゼは細胞シグナル伝達において広く研究されてきたが、動的細胞プロセスの調節におけるPPPの役割はまだ現れている。
リン酸化ダイナミクスは、キナーゼとホスファターゼの間の動的相互作用によって制御される。哺乳類細胞には、セリン/スレオニンリン酸化を触媒する400以上のプロテインキナーゼが存在する。これらの部位の90%以上は、PP1、PP2A、PP2B、PP4-7、PPT、およびPPZ 2,3からなる酵素の小さなファミリーであるリンタンパク質ホスファターゼ(PPP)によって脱リン酸化されている。PP1およびPP2Aは、細胞内のホスホセリンおよびホスホスレオニン脱リン酸化の大部分を担う2、3、4。キナーゼとホスファターゼの数の顕著な違いおよびインビトロでのPPP触媒サブユニットの特異性の欠如は、キナーゼがリン酸化の主な決定因子であるという信念につながった2,3。しかしながら、複数の研究は、ホスファターゼが多量体ホロ酵素5、6、7、8、9の形成を通じて基質特異性を確立することを示している。例えば、PP1は、触媒サブユニットおよび、所与の時点で、150を超える調節サブユニットのうちの1つからなるヘテロ二量体である6、7、8である。逆に、PP2Aは、足場(A)、調節(B)、および触媒(C)サブユニット2,3,9から形成されるヘテロ三量体である。PP2A調節サブユニット(B55、B56、PR72、および線条体)の4つの異なるファミリーがあり、それぞれに複数の遺伝子、スプライスバリアント、および局在化パターン2、3、9がある。PPPの多量体性は、キナーゼおよびPPP触媒サブユニットの数のギャップを埋める。しかし、PPPシグナリングを研究するための分析上の課題が生じます。PPPシグナル伝達を網羅的に解析するためには、細胞または組織内の様々なホロ酵素を調べることが重要です。キナーゼ阻害剤ビーズ(マルチプレックス阻害剤ビーズまたはキノビーズと呼ばれる)の使用を通じてヒトキノメの研究において大きな進歩がなされており、キナーゼ阻害剤がビーズに固定化され、質量分析法が濃縮キナーゼおよびそれらのインターアクターを同定するために使用される化学的プロテオミクス戦略10,11,12,13。
我々は、PPP生物学を研究するために同様のアプローチを確立している。この技術は、ホスファターゼ阻害剤ビーズ(PIB)と呼ばれるミクロシスチン−LR(MCLR)と呼ばれる固定化された非選択的PPP阻害剤を有するビーズを用いたPPP触媒サブユニットの親和性捕捉を含む14,15。タンパク質活性または局在化を変化させる可能性のある外因性PPPサブユニットの内因性タグ付けまたは発現を必要とする他の方法とは異なり、PIB-MSは、内因性PPP触媒サブユニット、それらに関連する調節および足場サブユニット、および所定の時点または特定の治療条件下での細胞および組織からの相互作用タンパク質(PPPomeと呼ばれる)の濃縮を可能にする。MCLRは、PP1、PP2A、PP4-6、PPT、およびPPZをナノモル濃度で阻害し、PIBをPPPome16の濃縮に非常に効果的にする。この方法は、細胞から臨床サンプルまでの任意の出発物質に使用するためにスケーリングすることができる。ここでは、内因性PPPomeとその修飾状態を効率的に捕捉、同定、定量化するためのPIBおよび質量分析(PIB-MS)の使用について詳しく説明します。
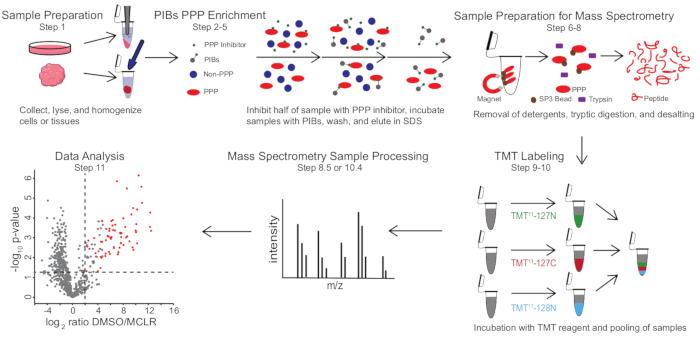
図1:PIB-MSプロトコルの視覚的な概要 PIB-MS実験では、細胞から腫瘍まで、さまざまな形態でサンプルを得ることができます。サンプルは、PPP 濃縮の前に収集、溶解、および均質化されます。PPPを富化するために、溶解液をMCLRなどのPPP阻害剤の有無にかかわらずPIBと共にインキュベートする。その後、PIBを洗浄し、PPPを変性条件下で溶出します。サンプルは、SP3タンパク質濃縮、トリプシン消化、および脱塩による洗剤の除去によって質量分析分析用に調製される。次いで、サンプルを、質量分析分析の前に任意選択でTMT標識することができる。 この図の拡大版を表示するには、ここをクリックしてください。
PIB-MSには、細胞または組織の溶解および清澄化、溶解液とPIBとのインキュベーション、溶出、およびウェスタンブロッティングまたは質量分析ベースのアプローチによる溶出液の分析が含まれます(図1)。遊離MCLRの添加は、特異的PIB結合剤を非特異的相互作用体から区別するための対照として使用することができる。ほとんどのアプリケーションでは、溶出液中のタンパク質を直接同定するためにラベルフリーのアプローチを使用できます。定量化または低存在種の同定においてより高い精度が必要な場合は、タンデム質量タグ(TMT)標識によるさらなる処理を使用して、カバレッジを増加させ、入力を減少させることができる。
Protocol
Representative Results
Discussion
PIB-MSは、単一の分析でさまざまなサンプルソースからPPPomeを定量的にプロファイリングするために使用される化学プロテオミクスアプローチです。キナーゼ阻害剤ビーズを使用して、キノメとそれが癌および他の疾患状態においてどのように変化するかを研究するために多くの研究が行われてきた10、11、12、13。<s…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
A.N.K. は、NIH R33 CA225458 および R35 GM119455 からのサポートを認めています。ケッテンバッハ研究所とガーバー研究所の有益な議論に感謝します。
Materials
| Acetonitrile (ACN) | Honeywell | AH015-4 | CAUTION: ACN is flammable and toxic; wear gloves, and work in a chemical fume hood. |
| Anhydrous Acetonitrile | Sigma-Aldrich | 271004-100ML | CAUTION: ACN is flammable and toxic; wear gloves, and work in a chemical fume hood. |
| Benchtop centrifuge | Eppendorf | model no. 5424 | |
| Beta-glycerophosphoric acid, disodium salt pentahydrate | Acros Organics | 410991000 | |
| Centrifuge | Eppendorf | model no. 5810 R 15 amp version | |
| Distilled water | |||
| DMSO | Fisher Scientific | BP231-100 | |
| Dounce tissue grinder | Fisherbrand Pellet Pestles | 12-141-363 | |
| Empore solid phase extraction disk, C18 | CDS Analytical | 76333-132 | |
| Eppendorf tubes, 1.5 mL | Eppendorf | 22363204 | CRITICAL: Other tubes may leach polymer into sample, contaminating the analysis. |
| Eppendorf tubes, 2 mL | Eppendorf | 22363352 | CRITICAL: Other tubes may leach polymer into sample, contaminating the analysis. |
| Extraction plate manifold | Waters | WAT097944 | |
| Falcon tubes, 50 mL | VWR | 21008 | |
| Generic blunt end needle and plunger | |||
| Generic magnetic separation rack | |||
| HEPES | Sigma-Aldrich | H3375 | |
| Hydrogen chloride (HCl) | VWR Chemicals BDH | BDH3028 | CAUTION: HCl is corrosive; wear gloves and work in a chemical fume hood. |
| Hydroxylamine solution 50% (wt/vol) | Sigma-Aldrich | 467804 | |
| Incubator, 65 °C | VWR | model no. 1380FM | |
| Koptec Pure Ethanol, 200 Proof | Decon Labs | V1001 | |
| Methanol for HPLC (MeOH) | Sigma-Aldrich | 34860-4L-R | CAUTION: MeOH is flammable and toxic; wear gloves, and work in a chemical fume hood. |
| Microcystin LR (MCLR) | Cayman Chemical | 10007188 | CAUTION: MCLR is toxic; wear gloves when handling and avoid skin contact. |
| PBS, 1× without calcium and magnesium, pH 7.4 ± 0.1 | Corning | 21-040-CV | |
| pH test strips, such as MilliporeSigma MColorpHast pH test strips and indicator papers | Fisher Scientific | M1095310001 | |
| PIBs | For protocol for the generation of PIBs, see Moorhead et al., 2007. | ||
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23225 | |
| Pipette tips, 10 μL | Eppendorf | 22491504 | CRITICAL: Other tips may leach polymer into samples, contaminating the analysis. |
| Pipette tips, 1000 μL | Eppendorf | 22491555 | CRITICAL: Other tips may leach polymer into samples, contaminating the analysis. |
| Pipette tips, 200 μL | Eppendorf | 22491539 | CRITICAL: Other tips may leach polymer into samples, contaminating the analysis. |
| plastic syringe, 10 mL | BD | 309604 | |
| Protease inhibitor cocktail III | Research Products International | P50700-1 | |
| Q Exactive Plus Hybrid Quadrupole-Orbitrap Mass Spectrometer, Oribtrap Fusion, Orbitrap Fusion Lumos, or Orbitrap Eclipse Tribrid Mass Spectrometer | Thermo Scientific | ||
| Refrigerated benchtop centrifuge | Eppendorf | model no. 5424 R | |
| Rotator (Labquake Shaker Rotisserie) | Thermo Scientific | 13-687-12Q | 8 rpm rotation |
| Sample collection plate, 96- well, 1 mL | Waters | WAT058957 | |
| SDS | Fisher Scientific | BP1311-1 | |
| Sequencing grade modified trypsin | Promega | V511C | |
| Sodium azide | EMD Chemicals | SX0299-1 | CAUTION: Sodium azide is explosive and toxic; wear gloves, work in a chemical fume hood and avoid contact with metals. |
| Sodium chloride (NaCl) | Fisher Chemical | S27110 | |
| Sonicator (Branson digital sonifier) | model no. SFX 250 | ||
| SPE C18 desalting plate | Waters | 186001828BA | |
| SpeedBeads magnetic carboxylate modified particles (SP3 beads) | Cytiva | 6.51521E+13 | |
| Thermomixer | Eppendorf | model no. 5350 | |
| TMT10plex Isobaric Label Reagent Set plus TMT11-131C Label Reagent, 3 × 0.8 mg per tag | ThermoFisher | A37725 | |
| Trifluoroacetic acid (TFA) | Honeywell | T6508-25ML | CAUTION: TFA is corrosive and will irritate skin on contact. Wear gloves and eye protection, and work in a chemical fume hood. |
| Tris Base | Research Products International | T60040 | |
| Triton X-100 | Sigma-Aldrich | T9284 | |
| Vacuum centrifuge and vapor trap | Thermo Scientific | model nos. SpeedVac SPD120 and RVT5105 | |
| Vortexer (Vortex-Genie 2) | Scientific Industries | ||
| Water LC-MS | Honeywell | LC365-4 |
Riferimenti
- Nilsson, J. Protein phosphatases in the regulation of mitosis. Journal of Cell Biology. 218 (2), 395-409 (2019).
- Brautigan, D. L. Protein Ser/Thr phosphatases–the ugly ducklings of cell signalling. The FEBS Journal. 280 (2), 324-345 (2013).
- Brautigan, D. L., Shenolikar, S. Protein serine/threonine phosphatases: keys to unlocking regulators and substrates. Annual Review of Biochemistry. 87, 921-964 (2018).
- Janssens, V., Goris, J. Protein phosphatase 2A: A highly regulated family of serine/threonine phosphatases implicated in cell growth and signalling. Biochemical Journal. 353, 417-439 (2001).
- Virshup, D. M., Shenolikar, S. From promiscuity to precision: protein phosphatases get a makeover. Molecular Cell. 33 (5), 537-545 (2009).
- Bollen, M., Peti, W., Ragusa, M. J., Beullens, M. The extended PP1 toolkit: designed to create specificity. Trends in Biochemical Sciences. 35 (8), 450-458 (2010).
- Qian, J., Winkler, C., Bollen, M. 4D-networking by mitotic phosphatases. Current Opinion in Cell Biology. 25 (6), 697-703 (2013).
- Heroes, E., et al. The PP1 binding code: a molecular-lego strategy that governs specificity. The FEBS Journal. 280 (2), 584-595 (2013).
- Eichhorn, P. J., Creyghton, M. P., Bernards, R. Protein phosphatase 2A regulatory subunits and cancer. Biochimica et Biophysica Acta. 1795 (1), 1-15 (2009).
- Bantscheff, M., et al. Quantitative chemical proteomics reveals mechanisms of action of clinical ABL kinase inhibitors. Nature Biotechnology. 25 (9), 1035-1044 (2007).
- Klaeger, S., et al. Chemical proteomics reveals ferrochelatase as a common off-target of kinase inhibitors. ACS Chemical Biology. 11 (5), 1245-1254 (2016).
- Duncan, J. S., et al. Dynamic reprogramming of the kinome in response to targeted MEK inhibition in triple-negative breast cancer. Cell. 149 (2), 307-321 (2012).
- Cooper, M. J., et al. Application of multiplexed kinase inhibitor beads to study kinome adaptations in drug-resistant leukemia. PLoS ONE. 8 (6), 66755 (2013).
- Lyons, S. P., et al. A quantitative chemical proteomic strategy for profiling phosphoprotein phosphatases from yeast to humans. Molecular and Cellular Proteomics. 17 (12), 2448-2461 (2018).
- Nasa, I., et al. Quantitative kinase and phosphatase profiling reveal that CDK1 phosphorylates PP2Ac to promote mitotic entry. Science Signaling. 13 (648), (2020).
- Swingle, M., Ni, L., Honkanen, R. E. Small-molecule inhibitors of ser/thr protein phosphatases: specificity, use and common forms of abuse. Methods in Molecular Biology. 365, 23-38 (2007).
- Moorhead, G. B. G., Haystead, T. A. J., MacKintosh, C. Synthesis and use of the protein phosphatase affinity matrices microcystin-sepharose and microcystin-biotin-sepharose. Methods in Molecular Biology. 365, 39-45 (2007).
- Brauer, B. L., Wiredu, K., Mitchell, S., Moorhead, G. B., Gerber, S. A., Kettenbach, A. N. Affinity-based profiling of endogenous phosphoprotein phosphatases by mass spectrometry. Nature Protocols. 16 (10), 4919-4943 (2021).
- Hughes, C. S., Moggridge, S., Müller, T., Sorensen, P. H., Morin, G. B., Krijgsveld, J. Single-pot, solid-phase-enhanced sample preparation for proteomics experiments. Nature Protocols. 14 (1), 68-85 (2019).
- Rappsilber, J., Mann, M., Ishihama, Y. Protocol for micro-purification, enrichment, pre-fractionation and storage of peptides for proteomics using StageTips. Nature Protocols. 2 (8), 1896-1906 (2007).
- Zecha, J., et al. TMT labeling for the masses: A robust and cost-efficient, in-solution labeling approach. Molecular and Cellular Proteomics. 18 (7), 1468-1478 (2019).
- Elias, J. E., Gygi, S. P. Target-decoy search strategy for increased confidence in large-scale protein identifications by mass spectrometry. Nature Methods. 4 (3), 207-214 (2007).
- Eng, J. K., Jahan, T. A., Hoopmann, M. R. Comet: an open-source MS/MS sequence database search tool. Proteomics. 13 (1), 22-24 (2013).
- Tyanova, S., et al. The Perseus computational platform for comprehensive analysis of (prote)omics data. Nature Methods. 13 (9), 731-740 (2016).
- Yu, S. H., Ferretti, D., Schessner, J. P., Rudolph, J. D., Borner, G. H. H., Cox, J. Expanding the Perseus software for omics data analysis With custom plugins. Current Protocols in Bioinformatics. 71 (1), 1-29 (2020).

