Caenorhabditis elegans Health Üzerinde Etkisi Olan Mikrobiyal İzolatların Yüksek Verimli Taraması
Summary
Bağırsak mikropları, konakçılarının sağlığını spesifik veya korunmuş mekanizmalar yoluyla olumlu veya olumsuz yönde etkileyebilir. Caenorhabditis elegans , bu tür mikropları taramak için uygun bir platformdur. Mevcut protokol, solucan sağlığı için bir vekil olarak kullanılan nematod stres direnci üzerindeki etki için 48 bakteri izolatının yüksek verimli taramasını açıklamaktadır.
Abstract
Küçük boyutu, kısa ömrü ve kolay genetiği ile Caenorhabditis elegans , mikrobiyal izolatların konakçı fizyolojisi üzerindeki etkisini incelemek için uygun bir platform sunar. Aynı zamanda ölürken mavi renkte floresan yapar ve ölümü tespit etmek için uygun bir araç sağlar. Bu özellik, yüksek verimli etiketsiz C. elegans hayatta kalma testleri (LFASS) geliştirmek için kullanılmıştır. Bunlar, popülasyon medyan ölüm zamanının türetilebileceği çok kuyulu plakalara yerleştirilmiş solucan popülasyonlarının hızlandırılmış floresan kaydını içerir. Bu çalışma, C. elegans’ın şiddetli ısı ve oksidatif streslere duyarlılığı üzerindeki etkileri için birden fazla mikrobiyal izolatı aynı anda taramak için LFASS yaklaşımını benimsemiştir. Özellikle probiyotikleri ön taramak için kullanılabilecek bu tür mikrobiyal tarama boru hattı, konakçı sağlığı için bir vekil olarak şiddetli stres direnci kullanarak burada bildirilmiştir. Protokol, hem C. elegans bağırsak mikrobiyotasının izole koleksiyonlarının hem de senkron solucan popülasyonlarının tahliller için birleştirilmeden önce çok kuyulu dizilerde nasıl yetiştirileceğini açıklar. Verilen örnek, paralel olarak iki stres tahlilinde 47 bakteri izolatının ve iki solucan suşu üzerinde bir kontrol suşunun test edilmesini kapsamaktadır. Bununla birlikte, yaklaşım boru hattı kolayca ölçeklenebilir ve diğer birçok yöntemin taranması için uygulanabilir. Böylece, C. elegans sağlığını etkileyen biyolojik ve biyokimyasal koşulların multiparametrik bir manzarasını hızlı bir şekilde araştırmak için çok yönlü bir kurulum sağlar.
Introduction
İnsan vücudu, öncelikle bağırsak, cilt ve mukozal ortamlarda bulunan tahmini 10-100 trilyon canlı mikrobiyal hücreyi (bakteri, arkea mantarı) barındırır1. Sağlıklı bir durumda, bunlar vitamin üretimi, bağışıklık sisteminin olgunlaşması, patojenlere karşı doğuştan gelen ve adaptif bağışıklık tepkilerinin uyarılması, yağ metabolizmasının düzenlenmesi, stres yanıtlarının modülasyonu ve daha fazlası dahil olmak üzere konakçılarına büyüme ve gelişme, hastalık başlangıcı ve yaşlanma üzerinde etkili olan faydalar sağlar 2,3,4,5 . Bağırsak mikrobiyotası da yaşam boyunca önemli ölçüde gelişir. En şiddetli evrim bebeklik ve erken çocuklukdöneminde meydana gelir 6, ancak Bifidobacterium bolluğunda bir azalma ve Clostridium, Lactobacillus, Enterobacteriaceae ve Enterococcus türlerinde bir artış da dahil olmak üzere yaşla birlikte önemli değişiklikler meydana gelir7. Yaşam tarzı, dysbiosis’e (faydalı bakteri kaybı, fırsatçı bakterilerin aşırı büyümesi) yol açan bağırsak mikrobiyal bileşimini daha da değiştirebilir, enflamatuar bağırsak hastalığı, diyabet ve obezite5 gibi çeşitli patolojilere neden olabilir, ancak aynı zamanda Alzheimer ve Parkinson hastalıklarına da katkıda bulunabilir 8,9,10,11.
Bu gerçekleşme, bağırsak fizyolojisi (şimdi içindeki mikroplar dahil) ve sinir sistemi arasındaki etkileşimlerin hayvan metabolizmasının ve fizyolojik işlevlerin ana düzenleyicisi olarak kabul edildiği bağırsak-beyin ekseni (GBA) kavramının rafine edilmesine kritik katkıda bulunmuştur12. Bununla birlikte, mikrobiyotanın bağırsak-beyin sinyalizasyonundaki kesin rolü ve ilişkili etki mekanizmaları tam olarak anlaşılmaktan uzaktır13. Bağırsak mikrobiyotasının sağlıklı yaşlanmanın önemli bir belirleyicisi olmasıyla, bakterilerin yaşlanma sürecini nasıl modüle ettiği yoğun bir araştırma ve tartışma konusu haline gelmiştir 6,14,15.
Yuvarlak kurt Caenorhabditis elegans’ın, diğer türlerde olduğu gibi, Bacteroidetes, Firmicutes ve Actinobacteria16,17,18,19,20 tarafından domine edilen iyi niyetli bir bağırsak mikrobiyotasına ev sahipliği yaptığının gösterilmesiyle, konakçı-bağırsak kommensal etkileşimlerini incelemek için deneysel bir platform olarak hızlı yükselişi21,22,23,24 ,25,26 araştırma cephaneliğimizi önemli ölçüde genişletti26,27,28,29. Özellikle, C. elegans’ın gen-diyet, gen-ilaç, gen-patojen vb. etkileşimlerini incelemesi için mevcut olan yüksek verimli deneysel yaklaşımlar, bakteriyel izolatların ve kokteyllerin C. elegans sağlığını ve yaşlanmasını nasıl etkilediğini hızlı bir şekilde keşfetmek için uyarlanabilir.
Mevcut protokol, probiyotikleri tanımlamak için kullanılabilecek sağlık için bir vekil olarak C. elegans stres direnci üzerindeki etkileri için çok kuyulu plakalara yerleştirilmiş bakteri izolatlarının veya karışımlarının dizilerini bir kerede taramak için deneysel bir boru hattını tanımlamaktadır. Bir floresan plaka okuyucu kullanarak otomatik stres direnci analizi için solucanları işlemeden önce büyük solucan popülasyonlarının nasıl yetiştirileceğini ve bakteri dizilerinin 96 ve 384 kuyucuklu plaka formatlarında nasıl ele alınacağını detaylandırır (Şekil 1). Yaklaşım, ölüm floresansı31 fenomeninden yararlanan etiketsiz otomatik hayatta kalma tahlillerine (LFASS)30 dayanmaktadır; burada ölmekte olan solucanlar, ölüm zamanını belirlemek için kullanılabilecek bir mavi floresan patlaması üretir. Mavi floresan, C. elegans bağırsak granüllerinde (lizozom ile ilişkili bir tür organel) depolanan antranilik asidin glukozil esterleri tarafından yayılır ve bu da ölüm üzerine solucan bağırsağında nekrotik bir kaskad tetiklendiğinde patlar31.
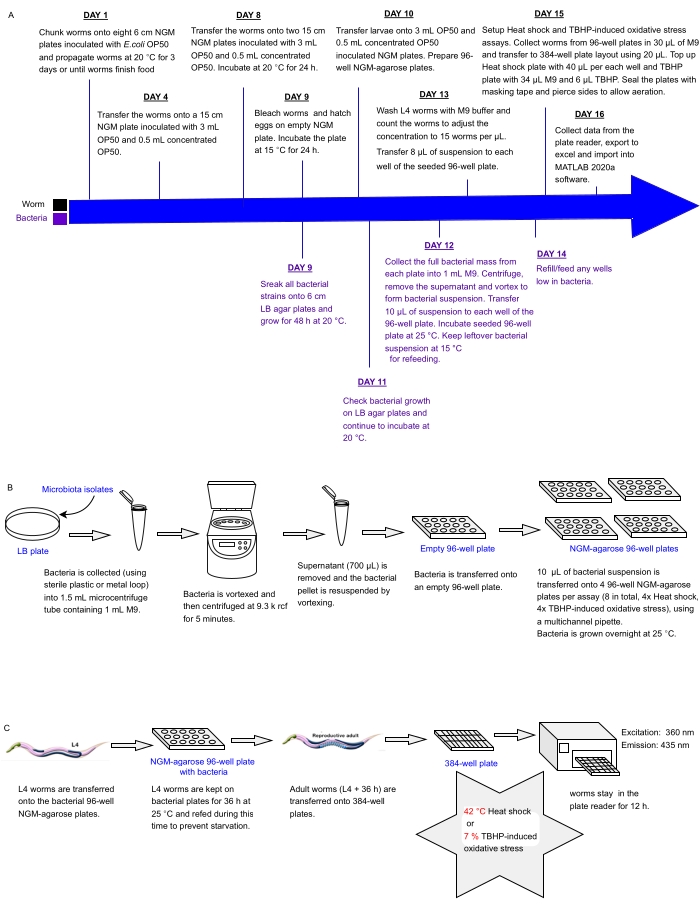
Şekil 1: C. elegans’ın strese karşı direnci üzerinde etkisi olan bakteriyel izolatların yüksek verimli taranması için deneysel iş akışı . (A) Solucan ve bakteri bakımı ve tahlil kurulumu için zaman çizelgesi. (B) 96 kuyucuklu bakteri plakası dizisi kurulumu ve kullanımı. (C) 384 delikli sonsuz plaka kurulumu. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
C. elegans, küçük boyutu, şeffaflığı, hızlı gelişimi, kısa ömrü, ucuzluğu ve kullanım kolaylığı nedeniyle aynı anda birden fazla deneysel parametreyi hızlı bir şekilde taramak için birçok avantaj sunar. Oldukça basit genomu, vücut planı, sinir sistemi, bağırsak ve mikrobiyomu, ancak insanlara yeterince karmaşık ve benzer, biyoaktif etkinlik veya toksisite için test ederken mekanik anlayışın kazanılabileceği güçlü bir klinik öncesi model haline getirmektedir. Hastalıklar …
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
CGC Minnesota’ya (Madison, ABD, NIH – P40 OD010440) solucan suşları sağladığı için ve OP50 ve Pr. Hinrich Schulenburg’a (CAU, Kiel, Almanya) burada tasvir edilen tüm çevresel mikrobiyal izolatları sağladıkları için teşekkür ederiz. Bu çalışma AB’ye UKRI-BBSRC hibesi ile finanse edilmiştir (BB / S017127 / 1). JM, Lancaster Üniversitesi FHM doktora bursu ile finanse edilmektedir.
Materials
| 10 cm diameter plates (Non-vented) | Fisher Scientific | 10720052 | Venting is not necessary for bacterial cultures |
| 15 cm diameter plates (Vented) | Fisher Scientific | 168381 | |
| 384-well black, transparent flat bottom plates | Corning | 3712 or 3762 | Not essential to be sterile for fast stress assays |
| 6 cm diameter plates (Vented) | Fisher Scientific | 150288 | Venting is necessary for worm cultures to avoid hypoxia |
| 96-well transparent plates (Biolite) | Thermo | 130188 | |
| Agar (<4% ash) | Sigma-Aldrich | 102218041 | Good quality agar is important for the structural integrity of the culture media, to avoid worm burrowing |
| Agarose | Fisher Scientific | BP1356 | |
| Avanti Centrifuge J-26 XP | Beckman coulter | ||
| Bleach | Honeywell | 425044 | |
| Calcium chloride | Sigma-Aldrich | C5080 | |
| Centrifuge 5415 R | Eppendorf | ||
| Centrifuge 5810 R | Eppendorf | ||
| Cholesterol | Sigma-Aldrich | C8667 | |
| LB agar | Difco | 240110 | |
| LB broth | Invitrogen | 12795084 | |
| LoBind tips | VWR | 732-1488 | Lo-bind reduce worm loss during transfers |
| LoBind tubes | Eppendorf | 22431081 | |
| Magnesium sulfate | Fisher Scientific | M/1100/53 | |
| Plate reader- infinite M nano+ | Tecan | Monochromator setup enables fluorescence tuning but adequate filter-based setups may be used | |
| Plate reader- Spark | Tecan | ||
| Potassium phosphate monobasic | Honeywell | P0662 | |
| Sodium chloride | Sigma-Aldrich | S/3160/63 | |
| Stereomicroscope setup with transillumination base | Leica | MZ6, or M80 | Magnification from 0.6-0.8x up to 40-60x is necessary, as is a good quality transillumination base with a deformable, titable or slidable mirror to adjust contrast |
| t-BHP (tert-Butyl hydroperoxide) | Sigma-Aldrich | 458139 | |
| Transparent adhesive seals Nunc | Fisher Scientific | 101706871 | It is important that it is transparent and that it can tolerate the temperatures involved in the assays. |
| Tryptophan | Sigma-Aldrich | 1278-7099 | |
| Yeast extract | Fisher Scientific | BP1422 |
Riferimenti
- Krishna, S., et al. Integrating microbiome network: establishing linkages between plants, microbes and human health. The Open Microbiology Journal. 13, 330-342 (2019).
- Amon, P., Sanderson, I. What is the microbiome. Archives of Disease in Childhood – Education & Practice Edition. 102 (5), 257-260 (2017).
- Belkaid, Y., Harrison, O. J. Homeostatic immunity and the microbiota. Immunity. 46 (4), 562-576 (2017).
- Cabreiro, F., Gems, D. Worms need microbes too: microbiota, health and aging in Caenorhabditis elegans. EMBO Molecular Medicine. 5 (9), 1300-1310 (2013).
- Vaga, S., et al. Compositional and functional differences of the mucosal microbiota along the intestine of healthy individuals. Scientific Reports. 10 (1), 14977 (2020).
- Nagpal, R., et al. Gut microbiome and aging: Physiological and mechanistic insights. Nutrition and Healthy Aging. 4 (4), 267-285 (2018).
- Mitsuoka, T. Establishment of intestinal bacteriology. Biosci Microbiota Food Health. 33 (3), 99-116 (2014).
- Bonfili, L., et al. Microbiota modulation as preventative and therapeutic approach in Alzheimer’s disease. The FEBS Journal. 288 (9), 2836-2855 (2021).
- Vendrik, K. E. W., et al. Fecal microbiota transplantation in neurological disorders. Frontiers in Cellular and Infection Microbiology. 10, 98 (2020).
- Wang, Q., et al. The role of gut dysbiosis in Parkinson’s disease: mechanistic insights and therapeutic options. Brain. 144 (9), 2571-2593 (2021).
- Zhu, X., et al. The relationship between the gut microbiome and neurodegenerative diseases. Neuroscience Bulletin. 37 (10), 1510-1522 (2021).
- Miller, I. The gut-brain axis: historical reflections. Microbial Ecology in Health and Disease. 29 (1), 1542921 (2018).
- Foster, J. A., Rinaman, L., Cryan, J. F. Stress & the gut-brain axis: Regulation by the microbiome. Neurobiology of Stress. 7, 124-136 (2017).
- Coman, V., Vodnar, D. C. Gut microbiota and old age: Modulating factors and interventions for healthy longevity. Experimental Gerontology. 141, 111095 (2020).
- Conway, J., Duggal, N. A. Ageing of the gut microbiome: Potential influences on immune senescence and inflammageing. Ageing Research Reviews. 68, 101323 (2021).
- Berg, M., et al. Assembly of the Caenorhabditis elegans gut microbiota from diverse soil microbial environments. The ISME Journal. 10 (8), 1998-2009 (2016).
- Dirksen, P., et al. CeMbio – The Caenorhabditis elegans Microbiome Resource. G3: Genes, Genomes, Genetics. 10 (9), 3025-3039 (2020).
- Dirksen, P., et al. The native microbiome of the nematode Caenorhabditis elegans: gateway to a new host-microbiome model. BMC Biology. 14, 38 (2016).
- Samuel, B. S., Rowedder, H., Braendle, C., Felix, M. A., Ruvkun, G. Caenorhabditis elegans responses to bacteria from its natural habitats. Proceedings of the National Academy of Sciences of the United States of America. 113 (27), 3941-3949 (2016).
- Zimmermann, J., et al. The functional repertoire contained within the native microbiota of the model nematode Caenorhabditis elegans. The ISME Journal. 14 (1), 26-38 (2020).
- Dinic, M., et al. Host-commensal interaction promotes health and lifespan in Caenorhabditis elegans through the activation of HLH-30/TFEB-mediated autophagy. Aging. 13 (6), 8040-8054 (2021).
- Goya, M. E., et al. Probiotic Bacillus subtilis protects against alpha-Synuclein aggregation in C. elegans. Cell Reports. 30 (2), 367-380 (2020).
- Hacariz, O., Viau, C., Karimian, F., Xia, J. The symbiotic relationship between Caenorhabditis elegans and members of its microbiome contributes to worm fitness and lifespan extension. BMC Genomics. 22 (1), 364 (2021).
- Shin, M. G., et al. Bacteria-derived metabolite, methylglyoxal, modulates the longevity of C. elegans through TORC2/SGK-1/DAF-16 signaling. Proceedings of the National Academy of Sciences of the United States of America. 117 (29), 17142-17150 (2020).
- Zhang, F., et al. Natural genetic variation drives microbiome selection in the Caenorhabditis elegans gut. Current Biology. 31 (12), 2603-2618 (2021).
- Zhang, F., et al. High-throughput assessment of changes in the Caenorhabditis elegans gut microbiome. Methods in Molecular Biology. 2144, 131-144 (2020).
- Chan, J. P., et al. Using bacterial transcriptomics to investigate targets of host-bacterial interactions in Caenorhabditis elegans. Scientific Reports. 9 (1), 5545 (2019).
- Hartsough, L. A., et al. Optogenetic control of gut bacterial metabolism to promote longevity. Elife. 9, 56849 (2020).
- Pryor, R., et al. Host-microbe-drug-nutrient screen identifies bacterial effectors of Metformin therapy. Cell. 178 (6), 1299-1312 (2019).
- Benedetto, A., et al. New label-free automated survival assays reveal unexpected stress resistance patterns during C. elegans aging. Aging Cell. 18 (5), 12998 (2019).
- Coburn, C., et al. Anthranilate fluorescence marks a calcium-propagated necrotic wave that promotes organismal death in C. elegans. PLOS Biology. 11 (7), 1001613 (2013).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Ceron, J. Basic Caenorhabditis elegans methods: synchronization and observation. Journal of Visualized Experiments. (64), e4019 (2012).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 1-11 (2006).
- Naomi, R., et al. Probiotics for Alzheimer’s disease: a systematic review. Nutrients. 14 (1), 20 (2021).
- Zheng, S. Y., et al. Potential roles of gut microbiota and microbial metabolites in Parkinson’s disease. Ageing Research Reviews. 69, 101347 (2021).
- Gill, M. S., Olsen, A., Sampayo, J. N., Lithgow, G. J. An automated high-throughput assay for survival of the nematode Caenorhabditis elegans. Free Radical Biology and Medicine. 35 (6), 558-565 (2003).
- Park, H. -. E. H., Jung, Y., Lee, S. -. J. V. Survival assays using Caenorhabditis elegans. Molecules and Cells. 40 (2), 90-99 (2017).
- Partridge, F. A., et al. An automated high-throughput system for phenotypic screening of chemical libraries on C. elegans and parasitic nematodes. International Journal for Parasitology: Drugs and Drug Resistance. 8 (1), 8-21 (2018).
- Rahman, M., et al. NemaLife chip: a micropillar-based microfluidic culture device optimized for aging studies in crawling C. elegans. Scientific Reports. 10 (1), 16190 (2020).
- Stroustrup, N., et al. The Caenorhabditis elegans lifespan machine. Nature Methods. 10 (7), 665-670 (2013).
- Xian, B., et al. WormFarm: a quantitative control and measurement device toward automated Caenorhabditis elegans aging analysis. Aging Cell. 12 (3), 398-409 (2013).
- Brown, A. E., Schafer, W. R. Unrestrained worms bridled by the light. Nature Methods. 8 (2), 129-130 (2011).
- Churgin, M. A., et al. Longitudinal imaging of Caenorhabditis elegans in a microfabricated device reveals variation in behavioral decline during aging. Elife. 6, 26652 (2017).
- Jushaj, A., et al. Optimized criteria for locomotion-based healthspan evaluation in C. elegans using the WorMotel system. PLoS One. 15 (3), 0229583 (2020).
- Nambyiah, P., Brown, A. E. X. Quantitative behavioural phenotyping to investigate anaesthesia induced neurobehavioural impairment. Scientific Reports. 11 (1), 19398 (2021).
- Squiban, B., Belougne, J., Ewbank, J., Zugasti, O. Quantitative and automated high-throughput genome-wide RNAi screens in C. elegans. Journal of Visualized Experiments. (60), e3448 (2012).
- Zugasti, O., et al. Activation of a G protein-coupled receptor by its endogenous ligand triggers the innate immune response of Caenorhabditis elegans. Nature Immunology. 15 (9), 833-838 (2014).
- Zugasti, O., et al. A quantitative genome-wide RNAi screen in C. elegans for antifungal innate immunity genes. BMC Biology. 14, 35 (2016).

