인지질 매개체는 3차원 배양에서 형질전환을 유도했습니다.
Summary
본 프로토콜은 혈소판 활성화 인자(PAF) 유도 형질전환을 연구하기 위해 변형된 형질전환되지 않은 유방 상피 세포주인 MCF10A의 3D ‘온탑 ‘ 배양의 설정을 설명합니다. 면역-형광은 형질전환을 평가하기 위해 사용되었으며 상세히 논의된다.
Abstract
설치류 모델 및 확립 된 세포주와 같은 암을 연구하기 위해 여러 모델이 개발되었습니다. 발암에 대한 귀중한 통찰력은 이러한 모델을 사용한 연구에 의해 제공되었습니다. 세포주는 유방 종양 발생과 관련된 분자 신호 전달의 조절 완화에 대한 이해를 제공하는 반면, 설치류 모델은 생체 내에서 유방암의 세포 및 분자 특성을 연구하는 데 널리 사용됩니다. 유방 상피 및 암세포의 3D 배양의 확립은 in vivo 조건을 모방하여 in vivo 모델과 in vitro 모델 사이의 격차를 해소하는 데 도움이 됩니다. 이 모델은 복잡한 분자 신호 전달 이벤트의 조절 완화와 유방 발암 중 세포 특성을 이해하는 데 사용할 수 있습니다. 여기서, 인지질 매개체-유도(혈소판 활성화 인자, PAF) 형질전환을 연구하기 위해 3D 배양 시스템을 변형한다. 면역 조절제 및 기타 분비 된 분자는 유방에서 종양 시작 및 진행에 중요한 역할을합니다. 본 연구에서, PAF에 노출된 유방 상피 세포의 3D acinar 배양물은 극성 손실 및 변경된 세포 특성과 같은 형질전환 특성을 나타내었다. 이 3D 배양 시스템은 종양 미세 환경에서 다양한 소분자 개체에 의해 유도된 유전적 및/또는 후성유전학적 섭동을 밝히는 데 도움이 됩니다. 또한, 이 시스템은 또한 형질전환 과정에 관여할 수 있는 신규한 유전자뿐만 아니라 알려진 유전자의 식별을 위한 플랫폼을 제공할 것이다.
Introduction
암의 진행을 연구하기 위해 수많은 모델을 사용할 수 있으며, 각 모델은 고유하며이 복잡한 질병의 하위 유형을 나타냅니다. 각 모델은 암 생물학에 대한 독특하고 가치 있는 통찰력을 제공하며 실제 질병 상태를 모방하는 수단을 개선했습니다. 단일층으로 성장한 확립된 세포주는 증식, 침습성, 이동 및 세포자멸사와 같은 시험관 내 중요한 과정에 대한 귀중한 통찰력을제공했습니다1. 2차원(2D) 세포 배양이 여러 환경 섭동에 대한 포유류 세포의 반응을 조사하는 전통적인 도구였지만 조직 수준 반응을 예측하기 위한 이러한 발견의 외삽은 충분히 설득력이 없어 보입니다. 2D 배양의 주요 한계는 생성 된 미세 환경이 유방 조직 자체의 미세 환경과 크게 다르다는 것입니다2. 2D 배양은 세포와 세포 외 기질의 상호 작용이 부족하며, 이는 모든 조직의 성장에 필수적입니다. 또한 단층 배양에서 세포가 경험하는 인장력은 이러한 세포의 극성을 방해하여 세포 신호 전달 및 거동 3,4,5를 변경합니다. 3차원(3D) 배양 시스템은 체외 조건을 모방할 수 있는 능력으로 암 연구 분야의 새로운 길을 열었습니다. 2D 세포 배양에서 손실되는 많은 중요한 미세환경 신호는 라미닌이 풍부한 세포외 기질(lrECM)의 3D 배양을 사용하여 재설정할 수 있습니다6.
다양한 연구에서 발암 7,8에서 종양 미세 환경의 중요성이 확인되었습니다. 염증 관련 요인은 미세 환경의 주요 부분입니다. 혈소판 활성화 인자 (PAF)는 다중 면역 반응 9,10을 매개하는 다양한 면역 세포에 의해 분비되는 인지질 매개체입니다. 높은 수준의 PAF는 상이한 유방암 세포주에 의해 분비되며 향상된 증식과 관련이 있습니다11. 우리 연구실의 연구에 따르면 아시나 배양에서 PAF가 장기간 존재하면 유방 상피 세포가 변형되는 것으로 나타났습니다12. PAF는 PAF 수용체 (PAFR)를 활성화시켜 PI3K / Akt 신호 전달 축13을 활성화시킵니다. PAFR은 또한 EMT, 침습 및 전이14와 관련이있는 것으로보고되었습니다.
본 프로토콜은 Chakravarty et al.12에 의해 이전에 기술된 바와 같이, 유방 상피 세포의 3D 배양을 사용하여 PAF-유도된 형질전환을 연구하기 위한 모델 시스템을 입증한다. 세포외 기질(3D 배양)에서 성장한 유방 상피 세포는 편광된 성장 정지 스페로이드를 형성하는 경향이 있습니다. 이들은 acini라고 불리며 생체내 15에서 유선의 가장 작은 기능 단위 인 유방 조직의 acini와 매우 유사합니다. 이러한 스페로이드(그림 1A,B)는 속이 빈 내강을 둘러싸고 기저막에 부착된 밀접하게 채워진 편광 상피 세포의 단층으로 구성됩니다(그림 1C). 이러한 형태 형성 과정은 문헌16에 잘 설명되어 있습니다. lrECM에 파종하면 세포가 분열과 분화를 거쳐 세포 클러스터를 형성한 다음 4일째부터 분극화됩니다. 8일차까지 acini는 세포외 기질과 직접 접촉하는 편광 세포 그룹과 기질에 접촉하지 않고 외부 편광 세포 내에 둘러싸인 분극되지 않은 세포 클러스터로 구성됩니다. 이러한 분극되지 않은 세포는 배양 12일째까지 세포사멸을 거쳐 속이 빈 내강을 형성하는 것으로 알려져 있습니다. 16 일째까지, 성장 정지 구조가 형성됩니다16.
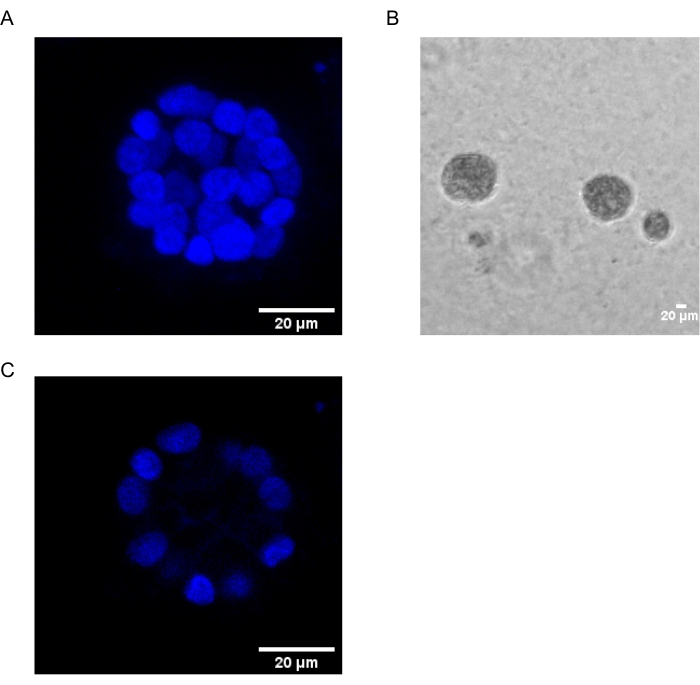
그림 1: 핵 염색으로 염색된 acini의 세포핵 . (A) acini의 3D 구성. (B) 20일 동안 마트리겔에서 성장한 MCF10A 아시니의 위상차 이미지. (C) 가장 중앙 부분은 중공 루멘의 존재를 보여줍니다. 스케일 바 = 20 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2D 배양과 달리 acinar 배양은 명백한 형태 변화를 통해 정상 세포와 형질전환 세포를 구별하는 데 도움이 됩니다. 형질전환되지 않은 유방 상피 세포는 속이 빈 내강을 가진 acini를 형성하여 정상적인 인간 유방 acini를 모방합니다. 이러한 스페로이드는 변형시 다양한 유전자의 조절 완화로 인해 유도 될 수있는 극성의 주요 손실 (암의 특징 중 하나), 내강의 부재 또는 중공 내강의 파괴 (세포 사멸의 회피로 인한)를 특징으로하는 분열 된 형태를 보여줍니다17,18,19,20 . 이러한 형질전환은 면역형광법과 같이 일반적으로 사용되는 기술을 사용하여 연구할 수 있습니다. 따라서, 3D 세포 배양 모델은 유방 무시나르 형태형성 및 유방 발암 과정을 조사하는 간단한 방법으로 기능할 수 있다. 인지질 매개체인 PAF의 효과를 이해하기 위한 3D 배양 시스템을 구축하면 고처리량 전임상 약물 스크리닝에 도움이 됩니다.
이 연구는 PAF 22에 의해 유도 된 형질 전환을 연구하기 위해 3D ‘상단’배양 프로토콜16,21을 채택했습니다. 인지질 매개체에 대한 acini의 노출에 의해 유도 된 표현형 변화는 면역 형광법을 사용하여 연구되었다. 다양한 극성 및 상피에서 중간엽으로의 전이(EMT) 마커12,16이 연구에 사용되었습니다. 표 1은 이들의 정상적인 국소화와 형질전환 시 예상되는 표현형을 언급한다.
| 항 체 | 표시 | 일반 현지화 | 형질 전환 된 표현형 |
| α6-인테그린 | 기저측 | 약한 측면 얼룩이있는 기초 | 강한 측면 / 정점 얼룩 |
| β-카테닌 | 세포-세포 접합 | 기저측 | 비정상/핵 또는 세포질 국소화 |
| 비 멘틴 | 증권 시세 표시기 | 부재 / 약한 존재 | 상향 규제 |
표 1: 연구에 사용된 마커. PAF 치료의 유무에 따라 국소화와 함께 사용되는 다른 마커.
이 방법은 다양한 유방암 아형에 대한 그럴듯한 약물 및 표적 유전자를 연구/스크리닝하는 데 가장 잘 활용될 수 있습니다. 이는 생체 내 시나리오에 더 가까운 약물 반응 데이터를 제공하여 더 빠르고 신뢰할 수 있는 약물 개발을 지원할 수 있습니다. 또한이 시스템은 약물 반응 및 약물 내성과 관련된 분자 신호 전달을 연구하는 데 사용할 수 있습니다.
Protocol
Representative Results
Discussion
확립 된 세포주 기반 모델은 발암 과정을 연구하는 데 널리 사용됩니다. 세포의 단일층 배양은 암세포의 특징적인 변화를 매개하는 다양한 분자 신호전달 경로에 대한 통찰력을 지속적으로 제공한다32. Ras, Myc 및 돌연변이 된 p53과 같은 잘 알려진 종양 유전자의 역할에 대한 연구는 단층 배양을 모델 시스템33,34,35,36<sup class="xref…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
장비 및 인프라에 대한 접근과 실험 지원에 대해 IISER Pune 현미경 시설에 감사드립니다. 이 연구는 생명 공학부 (DBT), 인도 정부 (BT / PR8699 / MED / 30 / 1018 / 2013), 과학 및 공학 연구위원회 (SERB), 인도 정부 (EMR / 2016 / 001974) 및 부분적으로 IISER, Pune Core 자금. AK는 CSIR-SRF 펠로우십, LA는 DST-INSPIRE 펠로우십, V.C.는 DBT(BT/PR8699/MED/30/1018/2013)에서 자금을 지원받았습니다.
Materials
| 0.05% Trypsin EDTA | Invitrogen | 25300062 | |
| 16% paraformaldehyde | Alfa Aesar | AA433689M | |
| Anti Mouse Alexa Flour 488 | Invitrogen | A11029 | |
| Anti Rabbit Alexa Flour 488 | Invitrogen | A-11008 | |
| BSA | Sigma | A7030 | |
| Chamber Coverglass | Nunc | 155409 | |
| Cholera Toxin | Sigma | C8052-1MG | 1 mg/mL in dH2O |
| Confocal Microscope | Leica | Leica SP8 | |
| DMEM | Gibco | 11965126 | |
| EDTA | Sigma | E6758 | |
| EGF | Sigma | E9644-0.2MG | 100 mg/mL in dH2O |
| F(ab’)2 fragment of antibody raised in goat against mouse antigen | Jackson Immunoresearch | 115-006-006 | |
| GM130 antibody | Abcam | ab52649 | |
| Goat Serum | Abcam | ab7481 | |
| Hoechst | Invitrogen | 33258 | |
| Horse Serum | Gibco | 16050122 | |
| Hydrocortisone | Sigma | H0888 | 1 mg/mL in ethanol |
| Image Processing Software | ImageJ | ||
| Insulin | Sigma | I1882 | 10 mg/mL stock dH2O |
| lrECM (Matrigel) | Corning | 356231 | |
| Mounting reagent (Slow fade Gold Anti-fade) | Invitrogen | S36937 | |
| Nuclear Stain (Hoechst) | Invitrogen | 33258 | |
| PAF | Cayman Chemicals | 91575-58-5 | Methylcarbamyl PAF C-16, procured as a 10 mg/mL in ethanol |
| Penicillin-Streptomycin | Lonza | 17-602E | |
| Sodium Azide | Sigma | S2002 | |
| Tris Base | Sigma | B9754 | |
| Triton X-100 | Sigma | T8787 | |
| Tween 20 | Sigma | P9416 | |
| Vimentin antibody | Abcam | ab92547 | |
| α6-integrin antibody | Millipore | MAB1378 |
Riferimenti
- Lacroix, M., Leclercq, G. Relevance of breast cancer cell lines as models for breast tumours: an update. Breast Cancer Research and Treatment. 83 (3), 249-289 (2004).
- Vargo-Gogola, T., Rosen, J. M. Modelling breast cancer: one size does not fit all. Nature Reviews Cancer. 7 (9), 659-672 (2007).
- Runswick, S. K., O’Hare, M. J., Jones, L., Streuli, C. H., Garrod, D. R. Desmosomal adhesion regulates epithelial morphogenesis and cell positioning. Nature Cell Biology. 3 (9), 823-830 (2001).
- Streuli, C. H., Bailey, N., Bissell, M. J. Control of mammary epithelial differentiation: basement membrane induces tissue-specific gene expression in the absence of cell-cell interaction and morphological polarity. Journal of Cell Biology. 115 (5), 1383-1395 (1991).
- Streuli, C. H., et al. Laminin mediates tissue-specific gene expression in mammary epithelia. Journal of Cell Biology. 129 (3), 591-603 (1995).
- Bissell, M. J., Kenny, P. A., Radisky, D. C. Microenvironmental regulators of tissue structure and function also regulate tumor induction and progression: the role of extracellular matrix and its degrading enzymes. Cold Spring Harbor Symposia on Quantitative Biology. 70, 343-356 (2005).
- Heinrich, E. L., et al. The inflammatory tumor microenvironment, epithelial mesenchymal transition and lung carcinogenesis. Cancer Microenvironment. 5 (1), 5-18 (2012).
- Gonda, T. A., Tu, S., Wang, T. C. Chronic inflammation, the tumor microenvironment and carcinogenesis. Cell Cycle. 8 (13), 2005-2013 (2009).
- Berdyshev, E. V., Schmid, P. C., Krebsbach, R. J., Schmid, H. H. Activation of PAF receptors results in enhanced synthesis of 2-arachidonoylglycerol (2-AG) in immune cells. The FASEB Journal. 15 (12), 2171-2178 (2001).
- Rola-Pleszczynski, M., Stankova, J. Cytokine gene regulation by PGE(2), LTB(4) and PAF. Mediators of Inflammation. 1 (2), 5-8 (1992).
- Bussolati, B., et al. PAF produced by human breast cancer cells promotes migration and proliferation of tumor cells and neo-angiogenesis. The American Journal of Pathology. 157 (5), 1713-1725 (2000).
- Chakravarty, V., et al. Prolonged exposure to platelet activating factor transforms breast epithelial cells. Frontiers in Genetics. 12, 634938 (2021).
- Chen, J., et al. Platelet-activating factor receptor-mediated PI3K/AKT activation contributes to the malignant development of esophageal squamous cell carcinoma. Oncogene. 34 (40), 5114-5127 (2015).
- Chen, J., et al. Feed-forward reciprocal activation of PAFR and STAT3 regulates epithelial-mesenchymal transition in non-small cell lung cancer. Ricerca sul cancro. 75 (19), 4198-4210 (2015).
- Vidi, P. A., Bissell, M. J., Lelievre, S. A. Three-dimensional culture of human breast epithelial cells: the how and the why. Methods in Molecular Biology. 945, 193-219 (2013).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30 (3), 256-268 (2003).
- Barcellos-Hoff, M. H., Aggeler, J., Ram, T. G., Bissell, M. J. Functional differentiation and alveolar morphogenesis of primary mammary cultures on reconstituted basement membrane. Development. 105 (2), 223-235 (1989).
- Petersen, O. W., Ronnov-Jessen, L., Howlett, A. R., Bissell, M. J. Interaction with basement membrane serves to rapidly distinguish growth and differentiation pattern of normal and malignant human breast epithelial cells. Proceedings of the National Academy of Sciences. 89 (19), 9064-9068 (1992).
- Shaw, K. R., Wrobel, C. N., Brugge, J. S. Use of three-dimensional basement membrane cultures to model oncogene-induced changes in mammary epithelial morphogenesis. Journal of Mammary Gland Biology and Neoplasia. 9 (4), 297-310 (2004).
- Weaver, V. M., Fischer, A. H., Peterson, O. W., Bissell, M. J. The importance of the microenvironment in breast cancer progression: recapitulation of mammary tumorigenesis using a unique human mammary epithelial cell model and a three-dimensional culture assay. Biochemistry and Cell Biology. 74 (6), 833-851 (1996).
- Lee, G. Y., Kenny, P. A., Lee, E. H., Bissell, M. J. Three-dimensional culture models of normal and malignant breast epithelial cells. Nature Methods. 4 (4), 359-365 (2007).
- Bodakuntla, S., Libi, A. V., Sural, S., Trivedi, P., Lahiri, M. N-nitroso-N-ethylurea activates DNA damage surveillance pathways and induces transformation in mammalian cells. BMC Cancer. 14, 287 (2014).
- Banerjee, A., et al. A rhodamine derivative as a "lock" and SCN− as a "key": visible light excitable SCN− sensing in living cells. Chemical Communications. 49 (25), 2527-2529 (2013).
- Ren, G., et al. Reduced basal nitric oxide production induces precancerous mammary lesions via ERBB2 and TGFbeta. Scientific Reports. 9 (1), 6688 (2019).
- Anandi, L., Chakravarty, V., Ashiq, K. A., Bodakuntla, S., Lahiri, M. DNA-dependent protein kinase plays a central role in transformation of breast epithelial cells following alkylation damage. Journal of Cell Science. 130 (21), 3749-3763 (2017).
- Sonnenberg, A., et al. Integrin alpha 6/beta 4 complex is located in hemidesmosomes, suggesting a major role in epidermal cell-basement membrane adhesion. Journal of Cell Biology. 113 (4), 907-917 (1991).
- Pignatelli, M., Cardillo, M. R., Hanby, A., Stamp, G. W. Integrins and their accessory adhesion molecules in mammary carcinomas: loss of polarization in poorly differentiated tumors. Human Pathology. 23 (10), 1159-1166 (1992).
- Natali, P. G., et al. Changes in expression of alpha 6/beta 4 integrin heterodimer in primary and metastatic breast cancer. British Journal of Cancer. 66 (2), 318-322 (1992).
- Davis, T. L., Cress, A. E., Dalkin, B. L., Nagle, R. B. Unique expression pattern of the alpha6beta4 integrin and laminin-5 in human prostate carcinoma. Prostate. 46 (3), 240-248 (2001).
- Liu, J. S., Farlow, J. T., Paulson, A. K., Labarge, M. A., Gartner, Z. J. Programmed cell-to-cell variability in Ras activity triggers emergent behaviors during mammary epithelial morphogenesis. Cell Reports. 2 (5), 1461-1470 (2012).
- Liu, C. Y., Lin, H. H., Tang, M. J., Wang, Y. K. Vimentin contributes to epithelial-mesenchymal transition cancer cell mechanics by mediating cytoskeletal organization and focal adhesion maturation. Oncotarget. 6 (18), 15966-15983 (2015).
- Kapalczynska, M., et al. 2D and 3D cell cultures-a comparison of different types of cancer cell cultures. Archives of Medical Science. 14 (4), 910-919 (2018).
- Schulze, A., Lehmann, K., Jefferies, H. B., McMahon, M., Downward, J. Analysis of the transcriptional program induced by Raf in epithelial cells. Genes & Development. 15 (8), 981-994 (2001).
- McCarthy, S. A., Samuels, M. L., Pritchard, C. A., Abraham, J. A., McMahon, M. Rapid induction of heparin-binding epidermal growth factor/diphtheria toxin receptor expression by Raf and Ras oncogenes. Genes & Development. 9 (16), 1953-1964 (1995).
- Willis, A., Jung, E. J., Wakefield, T., Chen, X. Mutant p53 exerts a dominant negative effect by preventing wild-type p53 from binding to the promoter of its target genes. Oncogene. 23 (13), 2330-2338 (2004).
- Haupt, S., Raghu, D., Haupt, Y. Mutant p53 drives cancer by subverting multiple tumor suppression pathways. Frontiers in Oncology. 6, 12 (2016).
- Langhans, S. A. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in Pharmacology. 9, 6 (2018).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. ASSAY and Drug Development Technologies. 12 (4), 207-218 (2014).
- Lv, D., Hu, Z., Lu, L., Lu, H., Xu, X. Three-dimensional cell culture: A powerful tool in tumor research and drug discovery. Oncology Letters. 14 (6), 6999-7010 (2017).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33 (2020).
- Saraiva, D. P., Matias, A. T., Braga, S., Jacinto, A., Cabral, M. G. Establishment of a 3D co-culture with MDA-MB-231 breast cancer cell line and patient-derived immune cells for application in the development of immunotherapies. Frontiers in Oncology. 10, 1543 (2020).

