In vitro fordøjelse af emulsioner i en enkelt dråbe via multifaseudveksling af simulerede gastrointestinale væsker
Summary
En pendel drop overflade film balance implementeret med en multi-subfase udveksling, kaldet OCTOPUS, giver mulighed for at efterligne fordøjelsesforholdene ved sekventiel subfase udveksling af den oprindelige bulkopløsning med simulerede gastrointestinale væsker. Den simulerede in vitro-fordøjelse overvåges ved at registrere in situ grænsefladespændingen i det fordøjede grænsefladelag.
Abstract
Emulsioner bruges i øjeblikket til at indkapsle og levere næringsstoffer og lægemidler til at tackle forskellige gastrointestinale tilstande såsom fedme, næringsstofbefæstning, fødevareallergier og fordøjelsessygdomme. En emulsions evne til at tilvejebringe den ønskede funktionalitet, nemlig at nå et bestemt sted i mave-tarmkanalen, hæmme / forsinke lipolyse eller lette fordøjeligheden, afhænger i sidste ende af dets modtagelighed for enzymatisk nedbrydning i mave-tarmkanalen. I olie-i-vand-emulsioner er lipiddråber omgivet af grænsefladelag, hvor emulgatorerne stabiliserer emulsionen og beskytter den indkapslede forbindelse. At opnå en skræddersyet fordøjelighed af emulsioner afhænger af deres oprindelige sammensætning, men kræver også overvågning af udviklingen af disse grænsefladelag, da de udsættes for forskellige faser af gastrointestinal fordøjelse. En pendel drop overflade film balance implementeret med en multi-subfase udveksling gør det muligt at simulere in vitro fordøjelsen af emulsioner i en enkelt vandig dråbe nedsænket i olie ved at anvende en tilpasset statisk fordøjelsesmodel. Transitten gennem mave-tarmkanalen efterlignes ved subfaseudvekslingen af den oprindelige dråbemasseopløsning med kunstige medier, der efterligner de fysiologiske tilstande i hvert rum / trin i mave-tarmkanalen. Den dynamiske udvikling af grænsefladespændingen registreres in situ gennem hele den simulerede gastrointestinale fordøjelse. De mekaniske egenskaber ved fordøjede grænseflader, såsom grænsefladedilatationselasticitet og viskositet, måles efter hver fordøjelsesfase (oral, mave, tyndtarm). Sammensætningen af hvert fordøjelsesmedie kan indstilles til at tage højde for de særlige forhold i fordøjelsesforholdene, herunder gastrointestinale patologier og spædbarns fordøjelsesmedier. De specifikke grænseflademekanismer, der påvirker proteolyse og lipolyse, identificeres, hvilket giver værktøjer til at modulere fordøjelsen ved grænsefladeteknik af emulsioner. De opnåede resultater kan manipuleres til design af nye fødevarematricer med skræddersyede funktionaliteter såsom lav allergenicitet, kontrolleret energiindtag og nedsat fordøjelighed.
Introduction
At forstå, hvordan fedt fordøjes, hvilket involverer emulsionsfordøjelse, er vigtigt for rationelt at designe produkter med skræddersyet funktionalitet1. Substratet til fedtfordøjelse er en emulsion, da fedt emulgeres ved forbrug ved mekanisk virkning og blanding med biosurfactanter i mund og mave. Det meste af det fedt, der forbruges af mennesker, er også allerede emulgeret (såsom mejeriprodukter), og i tilfælde af spædbørn eller nogle ældre mennesker er dette den eneste form for forbrug. Derfor er designet af emulsionsbaserede produkter med specifikke fordøjelsesprofiler meget vigtigt i ernæring1. Desuden kan emulsioner indkapsle og levere næringsstoffer, lægemidler eller lipofile bioaktive stoffer2 for at tackle forskellige gastrointestinale tilstande såsom fedme3, næringsstofbefæstning, fødevareallergier og fordøjelsessygdomme. I olie-i-vand-emulsioner er lipiddråber omgivet af grænsefladelag af emulgatorer, såsom proteiner, overfladeaktive stoffer, polymerer, partikler og blandinger4. Emulgatorernes rolle er todelt: stabilisere emulsionen5 og beskytte / transportere den indkapslede forbindelse til et bestemt sted. At opnå en skræddersyet fordøjelighed af emulsioner afhænger af deres oprindelige sammensætning, men kræver også overvågning af den kontinuerlige udvikling af denne grænseflade under transit gennem mave-tarmkanalen (figur 1).
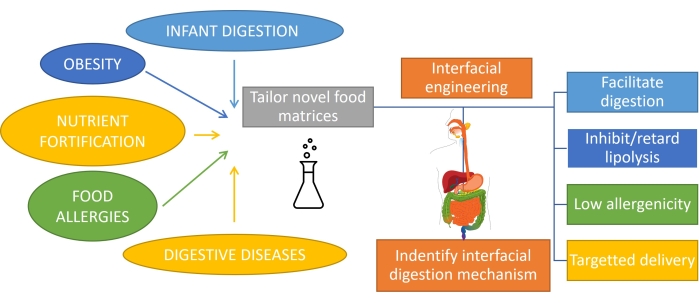
Figur 1: Anvendelse af grænsefladeteknik af emulsioner til at tackle nogle af de vigtigste gastrointestinale tilstande. Klik her for at se en større version af denne figur.
Lipidfordøjelse er i sidste ende en grænsefladeproces, fordi det kræver adsorption af lipaser (mave eller bugspytkirtel) på olie-vand-grænsefladen af emulgerede lipiddråber gennem grænsefladelaget for at nå og hydrolysere triglycerider indeholdt i olien til frie fedtsyrer og monoacylglycerider6. Dette er skematiseret i figur 2. Gastrisk lipase konkurrerer med pepsin og fosfolipider i maven for olie-vand-grænsefladen (figur 2, gastrisk fordøjelse). Derefter konkurrerer bugspytkirtellipase / colipase med trypsin / chymotrypsin, fosfolipider, galdesalte og fordøjelsesprodukter i tyndtarmen. Proteaser kan ændre grænsefladedækningen, forhindre eller favorisere lipaseadsorption, mens galdesalte er meget overfladeaktive og fortrænger det meste af det resterende emulgator for at fremme lipaseadsorption (figur 2, tarmfordøjelse). Til sidst afhænger hastigheden og omfanget af lipolyse af grænsefladeegenskaberne af den oprindelige / gastriske fordøjede emulsion, såsom tykkelsen, inter / intramolekylære forbindelser og elektrostatiske og steriske interaktioner. Følgelig tilbyder overvågning af udviklingen af grænsefladelaget, når det fordøjes, en eksperimentel platform til at identificere grænseflademekanismer og begivenheder, der påvirker lipaseadsorption og dermed lipidfordøjelse.
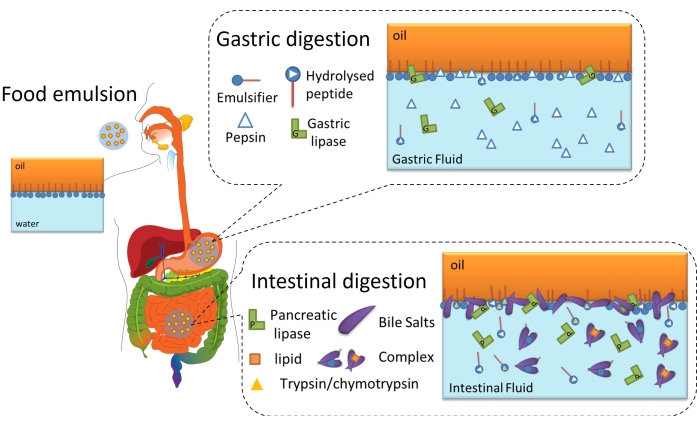
Figur 2: Skematisk diagram, der illustrerer grænsefladernes rolle i gastrointestinal lipidfordøjelse. Pepsinhydrolyse ændrer grænsefladesammensætningen i gastrisk fase, mens gastrisk lipase hydrolyserer triglycerider. I tyndtarmen hydrolyserer trypsin / chymotrypsin yderligere grænsefladefilmen, mens lipolyse fortsætter ved adsorption af BS / lipaser, hydrolyse af triglycerider og desorption af lipolytiske produkter ved opløselighed i BS-miceller / kompleks. Klik her for at se en større version af denne figur.
Vedhængsdråbeudstyret ved Granada Universitet (UGR) er implementeret med en patenteret teknologi, den koaksiale dobbeltkapillær, der muliggør subfaseudveksling af bulkopløsningen7. Kapillæren, der holder vedhængsdråben, består af et arrangement af to koaksiale kapillærer, der er uafhængigt forbundet med hver kanal i en dobbelt mikroinjektor. Hver mikroinjektor kan fungere uafhængigt, hvilket gør det muligt at udveksle det tabte indhold med gennemstrømning7. Subfaseudvekslingen består således af samtidig injektion af den nye opløsning med den indre kapillær og ekstraktion af bulkopløsningen med den ydre kapillær under anvendelse af samme strømningshastighed. Denne proces tillader udskiftning af bulkopløsningen uden forstyrrelse af grænsefladeområdet eller dråbens volumen. Denne procedure blev senere opgraderet til en multi-subfase udveksling, som tillader op til otte sekventielle underfaseudvekslinger af dråbebulkopløsningen8. Dette muliggør simulering af fordøjelsesprocessen i en enkelt vandig dråbe suspenderet i lipidmedier ved sekventielt at udveksle bulkopløsningen med kunstige medier, der efterligner de forskellige rum (mund, mave, tyndtarm). Hele opsætningen er repræsenteret i figur 3, herunder detaljerne i komponenterne. Sprøjterne i mikroinjektoren er forbundet med de otte viasventiler, der hver forbinder til et mikrocentrifugerør indeholdende den kunstige fordøjelsesvæske med komponenter beskrevet i figur 2.

Figur 3: Generel visning af OCTOPUS med alle komponenter. CCD-kameraet, mikroskopet, mikropositioner, termostabiliseret celle og dobbelt kapillær forbundet uafhængigt til en dobbelt mikroinjektor med to sprøjter forbundet til otte vias-ventiler. Hver sprøjte forbindes med kapillær, fire mikrocentrifugerør med prøve og en udledning. Klik her for at se en større version af denne figur.
Figur 4A viser, hvordan hver af de kunstige fordøjelsesvæsker injiceres i vedhænget dråbe ved underfaseudveksling gennem dobbeltkapillæren. Hver fordøjelsesforbindelse, der er beskrevet i figur 2 , kan påføres samtidigt / sekventielt og simulere passagen gennem mave-tarmkanalen. De kunstige fordøjelsesvæsker indeholder forskellige enzymer og biosurfactanter, som ændrer grænsefladespændingen i den oprindelige emulgator, som skematiseret i figur 4B. Softwaren DINATEN (se Materialetabel), der også er udviklet på UGR, registrerer udviklingen af grænsefladespændingen i realtid, når det oprindelige grænsefladelag fordøjes in vitro. Efter hver fordøjelsesfase beregnes grænsefladelagets dilatationselasticitet også ved at pålægge periodiske svingninger af volumen / grænsefladeområde på det stabiliserede grænsefladelag og registrere reaktionen af grænsefladespændingen. Perioden/frekvensen og amplituden af svingningen kan varieres, og billedbehandling med softwaren CONTACTO giver de dilatationelle reologiske parametre8.
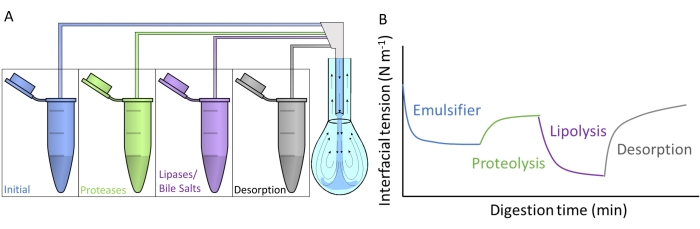
Figur 4: Eksempler på fordøjelsesprofiler . (A) Det oprindelige emulgatorlag udsættes for kunstige fordøjelsesmedier anbragt i mikrocentrifugen ved sekventiel subfaseudveksling af de forskellige opløsninger i vedhængsdråben. (B) Den generelle udvikling af grænsefladespændingen (y-aksen) af den oprindelige emulgator som funktion af tiden (x-aksen), som den fordøjes in vitro af de forskellige enzymer/biosurfactanter i de kunstige medier. En endelig subfaseudveksling med almindelig tarmvæske måler desorptionen af fordøjet lipid ved opløselighed i blandede miceller. Klik her for at se en større version af denne figur.
Denne undersøgelse præsenterer den generelle protokol designet til at måle in vitro fordøjelse af grænsefladelag med vedhængdrop udstyr 9. Det indledende grænsefladelag udsættes sekventielt for forhold, der efterligner passagen gennem mave-tarmkanalen, som afbildet i figur 2. Disse forskellige fordøjelsesmedier injiceres i vedhængsdråben ved subfaseudveksling af de forskellige opløsninger indeholdt i mikrocentrifugerørene (figur 4A). Sammensætningen af disse medier kan tilpasses afhængigt af de gastrointestinale tilstande, der vil blive evalueret, nemlig gastrisk / intestinal proteolyse / lipolyse, hvilket gør det muligt at måle kumulative virkninger og sinergier10. De eksperimentelle betingelser, der bruges til at efterligne fordøjelsesprocessen i hvert rum, følger den internationale konsensusprotokol offentliggjort af INFOGEST, der beskriver pH og mængder af elektrolytter og enzymer11. Den eksperimentelle enhed baseret på vedhængsfald tillader optagelse af grænsefladespændingen in situ gennem hele den simulerede fordøjelsesproces. Den dilatationelle reologi af grænsefladelaget beregnes i slutningen af hvert fordøjelsestrin. På denne måde tilbyder hver emulgator en fordøjelsesprofil, der illustrerer egenskaberne af de fordøjede grænseflader, som afbildet i figur 4B. Dette gør det muligt at udtrække konklusioner vedrørende dets modtagelighed eller modstand mod de forskellige stadier af fordøjelsesprocessen. Generelt indeholder det kunstige fordøjelsesmedie syre / basisk pH, elektrolytter, proteaser (mave og tarm), lipaser (mave og tarm), galdesalte og phospholipider, som opløses i deres respektive fordøjelsesvæsker (mave eller tarm). Figur 4B viser en generisk profil af udviklingen af en emulgators grænsefladespænding, først udsat for proteasevirkning efterfulgt af lipaser. Generelt fremmer proteolyse af grænsefladelaget en stigning i grænsefladespændingen på grund af desorptionen af hydrolyserede peptider9,12, mens lipolyse resulterer i en meget stejl reduktion i grænsefladespændingen på grund af adsorptionen af galdesalte og lipaser 13. En endelig subfaseudveksling med tarmvæske nedbryder bulkopløsningen af uadsorberet / fordøjet materiale og fremmer desorptionen af opløselige forbindelser og opløselsen af fordøjede lipider i blandede miceller. Dette kvantificeres af den registrerede øgede grænsefladespænding (figur 4B).
Sammenfattende giver det eksperimentelle design, der er implementeret i vedhængsdråben for at simulere in vitro-fordøjelsen i en enkelt dråbe, mulighed for at måle kumulative effekter og synergier, når fordøjelsesprocessen påføres sekventielt på det oprindelige grænsefladelag10. Sammensætningen af hvert fordøjelsesmedie kan let indstilles til at tage højde for de særlige forhold i fordøjelsesforholdene, herunder gastrointestinale patologier eller spædbarns fordøjelsesmedier14. Derefter kan identifikation af grænseflademekanismerne, der påvirker proteolyse og lipolyse, bruges til at modulere fordøjelsen ved grænsefladeteknik af emulsioner. De opnåede resultater kan anvendes til design af nye fødevarematricer med skræddersyede funktioner såsom lav allergenicitet, kontrolleret energiindtag og nedsat fordøjelighed 15,16,17,18,19.
Protocol
Representative Results
Discussion
Denne artikel beskriver en generaliseret protokol til måling af in vitro fordøjelse af grænsefladelag ved hjælp af vedhængsdråbeudstyr. Protokollen kan justeres til eksperimentets specifikke krav ved at indstille sammensætningen af fordøjelsesbufferne, som er baseret på INFOGEST11,20 harmoniseret protokol for at lette sammenligning med litteratur. Fordøjelsesenzymerne og biosurfactanterne kan tilsættes individuelt, sekventielt eller sammen. De…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Denne forskning blev finansieret af projekter RTI2018-101309-B-C21 og PID2020-631-116615RAI00, finansieret af MCIN/AEI/10.13039/501100011033 og af “EFRU A way of making Europe”. Dette arbejde blev (delvist) støttet af Biocolloid and Fluid Physics Group (ref. PAI-FQM115) ved Granada Universitet (Spanien).
Materials
| Alpha-chymotrypsin from bovine pancreas | Sigma-Aldrich | C4129 | Enzyme |
| Beta-lactoglobulin | Sigma-Aldrich | L0130 | Emulsfier |
| Bovine Serum Albumin | Sigma-Aldrich | 9048-46-8 | Emulsfier |
| CaCl2 | Sigma-Aldrich | 10043-52-4 | Electrolyte |
| Centrifuge | Kronton instruments | Centrikon T-124 | For separating oil and resins |
| Citrus pectin | Sigma-Aldrich | P9135 | Emulsfier |
| co-lipase FROM PORCINE PANCREAS | Sigma | C3028 | Enzyme |
| CONTACTO | University of Granada (UGR) | https://core.ugr.es/dinaten/, last access: 07/18/2022 | |
| DINATEN | University of Granada (UGR) | https://core.ugr.es/dinaten/, last access: 07/18/2022 | |
| Gastric lipase | Lipolytech | RGE15-1G | Enzyme |
| Human Serum Albumin | Sigma-Aldrich | 70024-90-7 | Emulsifier |
| INFOGEST | http://www.proteomics.ch/IVD/ | ||
| Lipase from porcine pancreas, type II | Sigma-Aldrich | L33126 | Enzyme |
| Magnesium metasilicate resins | Fluka | 1343-88-0 | Resins to purify oil |
| Micro 90 | International products | M-9051-04 | Cleaner |
| NaCl | Sigma | 7647-14-5 | Electrolyte |
| NaH2PO4 | Scharlau | 10049-21-5 | To prepare buffer |
| OCTOPUS | Producciones Científicas y Técnicas S.L. (Gójar, Spain) | Pendandt Drop Equipment implemented with multi subphase exchange | |
| Olive oil | Sigma-Aldrich | 1514 | oil |
| Pancreatic from porcine pancreas | Sigma | P7545-25 g | Enzyme |
| Pepsin | Sigma-Aldrich | P6887 | Enzyme |
| Pluronic F127 | Sigma | P2443 | Emulsifier |
| Pluronic F68 | Sigma | P1300 | Emulsfier |
| Sodium deoxycholate | Sigma | Bile salts | |
| Sodium glycodeoxycholate | Sigma | C9910 | Bile salts |
| Sodium taurocholate | Sigma | 86339 | Bile salts |
| Syringe Filter | Millex-DP | SLGP033R | Syringe Filter 0.22 µm pore size polyethersulfone |
| Trypsin | Sigma-Aldrich | T1426 | Enzyme |
Riferimenti
- McClements, D. J. The biophysics of digestion: Lipids. Current Opinion in Food Science. 21, 1-6 (2018).
- McClements, D. J., Li, Y. Structured emulsion-based delivery systems: Controlling the digestion and release of lipophilic food components. Advances in Colloid and Interface Science. 159 (2), 213-228 (2010).
- Corstens, M. N., et al. Food-grade micro-encapsulation systems that may induce satiety via delayed lipolysis: A review. Critical Reviews in Food Science and Nutrition. 57 (10), 2218-2244 (2017).
- Aguilera-Garrido, A., del Castillo-Santaella, T., Galisteo-González, F., Gálvez-Ruiz, M. J., Maldonado-Valderrama, J. Investigating the role of hyaluronic acid in improving curcumin bioaccessibility from nanoemulsions. Food Chemistry. 351, 129301 (2021).
- Rodríguez Patino, J. M., Carrera Sánchez, C., Rodríguez Niño, M. R. Implications of interfacial characteristics of food foaming agents in foam formulations. Advances in Colloid and Interface Science. 140 (2), 95-113 (2008).
- Wilde, P. J., Chu, B. S. Interfacial & colloidal aspects of lipid digestion. Advances in Colloid and Interface Science. 165 (1), 14-22 (2011).
- Cabrerizo-Vílchez, M. A., Wege, H. A., Holgado-Terriza, J. A., Neumann, A. W. Axisymmetric drop shape analysis as penetration Langmuir balance. Review of Scientific Instruments. 70 (5), 2438-2444 (1999).
- Maldonado-Valderrama, J., Muros-Cobos, J. L., Holgado-Terriza, J. A., Cabrerizo-Vílchez, M. A. Bile salts at the air-water interface: Adsorption and desorption. Colloids and surfaces B: Biointerfaces. 120, 176-183 (2014).
- Maldonado-Valderrama, J., Terriza, J. A. H., Torcello-Gómez, A., Cabrerizo-Vílchez, M. A. In vitro digestion of interfacial protein structures. Soft Matter. 9, 1043-1053 (2013).
- Maldonado-Valderrama, J. Probing in vitro digestion at oil-water interfaces. Current Opinion in Colloid and Interface Science. 39, 51-60 (2019).
- Brodkorb, A., et al. INFOGEST static in vitro simulation of gastrointestinal food digestion. Nature Protocols. 14 (4), 991-1014 (2019).
- del Castillo-Santaella, T., Maldonado-Valderrama, J., Molina-Bolivar, J. A., Galisteo-Gonzalez, F. Effect of cross-linker glutaraldehyde on gastric digestion of emulsified albumin. Colloids and Surfaces B: Biointerfaces. 145, 899-905 (2016).
- Macierzanka, A., Torcello-Gómez, A., Jungnickel, C., Maldonado-Valderrama, J. Bile salts in digestion and transport of lipids. Advances in Colloid and Interface Science. 274, 102045 (2019).
- Maldonado-Valderrama, J., Torcello-Gómez, A., del Castillo-Santaella, T., Holgado-Terriza, J. A., Cabrerizo-Vílchez, M. A. Subphase exchange experiments with the pendant drop technique. Advances in Colloid and Interface Science. 222, 488-501 (2015).
- Bellesi, F. A., Ruiz-Henestrosa, V. M. P., Maldonado-Valderrama, J., Del Castillo Santaella, T., Pilosof, A. M. R. Comparative interfacial in vitro digestion of protein and polysaccharide oil/water films. Colloids and Surfaces B: Biointerfaces. 161, 547-554 (2018).
- Del Castillo-Santaella, T., Sanmartín, E., Cabrerizo-Vílchez, M. A., Arboleya, J. C., Maldonado-Valderrama, J. Improved digestibility of β-lactoglobulin by pulsed light processing: A dilatational and shear study. Soft Matter. 10 (48), 9702-9714 (2014).
- Infantes-Garcia, M. R., et al. In vitro gastric lipid digestion of emulsions with mixed emulsifiers: Correlation between lipolysis kinetics and interfacial characteristics. Food Hydrocolloids. 128, 107576 (2022).
- del Castillo-Santaella, T., Cebrián, R., Maqueda, M., Gálvez-Ruiz, M. J., Maldonado-Valderrama, J. Assessing in vitro digestibility of food biopreservative AS-48. Food Chemistry. 246, 249-257 (2018).
- Torcello-Gómez, A., Maldonado-Valderrama, J., Jódar-Reyes, A. B., Cabrerizo-Vílchez, M. A., Martín-Rodríguez, A. Pluronic-covered oil-water interfaces under simulated duodenal conditions. Food Hydrocolloids. 34, 54-61 (2014).
- Minekus, M., et al. A standardised static in vitro digestion method suitable for food – an international consensus. Food & Function. 5 (6), 1113-1124 (2014).
- Wege, H. A., Holgado-Terriza, J. A., Cabrerizo-Vílchez, M. A. Development of a constant surface pressure penetration langmuir balance based on axisymmetric drop shape analysis. Journal of Colloid and Interface Science. 249 (2), 263-273 (2002).
- del Castillo-Santaella, T., et al. Hyaluronic acid and human/bovine serum albumin shelled nanocapsules: Interaction with mucins and in vitro digestibility of interfacial films. Food Chemistry. 383, 132330 (2022).
- Aguilera-Garrido, A., et al. Applications of serum albumins in delivery systems: Differences in interfacial behaviour and interacting abilities with polysaccharides. Advances in Colloid and Interface Science. 290 (5), 102365 (2021).

