Akış Sitometrisi ile Yaşlanan Tümör Hücrelerinin Tanımlanması ve Zenginleştirilmesi için Uzak Kırmızı Floresan Yaşlanma İlişkili β-Galaktosidaz Probu
Summary
Kemoterapi ilaçlarının hücre kültüründe veya murin tümör modellerinde indüklediği yaşlanan kanser hücrelerinin floresan, akım sitometrik nicelleştirilmesi için bir protokol sunulmuştur. İsteğe bağlı prosedürler arasında ko-immün boyama, büyük parti veya zaman noktası analizini kolaylaştırmak için numune fiksasyonu ve akış sitometrik sıralama ile canlı yaşlanan hücrelerin zenginleştirilmesi yer almaktadır.
Abstract
Hücresel yaşlanma, normalde yaşlanan hücrelerde yıllar içinde tahakkuk eden, ancak çeşitli kanser tedavilerinin neden olduğu hasara yanıt olarak tümör hücrelerinde hızla ortaya çıkabilen biyolojik hasarın neden olduğu proliferatif bir arrest durumudur. Tümör hücresi yaşlanması genellikle istenmeyen olarak kabul edilir, çünkü yaşlanan hücreler ölüme dirençli hale gelir ve tümör malignitesini ve tedavi direncini şiddetlendirirken tümör remisyonunu bloke eder. Bu nedenle, yaşlanan tümör hücrelerinin tanımlanması, kanser araştırma topluluğuna sürekli ilgi duymaktadır. Birçoğu iyi bilinen yaşlanma belirteci olan yaşlanma ile ilişkili beta-galaktosidaz (SA-β-Gal) aktivitesine dayanan çeşitli yaşlanma testleri mevcuttur.
Tipik olarak, SA-β-Gal testi, sabit hücreler üzerinde kromojenik bir substrat (X-Gal) kullanılarak, “mavi” yaşlanan hücrelerin ışık mikroskobu ile yavaş ve öznel sayımı ile gerçekleştirilir. C12-FDG (yeşil) ve DDAO-Galaktosid (DDAOG; uzak kırmızı) dahil olmak üzere hücre geçirgen, floresan SA-β-Gal substratları kullanılarak geliştirilmiş analizler, canlı hücrelerin analizini mümkün kıldı ve akış sitometreleri de dahil olmak üzere yüksek verimli floresan analiz platformlarının kullanılmasına izin verdi. C12-FDG, SA-β-Gal için iyi belgelenmiş bir probdur, ancak yeşil floresan emisyonu, lipofussin agregalarının birikmesi nedeniyle yaşlanma sırasında ortaya çıkan içsel hücresel otofloresan (AF) ile örtüşür. Uzak kırmızı SA-β-Gal probu DDAOG kullanılarak, yeşil hücresel otofloresan, yaşlanmayı doğrulamak için ikincil bir parametre olarak kullanılabilir ve tahlil için güvenilirlik katar. Kalan floresan kanallar, hücre canlılığı boyama veya isteğe bağlı floresan immünoetiketleme için kullanılabilir.
Akış sitometrisini kullanarak, yaşlanan tümör hücrelerinin tanımlanması için çift parametreli bir test olarak DDAOG ve lipofussin otofloresansının kullanımını gösteriyoruz. Canlı yaşlanan hücrelerin yüzdesinin kantitasyonu gerçekleştirilir. İstenirse, ilgilenilen hücre yüzey antijenlerini değerlendirmek için isteğe bağlı bir immünoetiketleme adımı eklenebilir. Tanımlanan yaşlanan hücreler ayrıca akış sitometrik olarak sıralanabilir ve aşağı akış analizi için toplanabilir. Toplanan yaşlanan hücreler hemen lize edilebilir (örneğin, immünotahliller veya ‘omik analizler için) veya daha fazla kültürlenebilir.
Introduction
Yaşlanan hücreler normalde normal biyolojik yaşlanma sırasında organizmalarda yıllar içinde birikir, ancak radyasyon ve kemoterapi de dahil olmak üzere çeşitli kanser tedavilerinin neden olduğu hasara yanıt olarak tümör hücrelerinde hızla gelişebilir. Artık çoğalmamasına rağmen, tedaviye bağlı yaşlanan (TIS) tümör hücreleri tedavi direncine katkıda bulunabilir ve nüksetmeyi tetikleyebilir 1,2,3. TIS hücreleri tarafından salgılanan faktörler, immün kaçamağı veya metastazı teşvik ederek tümör malignitesini şiddetlendirebilir 4,5. TIS hücreleri karmaşık, bağlama özgü fenotipler, değişmiş metabolik profiller ve benzersiz immün yanıtlar geliştirir 6,7,8. Bu nedenle, çeşitli kanser tedavisi yaklaşımları tarafından indüklenen TIS tümör hücrelerinin tanımlanması ve karakterizasyonu, kanser araştırma topluluğunun sürekli ilgi duyduğu bir konudur.
TIS tümör hücrelerini tespit etmek için, öncelikle yaşlanma belirteci enzimi lizozomal beta-galaktosidaz GLB19’un artan aktivitesini tespit etmeye dayanan geleneksel yaşlanma testleri yaygın olarak kullanılmaktadır. Nötre yakın (asidik değil) lizozomal pH’ta tespit, yaşlanma ile ilişkili beta-galaktosidaz (SA-β-Gal)10’un spesifik tespitine izin verir. Birkaç on yıldır kullanılan standart bir SA-β-Gal testi, ışık mikroskobu11 ile sabit hücrelerde SA-β-Gal’i tespit etmek için mavi bir kromojenik beta-galaktosidaz substratı olan X-Gal (5-bromo-4-kloro-3-indolil-β-D-galaktopiranosid) kullanır. X-Gal testi, yaygın olarak bulunan reaktifler ve laboratuvar ekipmanlarını kullanarak TIS’in kalitatif görsel doğrulamasını sağlar. Temel bir iletilen ışık mikroskobu, mavi kromojenin varlığını değerlendirmek için gereken tek enstrümantasyondur. Bununla birlikte, X-Gal boyama prosedürü hassasiyetten yoksun olabilir, bazen rengin gelişmesi için 24 saatten fazla zaman gerekir. Boyama, bir ışık mikroskobu altında mavi kromojen yoğunluğunun bir miktar seviyesini sergileyen hücrelerin sayılmasına dayanan bireysel yaşlanan hücrelerin düşük verimli, öznel skorlaması ile takip edilir. X-Gal hücre geçirimsiz olduğundan, bu tahlil, aşağı akış analizi için geri kazanılamayan çözücü sabit hücreler gerektirir. Hayvanlardan veya hastalardan sınırlı örneklerle çalışırken, bu büyük bir dezavantaj olabilir.
C 12-FDG (5-dodekanoylaminofluorescein Di-β-D-Galactopyranoside, yeşil) ve DDAOG (9H-(1,3-dichloro-9,9-dimethylacridin-2-one-7-yl) β-D-Galactopyranoside, far-red) dahil olmak üzere hücre geçirgen, floresan enzim substratları kullanılarak geliştirilmiş SA-β-Gal testleri daha önce literatür12,13,14,15’te ortaya çıkmıştır. DDAOG’un kimyasal prob yapısı ve optik özellikleri Ek Şekil S1’de gösterilmiştir. Bu hücre perkastlı problar, canlı (sabit değil) hücrelerin analizine izin verir ve kromojenik problar yerine floresan, yüksek içerikli tarama cihazları ve akış sitometreleri de dahil olmak üzere hızlı yüksek verimli floresan analiz platformlarının kullanımını kolaylaştırır. Akış sitometrelerinin sıralanması, aşağı akış analizi için hücre kültürlerinden veya tümörlerden (örneğin, batı lekelenmesi, ELISA veya ‘omikler) zenginleştirilmiş canlı yaşlanan hücre popülasyonlarının geri kazanılmasını sağlar. Floresan analizi ayrıca belirli bir numunedeki yaşlanan hücrelerin yüzdesinin daha doğru bir şekilde belirlenmesini sağlayan nicel bir sinyal sağlar. Canlılık probları ve florofor etiketli antikorlar dahil olmak üzere ek floresan problar, SA-β-Gal’in ötesindeki hedeflerin çoklanmış analizi için kolayca eklenebilir.
DDAOG’a benzer şekilde, C12-FDG, SA-β-Gal için bir floresan probdur, ancak yeşil floresan emisyonu,hücre 16’da lipofuscin agregalarının birikmesi nedeniyle yaşlanma sırasında ortaya çıkan içsel hücresel AF ile örtüşür. Uzak kırmızı DDAOG probu kullanılarak, yeşil hücresel AF, yaşlanma17’yi doğrulamak için ikincil bir parametre olarak kullanılabilir. Bu, yaşlanma18 için tek bir belirteç olarak genellikle güvenilmez olabilen SA-β-Gal’e ek olarak ikinci bir belirteç kullanarak tahlil güvenilirliğini artırır. Yaşlanan hücrelerde endojen AF’nin tespiti etiketsiz bir yaklaşım olduğundan, DDAOG tabanlı tahlilimizin özgüllüğünü genişletmenin hızlı ve basit bir yoludur.
Bu protokolde, DDAOG ve AF’nin, in vitro kültürlerden veya farelerde kurulan ilaçla tedavi edilen tümörlerden izole edilmiş canlı TIS tümör hücrelerinin tanımlanması için hızlı, çift parametreli bir akış sitometri testi olarak kullanımını gösteriyoruz (Şekil 1). Protokol, çok çeşitli standart ticari akış sitometri analizörleri ve ayıklayıcıları ile uyumlu floroforlar kullanır (Tablo 1). Standart akış sitometri analizi kullanılarak canlı yaşlanan hücrelerin yüzdesinin kantitasyonu sağlanır. İstenirse, yaşlanma ile eşzamanlı olarak ilgilenilen hücre yüzey antijenlerini değerlendirmek için isteğe bağlı bir immünoetiketleme adımı gerçekleştirilebilir. Tanımlanan yaşlanan hücreler, standart floresan aktive hücre sıralama (FACS) metodolojisi kullanılarak da zenginleştirilebilir.
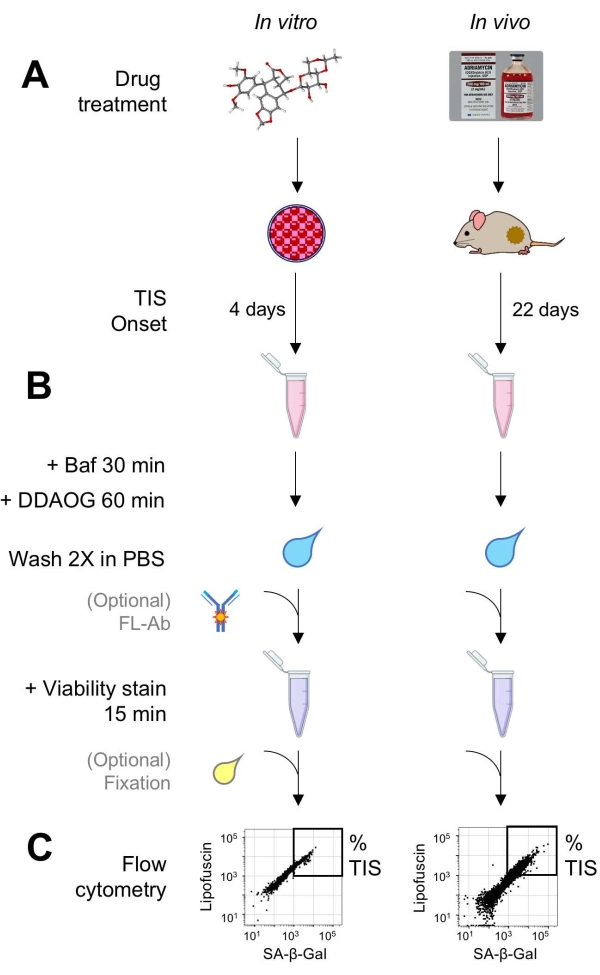
Şekil 1: Deneysel iş akışı. DDAOG testinin kilit noktalarını özetleyen şematik bir özetleme. (A) TIS’e neden olan bir ilaç, memeli kültürlü hücrelere eklenir veya tümör taşıyan farelere uygulanır. Daha sonra TIS’in başlangıcı için zamana izin verilir: hücreler için, tedaviden 4 gün sonra; fareler için, toplam 22 gün, her 5 günde bir üç tedavi artı 7 gün iyileşme. Hücreler toplanır veya tümörler süspansiyona ayrılır. (B) Numuneler, 30 dakika boyunca SA-β-Gal’in tespiti için lizozomal pH’ı ayarlamak üzere Baf ile muamele edilir; Daha sonra, SA-β-Gal’i tespit etmek için 60 dakika boyunca DDAOG probu eklenir. Numuneler PBS’de 2 kat yıkanır ve kısaca bir canlılık lekesi eklenir (15 dakika). İsteğe bağlı olarak, numuneler açık floresan kanallarında floresan antikorları ile boyanabilir ve / veya daha sonra analiz edilmek üzere sabitlenebilir. (C) Numuneler standart bir akış sitometresi kullanılarak analiz edilir. Canlı hücreler, yeşil otofloresansa (lipofussin) karşı kırmızı DDAOG (SA-β-Gal’i gösteren) gösteren nokta grafiklerinde görselleştirilir. TIS hücrelerinin yüzdesini belirlemek için bir kapı, işlenmemiş kontrol örneklerine dayanarak oluşturulur (gösterilmemiştir). Bir sıralama sitometresi (FACS) kullanılırsa, TIS hücreleri toplanabilir ve daha fazla in vitro tahlil için kültüre geri yerleştirilebilir veya moleküler biyoloji tahlilleri için lize edilebilir ve işlenebilir. Kısaltmalar: DDAO = 9H-(1,3-dikloro-9,9-dimetilakridin-2-one); DDAOG = DDAO-Galaktosit; TIS = tedaviye bağlı yaşlanma; FL-Ab = florofor konjuge antikor; Baf = Bafilomisin A1; SA-β-Gal = yaşlanma ile ilişkili beta-galaktosidaz; PBS = fosfat tamponlu salin; FACS = floresan ile aktive edilmiş hücre sıralama. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
| Florofor | Algı -lar | Eski/Em (nm) | Sitometre lazer (nm) | Sitometre dedektörü / bandpass filtresi (nm) |
| cesaret | SA-β-Gal | 645/6601 | 640 | 670 / 30 |
| AF | Lipofuscin (Lipofussin) | < 600 | 488 | 525 / 50 |
| CV450 Serisi | Canlılık | 408/450 | 405 | 450 / 50 |
| PE | Antikor/yüzey işaretleyici | 565/578 | 561 | 582 / 15 |
Tablo 1: Floroforlar ve sitometre optik özellikleri. Bu protokolde kullanılan sitometre özellikleri, toplam 4 lazer ve 15 emisyon dedektörü içeren bir cihaz için listelenmiştir. 645/660 nm’de tespit edilen DDAOG, SA-β-Gal1 tarafından parçalanan probun şeklidir. Amcalı DDAOG, 460/610 nm’de düşük seviyeli floresan gösterebilir, ancak protokoldeki yıkama adımlarıyla çıkarılır. Kısaltmalar: DDAO = 9H-(1,3-dikloro-9,9-dimetilakridin-2-one); DDAOG = DDAO-Galaktosit; AF = otofloresan; PE = fikoeritrin; SA-β-Gal = yaşlanma ile ilişkili beta-galaktosidaz.
Protocol
Representative Results
Discussion
Son on yılda, akış sitometrisi, tümör immünolojisinin ortaya çıkan popülaritesi, daha düşük maliyetli akış sitometrelerinin geliştirilmesi ve akademik kurumlarda paylaşılan enstrümantasyon tesislerinin iyileştirilmesi nedeniyle kanser araştırmalarında daha yaygın bir tahlil platformu haline gelmiştir. Çok renkli analizler artık standarttır, çünkü çoğu yeni enstrüman menekşe, mavi-yeşil ve kırmızıdan kırmızıya optik dizilerle donatılmıştır. Bu nedenle, bu DDAOG protokolünün ?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Chicago Üniversitesi’ndeki Sitometri ve Antikor Çekirdek Tesisi’ne akış sitometrisi enstrümantasyonu konusundaki desteği için teşekkür ederiz. Chicago Üniversitesi’ndeki Hayvan Araştırma Merkezi, hayvan barınağı sağladı.
Materials
| Bafilomycin A1 | Research Products International | B40500 | |
| Bleomycin sulfate | Cayman | 13877 | |
| Bovine serum albumin (BSA) | US Biological | A1380 | |
| Calcein Violet 450 AM viability dye | ThermoFisher Scientific | 65-0854-39 | eBioscience |
| DPP4 antibody, PE conjugate | Biolegend | 137803 | Clone H194-112 |
| Cell line: A549 human lung adenocarcinoma | American Type Culture Collection | CCL-185 | |
| Cell line: B16-F10 mouse melanoma | American Type Culture Collection | CRL-6475 | |
| Cell scraper | Corning | 3008 | |
| Cell strainers, 100 µm | Falcon | 352360 | |
| DDAO-Galactoside | Life Technologies | D6488 | |
| DMEM medium 1x | Life Technologies | 11960-069 | |
| DMSO | Sigma | D2438 | |
| DNAse I | Sigma | DN25 | |
| Doxorubicin, hydrochloride injection (USP) | Pfizer | NDC 0069-3032-20 | |
| Doxorubicin, PEGylated liposomal (USP) | Sun Pharmaceutical | NDC 47335-049-40 | |
| EDTA 0.5 M | Life Technologies | 15575-038 | |
| Etoposide | Cayman | 12092 | |
| FBS | Omega | FB-11 | |
| Fc receptor blocking reagent | Biolegend | 101320 | Anti-mouse CD16/32 |
| Flow cytometer (cell analyzer) | Becton Dickinson (BD) | Various | LSRFortessa |
| Flow cytometer (cell sorter) | Becton Dickinson (BD) | Various | FACSAria |
| GlutaMax 100x | Life Technologies | 35050061 | |
| HEPES 1 M | Lonza | BW17737 | |
| Liberase TL | Sigma | 5401020001 | Roche |
| Paraformaldehyde 16% | Electron Microscopy Sciences | 15710 | |
| Penicillin/Streptomycin 100x | Life Technologies | 15140122 | |
| Phosphate buffered saline (PBS) 1x | Corning | MT21031CV | Dulbecco's PBS (without calcium and magnesium) |
| Rainbow calibration particles, ultra kit | SpheroTech | UCRP-38-2K | 3.5-3.9 µm, 2E6/mL |
| RPMI-1640 medium 1x | Life Technologies | 11875-119 | |
| Sodium chloride 0.9% (USP) | Baxter Healthcare Corporation | 2B1324 | |
| Software for cytometer data acquisition, "FACSDiva" | Becton Dickinson (BD) | n/a | Contact BD for license |
| Software for cytometer data analysis, "FlowJo" | TreeStar | n/a | Contact TreeStar for license |
| Trypsin-EDTA 0.25% | Life Technologies | 25200-114 |
Riferimenti
- Saleh, T., Tyutyunyk-Massey, L., Gewirtz, D. A. Tumor cell escape from therapy-induced senescence as a model of disease recurrence after dormancy. Ricerca sul cancro. 79 (6), 1044-1046 (2019).
- Wang, B., Kohli, J., Demaria, M. Senescent cells in cancer therapy: friends or foes. Trends in Cancer. 6 (10), 838-857 (2020).
- Prasanna, P. G., et al. Therapy-induced senescence: Opportunities to improve anticancer therapy. Journal of the National Cancer Institute. 113 (10), 1285-1298 (2021).
- Velarde, M. C., Demaria, M., Campisi, J. Senescent cells and their secretory phenotype as targets for cancer therapy. Interdisciplinary Topics in Gerontology and Geriatrics. 38, 17-27 (2013).
- Ou, H. L., et al. Cellular senescence in cancer: from mechanisms to detection. Molecular Oncology. 15 (10), 2634-2671 (2021).
- Hernandez-Segura, A., Nehme, J., Demaria, M. Hallmarks of cellular senescence. Trends in Cell Biology. 28 (6), 436-453 (2018).
- Bojko, A., Czarnecka-Herok, J., Charzynska, A., Dabrowski, M., Sikora, E. Diversity of the senescence phenotype of cancer cells treated with chemotherapeutic agents. Cells. 8 (12), 1501 (2019).
- Mikuła-Pietrasik, J., Niklas, A., Uruski, P., Tykarski, A., Książek, K. Mechanisms and significance of therapy-induced and spontaneous senescence of cancer cells. Cellular and Molecular Life Sciences. 77 (2), 213-229 (2020).
- Lee, B. Y., et al. Senescence-associated beta-galactosidase is lysosomal beta-galactosidase. Aging cell. 5 (2), 187-195 (2006).
- Itahana, K., Itahana, Y., Dimri, G. P. Colorimetric detection of senescence-associated β galactosidase. Methods in Molecular Biology. 965, 143-156 (2013).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proceedings of the National Academy of Sciences of the United States of America. 92 (20), 9363-9367 (1995).
- Debacq-Chainiaux, F., Erusalimsky, J. D., Campisi, J., Toussaint, O. Protocols to detect senescence-associated beta-galactosidase (SA-betagal) activity, a biomarker of senescent cells in culture and in vivo. Nature Protocols. 4 (12), 1798-1806 (2009).
- Noppe, G., et al. Rapid flow cytometric method for measuring senescence associated beta-galactosidase activity in human fibroblasts. Cytometry A. 75 (11), 910-916 (2009).
- Tung, C. -. H., et al. In vivo imaging of β-galactosidase activity using far red fluorescent switch. Ricerca sul cancro. 64 (5), 1579-1583 (2004).
- Gong, H., et al. beta-Galactosidase activity assay using far-red-shifted fluorescent substrate DDAOG. Analytical Biochemistry. 386 (1), 59-64 (2009).
- Terman, A., Brunk, U. T. Lipofuscin: Mechanisms of formation and increase with age. APMIS. 106 (2), 265-276 (1998).
- Georgakopoulou, E. A., et al. Specific lipofuscin staining as a novel biomarker to detect replicative and stress-induced senescence. A method applicable in cryo-preserved and archival tissues. Aging. 5 (1), 37-50 (2013).
- Wang, B., Demaria, M. The quest to define and target cellular senescence in cancer. Ricerca sul cancro. 81 (24), 6087-6089 (2021).
- Appelbe, O. K., Zhang, Q., Pelizzari, C. A., Weichselbaum, R. R., Kron, S. J. Image-guided radiotherapy targets macromolecules through altering the tumor microenvironment. Molecular Pharmaceutics. 13 (10), 3457-3467 (2016).
- Maciorowski, Z., Chattopadhyay, P. K., Jain, P. Basic multicolor flow cytometry. Current Protocols in Immunology. 117, 1-38 (2017).
- Fan, Y., Cheng, J., Zeng, H., Shao, L. Senescent cell depletion through targeting BCL-family proteins and mitochondria. Frontiers in Physiology. 11, 593630 (2020).
- Kim, K. M., et al. Identification of senescent cell surface targetable protein DPP4. Genes and Development. 31 (15), 1529-1534 (2017).
- Flor, A. C., Kron, S. J. Lipid-derived reactive aldehydes link oxidative stress to cell senescence. Cell Death Discovery. 7 (9), 2366 (2016).
- Jochems, F., et al. The Cancer SENESCopedia: A delineation of cancer cell senescence. Cell reports. 36 (4), 109441 (2021).
- Fallah, M., et al. Doxorubicin and liposomal doxorubicin induce senescence by enhancing nuclear factor kappa B and mitochondrial membrane potential. Life Sciences. 232, 116677 (2019).
- Kasper, M., Barth, K. Bleomycin and its role in inducing apoptosis and senescence in lung cells – modulating effects of caveolin-1. Current Cancer Drug Targets. 9 (3), 341-353 (2009).
- Muthuramalingam, K., Cho, M., Kim, Y. Cellular senescence and EMT crosstalk in bleomycin-induced pathogenesis of pulmonary fibrosis-an in vitro analysis. Cell Biology International. 44 (2), 477-487 (2020).
- Flor, A. C., Wolfgeher, D., Wu, D., Kron, S. J. A signature of enhanced lipid metabolism, lipid peroxidation and aldehyde stress in therapy-induced senescence. Cell Death Discovery. 3, 17075 (2017).
- Burd, C. E., et al. Monitoring tumorigenesis and senescence in vivo with a p16(INK4a)-luciferase model. Cell. 152 (1-2), 340-351 (2013).
- Liu, J. Y., et al. Cells exhibiting strong p16 (INK4a) promoter activation in vivo display features of senescence. Proceedings of the National Academy of Sciences of the United States of America. 116 (7), 2603-2611 (2019).
- Wang, L., Lankhorst, L., Bernards, R. Exploiting senescence for the treatment of cancer. Nature Reviews Cancer. 22 (6), 340-355 (2022).
- Baek, K. -. H., Ryeom, S. Detection of oncogene-induced senescence in vivo. Methods in Molecular Biology. 1534, 185-198 (2017).
- González-Gualda, E., Baker, A. G., Fruk, L., Muñoz-Espín, D. A guide to assessing cellular senescence in vitro and in vivo. The FEBS Journal. 288 (1), 56-80 (2021).

