Sonda β-galattosidasi associata alla senescenza fluorescente Far-Red per l'identificazione e l'arricchimento delle cellule tumorali senescenti mediante citometria a flusso
Summary
Viene presentato un protocollo per la quantificazione fluorescente citometrica a flusso di cellule tumorali senescenti indotte da farmaci chemioterapici in colture cellulari o in modelli tumorali murini. Le procedure opzionali includono la co-immunocolorazione, la fissazione del campione per facilitare l’analisi di grandi lotti o punti temporali e l’arricchimento di cellule senescenti vitali mediante selezione citometrica a flusso.
Abstract
La senescenza cellulare è uno stato di arresto proliferativo indotto da un danno biologico che normalmente si accumula nel corso degli anni nelle cellule che invecchiano, ma può anche emergere rapidamente nelle cellule tumorali come risposta al danno indotto da vari trattamenti antitumorali. La senescenza delle cellule tumorali è generalmente considerata indesiderabile, poiché le cellule senescenti diventano resistenti alla morte e bloccano la remissione del tumore, esacerbando la malignità del tumore e la resistenza al trattamento. Pertanto, l’identificazione di cellule tumorali senescenti è di continuo interesse per la comunità di ricerca sul cancro. Esistono vari saggi di senescenza, molti basati sull’attività del noto marcatore di senescenza, la beta-galattosidasi associata alla senescenza (SA-β-Gal).
Tipicamente, il saggio SA-β-Gal viene eseguito utilizzando un substrato cromogenico (X-Gal) su cellule fisse, con l’enumerazione lenta e soggettiva delle cellule senescenti “blu” mediante microscopia ottica. Saggi migliorati che utilizzano substrati fluorescenti SA-β-Gal permeanti alle cellule, tra cui C12-FDG (verde) e DDAO-Galactoside (DDAOG; far-red), hanno permesso l’analisi di cellule viventi e consentito l’uso di piattaforme di analisi fluorescenti ad alto rendimento, compresi i citometri a flusso. C12-FDG è una sonda ben documentata per SA-β-Gal, ma la sua emissione fluorescente verde si sovrappone all’autofluorescenza cellulare intrinseca (AF) che si verifica durante la senescenza a causa dell’accumulo di aggregati lipofuscinici. Utilizzando la sonda SA-β-Gal DDAOG, l’autofluorescenza cellulare verde può essere utilizzata come parametro secondario per confermare la senescenza, aggiungendo affidabilità al test. I restanti canali di fluorescenza possono essere utilizzati per la colorazione della vitalità cellulare o per l’immunomarcatura fluorescente opzionale.
Utilizzando la citometria a flusso, dimostriamo l’uso di DDAOG e autofluorescenza lipofuscina come saggio a doppio parametro per l’identificazione di cellule tumorali senescenti. Viene eseguita la quantificazione della percentuale di cellule senescenti vitali. Se lo si desidera, può essere inclusa una fase di immunomarcatura opzionale per valutare gli antigeni di superficie cellulare di interesse. Le cellule senescenti identificate possono anche essere selezionate citometricamente a flusso e raccolte per l’analisi a valle. Le cellule senescenti raccolte possono essere immediatamente lisate (ad esempio, per saggi immunologici o analisi omiche) o ulteriormente coltivate.
Introduction
Le cellule senescenti normalmente si accumulano negli organismi nel corso degli anni durante il normale invecchiamento biologico, ma possono anche svilupparsi rapidamente nelle cellule tumorali come risposta ai danni indotti da vari trattamenti antitumorali, tra cui radiazioni e chemioterapia. Sebbene non siano più proliferanti, le cellule tumorali senescenti indotte dalla terapia (TIS) possono contribuire alla resistenza al trattamento e guidare la recidiva 1,2,3. I fattori secreti dalle cellule TIS possono esacerbare la malignità tumorale promuovendo l’evasione immunitaria o le metastasi 4,5. Le cellule TIS sviluppano fenotipi complessi e specifici del contesto, profili metabolici alterati e risposte immunitarie uniche 6,7,8. Pertanto, l’identificazione e la caratterizzazione delle cellule tumorali TIS indotte da vari approcci terapeutici del cancro è un argomento di continuo interesse per la comunità di ricerca sul cancro.
Per rilevare le cellule tumorali TIS, i saggi di senescenza convenzionali sono ampiamente utilizzati, principalmente basati sulla rilevazione di una maggiore attività dell’enzima marcatore di senescenza, la beta-galattosidasi lisosomiale GLB19. Il rilevamento a un pH lisosomiale quasi neutro (piuttosto che acido) consente il rilevamento specifico della beta-galattosidasi associata alla senescenza (SA-β-Gal)10. Un saggio standard SA-β-Gal che è stato utilizzato per diversi decenni utilizza X-Gal (5-bromo-4-cloro-3-indolil-β-D-galattopiranoside), un substrato cromogenico blu della beta-galattosidasi, per rilevare SA-β-Gal in cellule fisse mediante microscopia ottica11. Il test X-Gal consente la conferma visiva qualitativa di TIS utilizzando reagenti comunemente disponibili e apparecchiature di laboratorio. Un microscopio a luce trasmessa di base è l’unica strumentazione necessaria per valutare la presenza del cromogeno blu. Tuttavia, la procedura di colorazione X-Gal può mancare di sensibilità, a volte richiedendo più di 24 ore per lo sviluppo del colore. La colorazione è seguita da un punteggio soggettivo a basso rendimento delle singole cellule senescenti basato sul conteggio delle cellule che mostrano un certo livello di intensità del cromogeno blu al microscopio ottico. Poiché X-Gal è impermeabile alle cellule, questo test richiede celle fissate con solvente, che non possono essere recuperate per l’analisi a valle. Quando si lavora con campioni limitati di animali o pazienti, questo può essere un grosso svantaggio.
Saggi migliorati di SA-β-Gal utilizzando substrati enzimatici fluorescenti permeanti alle cellule, tra cui C 12-FDG (5-dodecanoylaminofluorescein Di-β-D-Galactopyranoside, verde) e DDAOG (9H-(1,3-dicloro-9,9-dimetilacridin-2-one-7-yl) β-D-Galactopyranoside, far-red) sono stati precedentemente pubblicati in letteratura12,13,14,15. La struttura chimica della sonda e le caratteristiche ottiche del DDAOG sono mostrate nella figura supplementare S1. Queste sonde cellulari consentono l’analisi di cellule viventi (piuttosto che fisse) e le sonde fluorescenti piuttosto che cromogeniche facilitano l’uso di piattaforme di analisi fluorescenti rapide ad alto rendimento, compresi strumenti di screening ad alto contenuto e citometri a flusso. I citometri a flusso di selezione consentono il recupero di popolazioni arricchite di cellule senescenti viventi da colture cellulari o tumori per l’analisi a valle (ad esempio, western blotting, ELISA o ‘omics). L’analisi della fluorescenza fornisce anche un segnale quantitativo, consentendo una determinazione più accurata della percentuale di cellule senescenti all’interno di un determinato campione. Ulteriori sonde fluorescenti, tra cui sonde di vitalità e anticorpi marcati con fluorofori, possono essere facilmente aggiunte per l’analisi multiplex di bersagli oltre SA-β-Gal.
Simile a DDAOG, C12-FDG è una sonda fluorescente per SA-β-Gal, ma la sua emissione fluorescente verde si sovrappone alla FA cellulare intrinseca, che si verifica durante la senescenza a causa dell’accumulo di aggregati di lipofuscina nelle cellule16. Utilizzando la sonda DDAOG rosso, la fibrillazione atriale cellulare verde può essere utilizzata come parametro secondario per confermare la senescenza17. Ciò migliora l’affidabilità del test utilizzando un secondo marcatore in aggiunta a SA-β-Gal, che spesso può essere inaffidabile come singolo marcatore per la senescenza18. Poiché la rilevazione della fibrillazione atriale endogena nelle cellule senescenti è un approccio label-free, è un modo rapido e semplice per espandere la specificità del nostro test basato su DDAOG.
In questo protocollo, dimostriamo l’uso di DDAOG e AF come test di citometria a flusso rapido e a doppio parametro per l’identificazione di cellule tumorali TIS vitali da colture in vitro o isolate da tumori trattati con farmaci stabiliti nei topi (Figura 1). Il protocollo utilizza fluorofori compatibili con un’ampia gamma di analizzatori e selezionatori di citometria a flusso commerciali standard (Tabella 1). È abilitata la quantificazione della percentuale di cellule senescenti vitali utilizzando l’analisi citometrica a flusso standard. Se lo si desidera, può essere eseguita una fase di immunomarcatura opzionale per valutare gli antigeni della superficie cellulare di interesse in concomitanza con la senescenza. Le cellule senescenti identificate possono anche essere arricchite utilizzando la metodologia standard di selezione cellulare attivata dalla fluorescenza (FACS).
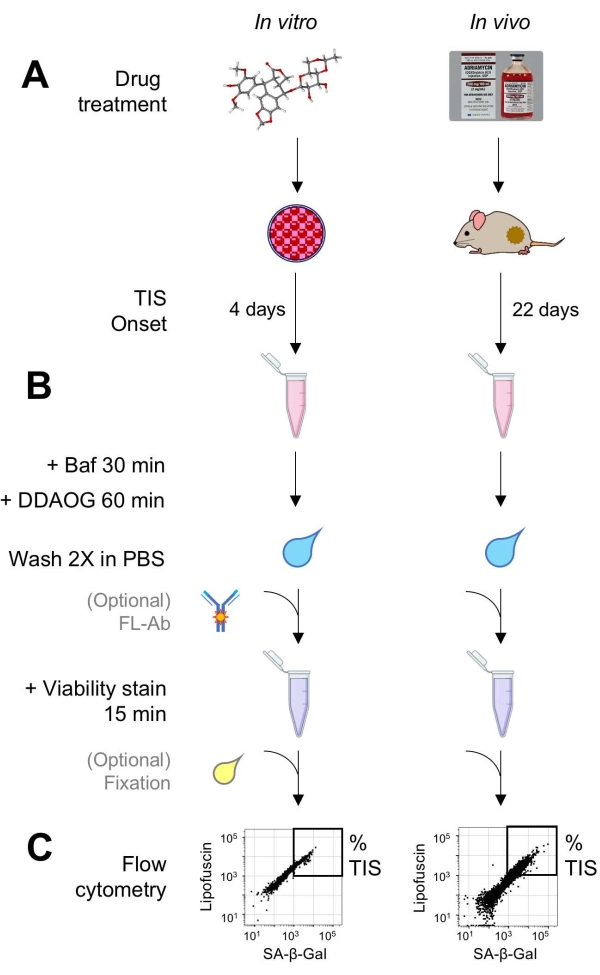
Figura 1: Flusso di lavoro sperimentale. Uno schema che riassume i punti chiave del test DDAOG. (A) Un farmaco che induce TIS viene aggiunto a cellule coltivate di mammiferi o somministrato a topi portatori di tumore. Il tempo è quindi concesso per l’insorgenza della TIS: per le cellule, 4 giorni dopo il trattamento; per i topi, 22 giorni totali, con tre trattamenti ogni 5 giorni più 7 giorni di recupero. Le cellule vengono raccolte o i tumori vengono dissociati in sospensione. (B) I campioni sono trattati con Baf per regolare il pH lisosomiale per la rilevazione di SA-β-Gal per 30 minuti; quindi, la sonda DDAOG viene aggiunta per 60 minuti per rilevare SA-β-Gal. I campioni vengono lavati 2 volte in PBS e viene aggiunta brevemente una macchia di vitalità (15 min). Opzionalmente, i campioni possono essere colorati con anticorpi fluorescenti in canali di fluorescenza aperti e/o fissati per analisi successive. (C) I campioni vengono analizzati utilizzando un citometro a flusso standard. Le cellule vitali sono visualizzate in grafici a punti che mostrano DDAOG rosso (che indica SA-β-Gal) rispetto all’autofluorescenza verde (lipofuscina). Un gate per determinare la percentuale di cellule TIS viene stabilito sulla base di campioni di controllo non trattati (non mostrati). Se viene utilizzato un citometro di selezione (FACS), le cellule TIS possono essere raccolte e rimesse in coltura per ulteriori test in vitro o lisate ed elaborate per saggi di biologia molecolare. Abbreviazioni: DDAO = 9H-(1,3-dicloro-9,9-dimetilacridina-2-one); DDAOG = DDAO-galattoside; TIS = senescenza indotta dalla terapia; FL-Ab = anticorpo coniugato con fluorofori; Baf = Bafilomicina A1; SA-β-Gal = beta-galattosidasi associata alla senescenza; PBS = soluzione salina tamponata fosfato; FACS = selezione cellulare attivata dalla fluorescenza. Fare clic qui per visualizzare una versione ingrandita di questa figura.
| Fluoroforo | Rileva | Ex/Em (nm) | Laser citometrico (nm) | Rilevatore citometrico / filtro passa banda (nm) |
| DDAOG | SA-β-Gal | 645/6601 | 640 | 670 / 30 |
| AF | Lipofuscina | < 600 | 488 | 525 / 50 |
| CV450 | Vitalità | 408/450 | 405 | 450 / 50 |
| PE | Marcatore anticorpo/superficie | 565/578 | 561 | 582 / 15 |
Tabella 1: Specifiche ottiche dei fluorofori e dei citometri. Le specifiche del citometro utilizzate in questo protocollo sono elencate per uno strumento con un totale di 4 laser e 15 rilevatori di emissioni. DDAOG rilevato a 645/660 nm è la forma della sonda scissa da SA-β-Gal1. DDAOG non scisso può presentare fluorescenza di basso livello a 460/610 nm, ma viene rimosso mediante fasi di lavaggio nel protocollo. Abbreviazioni: DDAO = 9H-(1,3-dicloro-9,9-dimetilacridina-2-one); DDAOG = DDAO-galattoside; AF = autofluorescenza; PE = ficoeritrina; SA-β-Gal = beta-galattosidasi associata alla senescenza.
Protocol
Representative Results
Discussion
Nell’ultimo decennio circa, la citometria a flusso è diventata una piattaforma di analisi più comune nella ricerca sul cancro a causa della popolarità emergente dell’immunologia tumorale, dello sviluppo di citometri a flusso a basso costo e del miglioramento delle strutture di strumentazione condivise presso le istituzioni accademiche. I saggi multicolore sono ora standard, poiché la maggior parte degli strumenti più recenti sono dotati di array ottici viola, blu-verde e da rosso a rosso lontano. Pertanto, questo pr…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Ringraziamo la Cytometry and Antibody Core Facility dell’Università di Chicago per il supporto sulla strumentazione di citometria a flusso. L’Animal Research Center dell’Università di Chicago ha fornito alloggi per animali.
Materials
| Bafilomycin A1 | Research Products International | B40500 | |
| Bleomycin sulfate | Cayman | 13877 | |
| Bovine serum albumin (BSA) | US Biological | A1380 | |
| Calcein Violet 450 AM viability dye | ThermoFisher Scientific | 65-0854-39 | eBioscience |
| DPP4 antibody, PE conjugate | Biolegend | 137803 | Clone H194-112 |
| Cell line: A549 human lung adenocarcinoma | American Type Culture Collection | CCL-185 | |
| Cell line: B16-F10 mouse melanoma | American Type Culture Collection | CRL-6475 | |
| Cell scraper | Corning | 3008 | |
| Cell strainers, 100 µm | Falcon | 352360 | |
| DDAO-Galactoside | Life Technologies | D6488 | |
| DMEM medium 1x | Life Technologies | 11960-069 | |
| DMSO | Sigma | D2438 | |
| DNAse I | Sigma | DN25 | |
| Doxorubicin, hydrochloride injection (USP) | Pfizer | NDC 0069-3032-20 | |
| Doxorubicin, PEGylated liposomal (USP) | Sun Pharmaceutical | NDC 47335-049-40 | |
| EDTA 0.5 M | Life Technologies | 15575-038 | |
| Etoposide | Cayman | 12092 | |
| FBS | Omega | FB-11 | |
| Fc receptor blocking reagent | Biolegend | 101320 | Anti-mouse CD16/32 |
| Flow cytometer (cell analyzer) | Becton Dickinson (BD) | Various | LSRFortessa |
| Flow cytometer (cell sorter) | Becton Dickinson (BD) | Various | FACSAria |
| GlutaMax 100x | Life Technologies | 35050061 | |
| HEPES 1 M | Lonza | BW17737 | |
| Liberase TL | Sigma | 5401020001 | Roche |
| Paraformaldehyde 16% | Electron Microscopy Sciences | 15710 | |
| Penicillin/Streptomycin 100x | Life Technologies | 15140122 | |
| Phosphate buffered saline (PBS) 1x | Corning | MT21031CV | Dulbecco's PBS (without calcium and magnesium) |
| Rainbow calibration particles, ultra kit | SpheroTech | UCRP-38-2K | 3.5-3.9 µm, 2E6/mL |
| RPMI-1640 medium 1x | Life Technologies | 11875-119 | |
| Sodium chloride 0.9% (USP) | Baxter Healthcare Corporation | 2B1324 | |
| Software for cytometer data acquisition, "FACSDiva" | Becton Dickinson (BD) | n/a | Contact BD for license |
| Software for cytometer data analysis, "FlowJo" | TreeStar | n/a | Contact TreeStar for license |
| Trypsin-EDTA 0.25% | Life Technologies | 25200-114 |
Riferimenti
- Saleh, T., Tyutyunyk-Massey, L., Gewirtz, D. A. Tumor cell escape from therapy-induced senescence as a model of disease recurrence after dormancy. Ricerca sul cancro. 79 (6), 1044-1046 (2019).
- Wang, B., Kohli, J., Demaria, M. Senescent cells in cancer therapy: friends or foes. Trends in Cancer. 6 (10), 838-857 (2020).
- Prasanna, P. G., et al. Therapy-induced senescence: Opportunities to improve anticancer therapy. Journal of the National Cancer Institute. 113 (10), 1285-1298 (2021).
- Velarde, M. C., Demaria, M., Campisi, J. Senescent cells and their secretory phenotype as targets for cancer therapy. Interdisciplinary Topics in Gerontology and Geriatrics. 38, 17-27 (2013).
- Ou, H. L., et al. Cellular senescence in cancer: from mechanisms to detection. Molecular Oncology. 15 (10), 2634-2671 (2021).
- Hernandez-Segura, A., Nehme, J., Demaria, M. Hallmarks of cellular senescence. Trends in Cell Biology. 28 (6), 436-453 (2018).
- Bojko, A., Czarnecka-Herok, J., Charzynska, A., Dabrowski, M., Sikora, E. Diversity of the senescence phenotype of cancer cells treated with chemotherapeutic agents. Cells. 8 (12), 1501 (2019).
- Mikuła-Pietrasik, J., Niklas, A., Uruski, P., Tykarski, A., Książek, K. Mechanisms and significance of therapy-induced and spontaneous senescence of cancer cells. Cellular and Molecular Life Sciences. 77 (2), 213-229 (2020).
- Lee, B. Y., et al. Senescence-associated beta-galactosidase is lysosomal beta-galactosidase. Aging cell. 5 (2), 187-195 (2006).
- Itahana, K., Itahana, Y., Dimri, G. P. Colorimetric detection of senescence-associated β galactosidase. Methods in Molecular Biology. 965, 143-156 (2013).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proceedings of the National Academy of Sciences of the United States of America. 92 (20), 9363-9367 (1995).
- Debacq-Chainiaux, F., Erusalimsky, J. D., Campisi, J., Toussaint, O. Protocols to detect senescence-associated beta-galactosidase (SA-betagal) activity, a biomarker of senescent cells in culture and in vivo. Nature Protocols. 4 (12), 1798-1806 (2009).
- Noppe, G., et al. Rapid flow cytometric method for measuring senescence associated beta-galactosidase activity in human fibroblasts. Cytometry A. 75 (11), 910-916 (2009).
- Tung, C. -. H., et al. In vivo imaging of β-galactosidase activity using far red fluorescent switch. Ricerca sul cancro. 64 (5), 1579-1583 (2004).
- Gong, H., et al. beta-Galactosidase activity assay using far-red-shifted fluorescent substrate DDAOG. Analytical Biochemistry. 386 (1), 59-64 (2009).
- Terman, A., Brunk, U. T. Lipofuscin: Mechanisms of formation and increase with age. APMIS. 106 (2), 265-276 (1998).
- Georgakopoulou, E. A., et al. Specific lipofuscin staining as a novel biomarker to detect replicative and stress-induced senescence. A method applicable in cryo-preserved and archival tissues. Aging. 5 (1), 37-50 (2013).
- Wang, B., Demaria, M. The quest to define and target cellular senescence in cancer. Ricerca sul cancro. 81 (24), 6087-6089 (2021).
- Appelbe, O. K., Zhang, Q., Pelizzari, C. A., Weichselbaum, R. R., Kron, S. J. Image-guided radiotherapy targets macromolecules through altering the tumor microenvironment. Molecular Pharmaceutics. 13 (10), 3457-3467 (2016).
- Maciorowski, Z., Chattopadhyay, P. K., Jain, P. Basic multicolor flow cytometry. Current Protocols in Immunology. 117, 1-38 (2017).
- Fan, Y., Cheng, J., Zeng, H., Shao, L. Senescent cell depletion through targeting BCL-family proteins and mitochondria. Frontiers in Physiology. 11, 593630 (2020).
- Kim, K. M., et al. Identification of senescent cell surface targetable protein DPP4. Genes and Development. 31 (15), 1529-1534 (2017).
- Flor, A. C., Kron, S. J. Lipid-derived reactive aldehydes link oxidative stress to cell senescence. Cell Death Discovery. 7 (9), 2366 (2016).
- Jochems, F., et al. The Cancer SENESCopedia: A delineation of cancer cell senescence. Cell reports. 36 (4), 109441 (2021).
- Fallah, M., et al. Doxorubicin and liposomal doxorubicin induce senescence by enhancing nuclear factor kappa B and mitochondrial membrane potential. Life Sciences. 232, 116677 (2019).
- Kasper, M., Barth, K. Bleomycin and its role in inducing apoptosis and senescence in lung cells – modulating effects of caveolin-1. Current Cancer Drug Targets. 9 (3), 341-353 (2009).
- Muthuramalingam, K., Cho, M., Kim, Y. Cellular senescence and EMT crosstalk in bleomycin-induced pathogenesis of pulmonary fibrosis-an in vitro analysis. Cell Biology International. 44 (2), 477-487 (2020).
- Flor, A. C., Wolfgeher, D., Wu, D., Kron, S. J. A signature of enhanced lipid metabolism, lipid peroxidation and aldehyde stress in therapy-induced senescence. Cell Death Discovery. 3, 17075 (2017).
- Burd, C. E., et al. Monitoring tumorigenesis and senescence in vivo with a p16(INK4a)-luciferase model. Cell. 152 (1-2), 340-351 (2013).
- Liu, J. Y., et al. Cells exhibiting strong p16 (INK4a) promoter activation in vivo display features of senescence. Proceedings of the National Academy of Sciences of the United States of America. 116 (7), 2603-2611 (2019).
- Wang, L., Lankhorst, L., Bernards, R. Exploiting senescence for the treatment of cancer. Nature Reviews Cancer. 22 (6), 340-355 (2022).
- Baek, K. -. H., Ryeom, S. Detection of oncogene-induced senescence in vivo. Methods in Molecular Biology. 1534, 185-198 (2017).
- González-Gualda, E., Baker, A. G., Fruk, L., Muñoz-Espín, D. A guide to assessing cellular senescence in vitro and in vivo. The FEBS Journal. 288 (1), 56-80 (2021).

