세포외 소포 하위 집합 분석을 위한 Multiplexed Surface Plasmon Resonance Imaging Chip의 다중 모드 분석 플랫폼
Summary
이 논문은 세포외 소포 하위 집합의 특성화를 위해 처리량이 증가한 차세대 다중 매개변수 분석 플랫폼을 제안합니다. 이 방법은 마이크로어레이 바이오칩에 갇힌 소포 표적을 검증하기 위해 원자력 현미경에 의한 도량형 및 형태역학적 분석과 라만 분광법의 결합을 기반으로 합니다.
Abstract
세포외 소포(EV)는 직경이 50나노미터에서 수백 나노미터에 이르는 모든 세포에서 생성되는 막 유래의 작은 소포이며 세포 간 통신 수단으로 사용됩니다. 그들은 다양한 질병에 대한 유망한 진단 및 치료 도구로 부상하고 있습니다. 크기, 구성 및 함량이 다른 EV를 생산하기 위해 세포가 사용하는 두 가지 주요 생물 발생 과정이 있습니다. 크기, 구성 및 세포 기원이 매우 복잡하기 때문에 특성 분석에는 분석 기술의 조합이 필요합니다. 이 프로젝트에는 EV의 하위 집단 특성화를 위한 처리량이 증가한 차세대 다중모수 분석 플랫폼의 개발이 포함됩니다. 이 목표를 달성하기 위해 이 작업은 그룹이 구축한 나노바이오 분석 플랫폼(NBA)에서 시작되며, 이를 통해 마이크로어레이 바이오칩에 갇힌 소포 표적의 원자력 현미경(AFM)에 의한 도량형 및 형태역학적 분석과 다중화된 생체 감지 방법의 조합을 기반으로 EV에 대한 독창적인 조사를 수행할 수 있습니다. 목표는 라만 분광법에 의한 표현형 및 분자 분석으로 이 EV 조사를 완료하는 것이었습니다. 이러한 개발을 통해 임상적 잠재력이 있는 생물학적 유체에서 EV 하위 집합을 구별하기 위한 다중 모드의 사용하기 쉬운 분석 솔루션을 제안할 수 있습니다
Introduction
진단 및 치료제 1,2,3,4,5에 대한 EV 연구에 대한 관심이 증가함에 따라 이 분야가 직면한 과제와 함께 이러한 소포를 정량화하거나 특성화하기 위한 다양한 접근 방식과 기술이 개발 및 구현되었습니다. EV 식별에 가장 널리 사용되는 방법은 EV의 기원을 확인하기 위한 단백질 특이적 면역블로팅 및 단백질체학, 구조를 확인하기 위한 투과 전자 현미경(TEM), 샘플 부피에서 EV의 수와 크기 분포를 정량화하기 위한 나노입자 추적 분석(NTA)입니다.
그러나 이러한 기술 중 어느 것도 자체적으로 EV 하위 집합을 특성화하는 데 필요한 모든 정보를 제공하지 않습니다. 생화학적 및 물리적 특성의 다양성으로 인한 EV의 고유한 이질성은 특히 혼합물(원유 샘플)에 포함된 EV의 경우 신뢰할 수 있고 재현 가능한 글로벌 분석을 방해합니다. 따라서 검출 및 특성화 방법은 EV에 개별적으로 그리고 일반적으로 더 빠르지만 선택적이지 않은 다른 방법을 보완하는 데 필요합니다6.
TEM(또는 cryoTEM) 또는 AFM에 의한 고해상도 이미징을 통해 나노미터 분해능 7,8,9,10,11,12로 EV의 형태 및 계측을 측정할 수 있습니다. 그러나 EV와 같은 생물학적 물체에 대한 전자 현미경 사용의 주요 한계는 샘플의 고정 및 탈수가 필요한 연구를 수행하기 위해 진공이 필요하다는 것입니다. 이러한 준비는 관찰된 구조에서 용액 내 EV 형태로 변환하는 것을 어렵게 만듭니다. 이러한 시료의 탈수를 피하기 위해, cryoTEM의 기술은 EV 특성화에 가장 적합하다(13). EV의 미세 구조를 결정하는 데 널리 사용됩니다. 생체 기능화된 금 나노입자에 의한 소포의 면역 표지는 또한 EV의 특정 하위 집단을 식별하고 복잡한 생물학적 샘플에 존재하는 다른 입자와 구별하는 것을 가능하게 합니다. 그러나 전자 현미경으로 분석하는 EV의 수가 적기 때문에 복잡하고 이질적인 샘플을 대표하는 특성화를 수행하기 어려운 경우가 많습니다.
이러한 크기의 이질성을 밝히기 위해 ISEV(International Society for Extracellular Vesicles)는 더 작은 이미지와 함께 충분한 수의 광시야 이미지를 분석하여 고해상도14의 개별 EV를 밝힐 것을 제안합니다. AFM은 EV 연구를 위한 광학 접근 방식 및 전자 회절 기술의 대안입니다. 이 기술은 하나의 지지대에 증착된 샘플을 한 줄씩 스캔하고 피드백 루프를 통해 존재하는 요소와 팁 사이의 거리를 조정하는 유연한 캔틸레버로 고정된 날카로운 팁을 사용합니다. 이를 통해 샘플의 지형을 특성화하고 형태역학적 정보(15,16,17,18)를 수집할 수 있습니다. EV는 원자적으로 평평한 기판에 증착된 후 또는 항체, 펩티드 또는 앱타머에 의해 기능화된 특정 기판 상에 포획된 후 AFM에 의해 스캔되어 다양한 하위 집단을 특성화할 수 있다(18,19). 전처리, 라벨링 또는 탈수 없이 복잡한 생물학적 시료 내에서 EV의 구조, 생체역학 및 막 생체 분자 함량을 정량화하고 동시에 조사할 수 있는 능력으로 인해 AFM은 이제 온도 및 매체의 생리학적 조건에서 미세하고 다중모수적인 방식으로 EV를 특성화하는 데 점점 더 많이 사용되고 있습니다.
본 논문은 다중화 형태로 (생)화학적으로 기능화할 수 있는 핵심 금 바이오칩을 이용한 방법론을 제안한다. 이 기판은 표면 플라즈몬 공명에 의한 EV 하위 집합의 생체 검출을 결합한 강력한 분석 플랫폼의 초석이며, EV가 칩에 흡착/이식 또는 면역포획되면 AFM은 EV의 도량형 및 형태역학적 특성화를 가능하게 합니다. 칩에 캡처된 EV 하위 집합의 라만 시그니처와 결합된 이 분석 플랫폼을 사용하면 사전 분석 단계 없이 라벨이 없는 방식으로 생물학적 샘플에 존재하는 EV를 검증할 수 있습니다. 이 백서는 기판 준비 및 데이터 수집에서 매우 엄격한 방법론의 도움을 받는 강력한 기술의 조합이 EV 분석을 심층적이고 확실하며 강력하게 만든다는 것을 보여줍니다.
제안된 접근 방식의 원리는 금 기판을 준비하고, EV 아형을 흡착/접목 또는 포획하고, AFM으로 스캔하여 각 EV 하위 집합의 크기와 형태를 추정하는 것입니다. 또한 흡착된 EV는 라만 분광법으로 분석됩니다. 이 기판은 실제로 복잡성이 증가하는 세 가지 유형의 인터페이스, 즉 네이키드, 화학적으로 기능화된 또는 리간드 마이크로어레이를 나타낼 수 있습니다. 프로토콜의 여러 단계를 설명하기 전에 독자는 표면 플라즈몬 공명 영상(SPRi), AFM 및 분광법을 결합한 그림 1의 나노바이오 분석 플랫폼(NBA) 접근 방식의 개략도를 참조합니다.
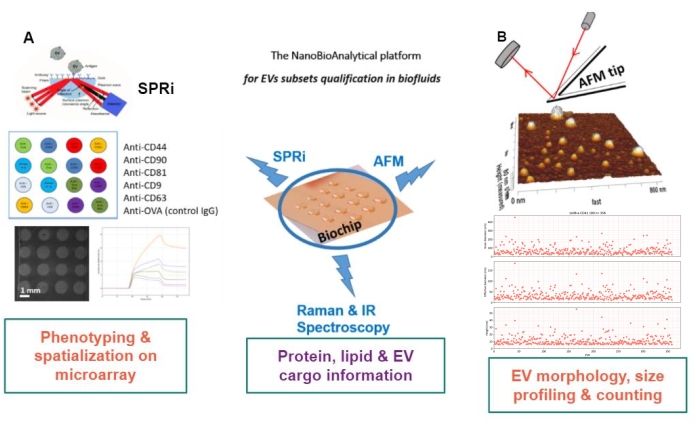
그림 1 : NanoBioAnalytical 플랫폼. 이 접근 방식은 (A) 표면 플라즈몬 공명 영상, (B) 원자력 현미경 및 적외선/라만(나노) 분광법을 결합하며, 모두 동일한 기판(다중화된 금 칩)에 결합됩니다. 약어: NBA = NanoBioAnalytical platform; SPRi = 표면 플라즈몬 공명 영상; AFM = 원자력 현미경; EV = 세포외 소포체. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
핵심 금 바이오칩은 모든 무표지 특성화 기술이 이 바이오칩에서 수행되기 때문에 플랫폼의 핵심을 구성합니다. EV 특성화(글로벌/전체 EV 또는 EV 하위 집합)의 요구와 사용된 방법의 한계/요구에 따라 세 가지 유형의 금 바이오칩 표면이 개발되었습니다: “네이키드”, 화학적으로 기능화된 “C11/C16” 또는 “리간드” 금 표면이라고 하는 리간드 생체 기능화.
“네이키드(naked)”라고 불리는 네이키드 바이오칩은 금에 EV를 간단하게 흡착할 수 있습니다. 사용되는 완충액을 선택하고 수동적 인 방법 (배양 후 헹굼 단계)으로 또는 흐름 (SPRi)에서 모니터링하여이 흡착을 실현할 수 있습니다. 또한, 이 수동 흡착은 전체 칩(매크로어레이)에서 실현되거나 마이크로피펫 스포터를 사용하여 마이크로어레이에 국한될 수 있습니다. “언더 플로우 절차”를 통해 조사관은 동역학과 EV 흡착 수준을 추적할 수 있습니다. 네이키드 골드 기판에 대한 이러한 접근 방식은 화학층 계면이 분석 방법(예: 라만 분광법)을 방해할 수 있을 때 채택됩니다.
“C11/C16“이라고 하는 화학적으로 기능화된 바이오칩은 EV 샘플에 대한 글로벌 관점을 갖는 것이 목적일 때 티올레이트와 1차 아미드 결합을 형성하여 금 표면에 공유 결합된 EV의 조밀하고 견고한 “카펫”을 만드는 데 사용됩니다. 실제로, 이 경우, 금은 메르캅토-1-운데칸올(11-MUOH: “C11”) 및 메르캅토-1-헥사데칸산(16-MHA: “C16”)의 티올레이트 혼합물에 의해 기능화되고, 티올레이트의 분획은 화학적으로 활성화되어 표적과의 공유 결합을 확립한다. 다시 말하지만, 이 전략은 수동적으로(“매크로어레이” 또는 마이크로피펫 스포터를 사용하는 여러 마이크로어레이에서 배양 후 헹굼 단계) 또는 유속(SPRi)에서 실현되어 금 표면의 EV 접목 및 동역학 수준을 따를 수 있습니다.
“리간드“라고 하는 리간드 생체 기능화 바이오칩은 화학적으로 활성화되어 서로 다른 리간드(예: 항체, 수용체)를 공유 접목하여 생물학적 샘플에 공존하는 서로 다른 EV 하위 집합을 선택적으로 (친화도로) 캡처합니다.
Protocol
Representative Results
Discussion
최근 가장 널리 사용되고 있는 EV 식별 방법은 EV의 기원을 확인하기 위한 단백질 특이적 면역블롯팅(Immunoblotting), EV의 구조를 확인하기 위한 TEM, 샘플 부피에서 EV의 수와 크기 분포를 정량화하기 위한 NTA입니다3. 그럼에도 불구하고 (생물)의학 연구에서 EV에 대한 높은 관심과 기존 분석 도구의 한계로 인해 과학계는 EV 특성화, 차별 및 정량화를 위한 새로운 방법을 개발하게 되었?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
IVETh 핵심 시설(파리)의 Kelly Aubertin과 Fabien Picot는 라만 이미징 실험으로 인정받고 있습니다. 티에리 부르노프(Thierry Burnouf, 대만 타이베이 의과대학)와 주자나 크루포바(Zuzana Krupova, 프랑스 헬린쿠르 출신)는 각각 혈소판과 소 우유 샘플에서 추출한 EV 샘플을 제공한 것으로 인정받고 있습니다. 이 작업은 Bourgogne Franche-Comté 지역과 EUR EIPHI 대학원(NOVICE 프로젝트, 2021-2024)의 지원을 받았습니다. 이 작업의 일부는 CLIPP 플랫폼과 FEMTO-ENGINEERING의 RENATECH 클린룸 시설에서 수행되었으며, 이에 대해 Rabah Zeggari에게 감사드립니다.
Materials
| CD41a antibody | Diaclone SAS (France) | 447528 | |
| CP920 | Microparticles GmbH, Germany | 448303 | |
| DXR3xi | Thermo Fisher Scientific | T1502 | |
| EDC | Sigma | A6272 | |
| Ethanolamine | Sigma | P5368-10PAK | |
| Evs derived from platelet concentrates | Collaboration : Pr T. Burnouf (TMU, Taipei) | S2889 | |
| Evs from bovine milk | Collaboration : Dr Z. Krupova (Excilone, Helincourt – France) | 3450 | |
| Glutaraldehyde | Sigma | 56845 | |
| Gwyddion | 853.223.020 | ||
| Magnetron sputtering | PLASSYS | SAB5300165 | |
| mercapto-1-hexadecanoic acid | Sigma | G5882 | |
| Mercapto-1-undecanol | Sigma | O8001 | |
| Mountains SPIP ones | Digital Surf | ||
| NanoWizard 3 Bioscience | Bruker-JPK | ||
| Octyl Glucoside (OG) | Sigma | ||
| Ovalbumine antibody | Sigma | ||
| Phosphate Buffer Saline (PBS) | Sigma | ||
| Rat Albumin Serum (RSA) | Sigma | ||
| Sodium acetate buffer | Sigma | ||
| SPR-Biacore 3000 | GE Healthcare/ Cytiva life sciences | ||
| SPRi Biochip | MIMENTO technology platform | The biochips were produced in-house in the clean room, Besancon | |
| SPRi Plex II | Horiba Scientific | ||
| Sulfo-NHS | Sigma |
Riferimenti
- Silva, A. K. A., et al. Development of extracellular vesicle-based medicinal products: A position paper of the group "Extracellular Vesicle translatiOn to clinicaL perspectiVEs – EVOLVE France". Advanced Drug Delivery Reviews. 179, 114001 (2021).
- Xunian, Z., Kalluri, R. Biology and therapeutic potential of mesenchymal stem cell-derived exosomes. Cancer Science. 111 (9), 3100-3110 (2020).
- Hartjes, T. A., et al. Extracellular vesicle quantification and characterization: Common methods and emerging approaches. Bioingegneria. 6 (1), 7 (2019).
- Xing, Y., et al. Analysis of extracellular vesicles as emerging theranostic nanoplatforms. Coordination Chemistry Reviews. 424, 213506 (2020).
- Wang, T., Xing, Y., Cheng, Z., Yu, F. Analysis of single extracellular vesicles for biomedical applications with especial emphasis on cancer investigations. Trends in Analytical Chemistry. 152, 116604 (2022).
- Boireau, W., Elie-Caille, C. Extracellular vesicles: Definition, isolation and characterization. Medecine Sciences: M/S. 37 (12), 1092-1100 (2021).
- Brisson, A. R., et al. Extracellular vesicles from activated platelets: A semiquantitative cryo-electron microscopy and immuno-gold labeling study. Platelets. 28 (3), 263-271 (2017).
- Yuana, Y., et al. Atomic force microscopy: A novel approach to the detection of nanosized blood microparticles. Journal of Thrombosis and Haemostasis. 8 (2), 315-323 (2010).
- Sebaihi, N., de Boeck, B., Yuana, Y., Nieuwland, R., Pétry, J. Dimensional characterization of extracellular vesicles using atomic force microscopy. Measurement Science and Technology. 28 (3), 034006 (2017).
- Beekman, P., et al. Immuno-capture of extracellular vesicles for individual multi-modal characterization using AFM, SEM and Raman spectroscopy. Lab on a Chip. 19 (15), 2526-2536 (2019).
- Malenica, M., et al. Perspectives of microscopy methods for morphology characterisation of extracellular vesicles from human biofluids. Biomedicines. 9 (6), 603 (2021).
- Verweij, F. J., et al. The power of imaging to understand extracellular vesicle biology in vivo. Nature Methods. 18 (9), 1013-1026 (2021).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): A position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Obeid, S., et al. NanoBioAnalytical characterization of extracellular vesicles in 75-nm nanofiltered human plasma for transfusion: A tool to improve transfusion safety. Nanomedicine: Nanotechnology, Biology, and Medicine. 20, 101977 (2019).
- Obeid, S., et al. Development of a NanoBioAnalytical platform for «on-chip» qualification and quantification of platelet-derived microparticles. Biosensors and Bioelectronics. 93, 250-259 (2017).
- Ridolfi, A., et al. AFM-based high-throughput nanomechanical screening of single extracellular vesicles. Analytical Chemistry. 92 (15), 10274-10282 (2020).
- Vorselen, D., et al. The fluid membrane determines mechanics of erythrocyte extracellular vesicles and is softened in hereditary spherocytosis. Nature Communications. 9 (1), 4960 (2018).
- Hardij, J., et al. Characterisation of tissue factor bearing extracellular vesicles with AFM: Comparison of air-tapping-mode AFM and liquid Peak Force AFM. Journal of Extracellular Vesicles. 2, 21045 (2013).
- Jorgensen, M., et al. Extracellular Vesicle (EV) Array: Microarray capturing of exosomes and other extracellular vesicles for multiplexed phenotyping. Journal of Extracellular Vesicles. 2, 20920 (2013).
- Remy-Martin, F., et al. Surface plasmon resonance imaging in arrays coupled with mass spectrometry (SUPRA-MS): Proof of concept of on-chip characterization of a potential breast cancer marker in human plasma. Analytical and Bioanalytical Chemistry. 404 (2), 423-432 (2012).
- Czamara, K., et al. Raman spectroscopy of lipids: A review. Journal of Raman Spectroscopy. 46 (1), 4-20 (2015).
- Penders, J., et al. Single particle automated Raman trapping analysis of breast cancer cell-derived extracellular vesicles as cancer biomarkers. ACS Nano. 15 (11), 18192-18205 (2021).
- Baek, S. J., Park, A., Ahn, Y. J., Choo, J. Baseline correction using asymmetrically reweighted penalized least squares smoothing. Analyst. 140 (1), 250-257 (2015).
- Daaboul, G. G., et al. Digital detection of exosomes by interferometric imaging. Scientific Reports. 6, 37246 (2016).
- Ertsgaard, C. T., et al. Integrated nanogap platform for sub-volt dielectrophoretic trapping and real-time Raman imaging of biological nanoparticles. Nano Letters. 18 (9), 5946-5953 (2018).
- Maas, S. L., et al. Possibilities and limitations of current technologies for quantification of biological extracellular vesicles and synthetic mimics. Journal of Controlled Release. 200, 87-96 (2015).

