Multimodaal analytisch platform op een multiplexed surface plasmon resonance imaging chip voor de analyse van extracellulaire vesikel subsets
Summary
Dit artikel stelt een nieuwe generatie multiparametrische analytische platforms voor met een verhoogde doorvoer voor de karakterisering van extracellulaire vesikelsubsets. De methode is gebaseerd op een combinatie van multiplexed biosensing-methoden met metrologische en morfomechanische analyses door atomaire krachtmicroscopie, gekoppeld aan Raman-spectroscopie, om vesiculaire doelen te kwalificeren die vastzitten op een microarray-biochip.
Abstract
Extracellulaire blaasjes (EV’s) zijn membraan-afgeleide, kleine blaasjes geproduceerd door alle cellen die variëren van 50 tot enkele honderden nanometers in diameter en worden gebruikt als een middel voor intercellulaire communicatie. Ze zijn in opkomst als veelbelovende diagnostische en therapeutische hulpmiddelen voor een verscheidenheid aan ziekten. Er zijn twee belangrijke biogeneseprocessen die door cellen worden gebruikt om EV’s te produceren met verschillen in grootte, samenstelling en inhoud. Vanwege hun hoge complexiteit in grootte, samenstelling en celoorsprong, vereist hun karakterisering een combinatie van analytische technieken. Dit project omvat de ontwikkeling van een nieuwe generatie multiparametrische analytische platforms met een verhoogde doorvoer voor de karakterisering van subpopulaties van EV’s. Om dit doel te bereiken, vertrekt het werk van het nanobioanalytische platform (NBA) dat door de groep is opgericht, dat een origineel onderzoek van EV’s mogelijk maakt op basis van een combinatie van multiplexed biosensing-methoden met metrologische en morfomechanische analyses door atomic force microscopy (AFM) van vesiculaire doelen gevangen op een microarray biochip. Het doel was om dit EV-onderzoek af te ronden met een fenotypische en moleculaire analyse door Raman-spectroscopie. Deze ontwikkelingen maken het mogelijk om een multimodale en gebruiksvriendelijke analytische oplossing voor de discriminatie van EV-subsets in biologische vloeistoffen met klinisch potentieel voor te stellen
Introduction
De groeiende belangstelling voor EV-onderzoek in diagnose en in therapeutica 1,2,3,4,5, in combinatie met de uitdagingen waarmee dit veld wordt geconfronteerd, heeft geresulteerd in de ontwikkeling en implementatie van een grote verscheidenheid aan benaderingen en technieken voor het kwantificeren of karakteriseren van deze blaasjes. De meest gebruikte methoden voor EV-identificatie zijn eiwitspecifieke immunoblotting en proteomics om de oorsprong van EV’s te bevestigen, transmissie-elektronenmicroscopie (TEM) om hun structuur te bevestigen en nanodeeltjesvolganalyse (NTA) om hun aantal en grootteverdeling in een monstervolume te kwantificeren.
Geen van deze technieken op zichzelf geeft echter alle informatie die nodig is om EV-subsets te karakteriseren. De inherente heterogeniteit van EV’s als gevolg van de diversiteit in hun biochemische en fysische eigenschappen belemmert wereldwijde analyses die betrouwbaar en reproduceerbaar zijn, vooral voor EV’s in een mengsel (ruw monster). Detectie- en karakteriseringsmethoden zijn daarom nodig voor EV’s, zowel individueel als in het algemeen als aanvulling op andere methoden die sneller maar niet selectief zijn6.
Hoge resolutie beeldvorming door TEM (of cryoTEM) of AFM maakt het mogelijk om de morfologie en metrologie van EV’s te bepalen met een nanometrische resolutievan 7,8,9,10,11,12. De belangrijkste beperking van het gebruik van elektronenmicroscopie voor biologische objecten, zoals EV’s, is echter de noodzaak van een vacuüm om het onderzoek uit te voeren dat de fixatie en uitdroging van het monster vereist. Een dergelijke voorbereiding maakt het moeilijk om te vertalen van de waargenomen structuren naar de in-oplossing EV-morfologie. Om deze uitdroging van het monster te voorkomen, is de techniek van cryoTEM het meest geschikt voor EV-karakterisering13. Het wordt veel gebruikt voor het bepalen van de ultrastructuur van EV’s. De immunolabeling van blaasjes door biofunctionele gouden nanodeeltjes maakt het ook mogelijk om specifieke subpopulaties van EV’s te identificeren en ze te onderscheiden van andere deeltjes die aanwezig zijn in een complex biologisch monster. Vanwege het lage aantal EV’s dat door elektronische microscopie wordt geanalyseerd, is het echter vaak moeilijk om een karakterisering uit te voeren die representatief is voor een complex en heterogeen monster.
Om deze heterogeniteit van de grootte te onthullen, stelt de International Society for Extracellular Vesicles (ISEV) voor om een voldoende aantal widefield-afbeeldingen te analyseren, vergezeld van kleinere afbeeldingen, om individuele EV’s met een hoge resolutie14 te onthullen. AFM is een alternatief voor optische benaderingen en elektronische diffractietechnieken voor de studie van EV’s. Deze techniek maakt gebruik van een scherpe punt die wordt vastgehouden door een flexibele cantilever die het monster scant dat op één steun is afgezet, regel voor lijn, en de afstand tussen de punt en de aanwezige elementen aanpast via een feedbacklus. Dit maakt het mogelijk om de topografie van het monster te karakteriseren en morfomechanische informatie te verzamelen15,16,17,18. De EV’s kunnen door de AFM worden gescand nadat ze zijn afgezet op een atomair vlak substraat of nadat ze zijn vastgelegd op een specifiek substraat dat is gefunctionaliseerd door antilichamen, peptiden of aptameren om de verschillende subpopulaties te karakteriseren18,19. Vanwege het vermogen om de structuur, biomechanica en vliezige biomoleculaire inhoud van EV’s in complexe biologische monsters te kwantificeren en tegelijkertijd te onderzoeken zonder de noodzaak van voorbehandeling, etikettering of uitdroging, wordt AFM nu steeds vaker gebruikt om EV’s op een fijne en multiparametrische manier te karakteriseren onder fysiologische omstandigheden van temperatuur en medium.
Dit artikel stelt een methodologie voor met behulp van een kern gouden biochip die (bio)chemisch gefunctionaliseerd kan worden in een gemultiplext formaat. Dit substraat is de hoeksteen van een krachtig analytisch platform dat de biodetectie van EV-subsets combineert door oppervlakteplasmonresonantie, en zodra de EV’s zijn geadsorbeerd / geënt of immunocaptured op de chip, maakt AFM de metrologische en morfomechanische karakterisering van de EV’s mogelijk. In combinatie met de Raman-handtekening van de EV-subsets die op de chip zijn vastgelegd, maakt dit analytische platform de kwalificatie van de EV’s in biologische monsters mogelijk op een labelvrije manier en zonder dat er vooraf analytische stappen nodig zijn. Dit artikel laat zien dat de combinatie van krachtige technieken, ondersteund door een zeer rigoureuze methodologie in substraatvoorbereiding en data-acquisitie, de EV-analyse diep, definitief en robuust maakt.
Het principe van de voorgestelde aanpak is om een goudsubstraat voor te bereiden, de EV-subtypen te adsorberen / enten of af te vangen en ze door de AFM te scannen om de grootte en morfologie van elke EV-subset te schatten. Bovendien worden die geadsorbeerde EV’s geanalyseerd door Raman-spectroscopie. Dit substraat kan inderdaad drie soorten interfaces van groeiende complexiteit vertonen: naakte, chemisch gefunctionaliseerde of ligandmicroarrays. Alvorens de verschillende stappen van het protocol te beschrijven, worden lezers verwezen naar de schematische presentatie van de nanobioanalytische platformbenadering (NBA) in figuur 1, waarbij oppervlakteplasmonresonantiebeeldvorming (SPRi), AFM en spectroscopie worden gecombineerd.
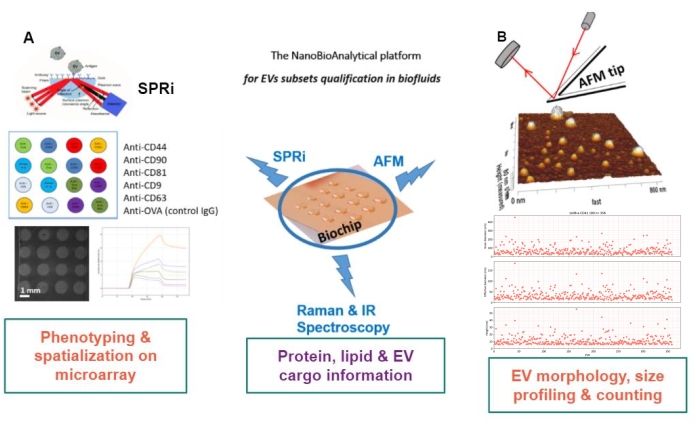
Figuur 1: Het NanoBioAnalytical platform. De aanpak combineert (A) oppervlakte plasmon resonantie beeldvorming, (B) atoomkracht microscopie, en infrarood / Raman (nano) spectroscopie, allemaal betrokken op hetzelfde substraat – een gemultiplexte gouden chip. Afkortingen: NBA = NanoBioAnalytical platform; SPRi =oppervlakte plasmon resonantie beeldvorming; AFM = atoomkrachtmicroscopie; EV = extracellulair blaasje. Klik hier om een grotere versie van deze figuur te bekijken.
De kern gouden biochip vormt het hart van het platform, omdat alle labelvrije karakteriseringstechnieken op deze biochip worden uitgevoerd. Afhankelijk van de behoeften van de EV-karakterisering (globale / totale EV’s of EV-subsets) en de beperkingen / eisen van de gebruikte methoden, zijn er drie soorten gouden biochipoppervlakken ontwikkeld: ofwel “naakt”, chemisch gefunctionaliseerd “C11 / C16”, of ligand-biofunctionalized, genaamd “ligand” goudoppervlak.
De naakte biochip, genaamd “naakt“, maakt de eenvoudige adsorptie van EV’s op goud mogelijk. Het is mogelijk om de gebruikte buffer te selecteren en deze adsorptie te realiseren, hetzij op een passieve manier (incubatie en vervolgens spoelstappen) of om deze onder stroom te bewaken (in SPRi). Bovendien kan deze passieve adsorptie worden gerealiseerd op de hele chip (als een macroarray) of gelokaliseerd in microarrays met behulp van een micropipette-spotter. De “under flow procedure” stelt onderzoekers in staat om de kinetiek en het niveau van EV-adsorptie te volgen. Deze benadering op het naakte gouden substraat wordt toegepast wanneer de chemische laaginterface de analysemethode kan verstoren (bijvoorbeeld voor Raman-spectroscopie).
De chemisch gefunctionaliseerde biochip, genaamd “C11 / C16“, wordt gebruikt om een dicht en robuust “tapijt” te creëren van EV’s die covalent op het gouden oppervlak zijn gebonden door primaire amidebindingen met de thiolaten te vormen wanneer het doel is om een globaal beeld van het EV-monster te hebben. Inderdaad, in dit geval wordt het goud gefunctionaliseerd door een thiolaatmengsel van mercapto-1-undecanol (11-MUOH: “C11”) en mercapto-1-hexadecanoic acid (16-MHA: “C16”), en een fractie van de thiolaten wordt chemisch geactiveerd om covalente binding met de doelen tot stand te brengen. Nogmaals, deze strategie kan passief worden gerealiseerd (incubatie en vervolgens spoelstappen, hetzij in “macroarray” of in meerdere microarrays met behulp van een micropipette-spotter) of onder stroomsnelheden (in SPRi) om de kinetiek en het niveau van EV-enting op het goudoppervlak te volgen.
De ligand-biofunctionele biochip, genaamd “liganden”, wordt chemisch geactiveerd om covalent verschillende liganden (bijv. Antilichamen, receptoren) te enten om selectief (met affiniteit) verschillende EV-subsets vast te leggen die naast elkaar bestaan in het biologische monster.
Protocol
Representative Results
Discussion
De recente methoden voor EV-identificatie die het meest worden gebruikt, zijn eiwitspecifieke immunoblotting om de oorsprong van EV’s te bevestigen, TEM om hun structuur te bevestigen en NTA om hun aantal en grootteverdeling in een steekproefvolume3 te kwantificeren. Niettemin hebben de grote belangstelling voor EV’s in (bio)medisch onderzoek en de beperkingen van bestaande analytische hulpmiddelen de wetenschappelijke gemeenschap ertoe aangezet nieuwe methoden te ontwikkelen voor EV-karakteriseri…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Kelly Aubertin en Fabien Picot van de IVETh-kernfaciliteit (Parijs) zijn erkend voor de Raman-beeldvormingsexperimenten. Thierry Burnouf (Taipei Medical University, Taiwan) en Zuzana Krupova (uit Helincourt, Frankrijk) zijn erkend voor het verstrekken van de EV-monsters afgeleid van respectievelijk bloedplaatjes- en rundermelkmonsters. Het werk werd ondersteund door de regio Bourgogne Franche-Comté en de EUR EIPHI graduate school (NOVICE-project, 2021-2024). Een deel van dit werk werd gedaan met behulp van het CLIPP-platform en in RENATECH cleanroomfaciliteiten in FEMTO-ENGINEERING, waarvoor we Rabah Zeggari bedanken.
Materials
| CD41a antibody | Diaclone SAS (France) | 447528 | |
| CP920 | Microparticles GmbH, Germany | 448303 | |
| DXR3xi | Thermo Fisher Scientific | T1502 | |
| EDC | Sigma | A6272 | |
| Ethanolamine | Sigma | P5368-10PAK | |
| Evs derived from platelet concentrates | Collaboration : Pr T. Burnouf (TMU, Taipei) | S2889 | |
| Evs from bovine milk | Collaboration : Dr Z. Krupova (Excilone, Helincourt – France) | 3450 | |
| Glutaraldehyde | Sigma | 56845 | |
| Gwyddion | 853.223.020 | ||
| Magnetron sputtering | PLASSYS | SAB5300165 | |
| mercapto-1-hexadecanoic acid | Sigma | G5882 | |
| Mercapto-1-undecanol | Sigma | O8001 | |
| Mountains SPIP ones | Digital Surf | ||
| NanoWizard 3 Bioscience | Bruker-JPK | ||
| Octyl Glucoside (OG) | Sigma | ||
| Ovalbumine antibody | Sigma | ||
| Phosphate Buffer Saline (PBS) | Sigma | ||
| Rat Albumin Serum (RSA) | Sigma | ||
| Sodium acetate buffer | Sigma | ||
| SPR-Biacore 3000 | GE Healthcare/ Cytiva life sciences | ||
| SPRi Biochip | MIMENTO technology platform | The biochips were produced in-house in the clean room, Besancon | |
| SPRi Plex II | Horiba Scientific | ||
| Sulfo-NHS | Sigma |
Riferimenti
- Silva, A. K. A., et al. Development of extracellular vesicle-based medicinal products: A position paper of the group "Extracellular Vesicle translatiOn to clinicaL perspectiVEs – EVOLVE France". Advanced Drug Delivery Reviews. 179, 114001 (2021).
- Xunian, Z., Kalluri, R. Biology and therapeutic potential of mesenchymal stem cell-derived exosomes. Cancer Science. 111 (9), 3100-3110 (2020).
- Hartjes, T. A., et al. Extracellular vesicle quantification and characterization: Common methods and emerging approaches. Bioingegneria. 6 (1), 7 (2019).
- Xing, Y., et al. Analysis of extracellular vesicles as emerging theranostic nanoplatforms. Coordination Chemistry Reviews. 424, 213506 (2020).
- Wang, T., Xing, Y., Cheng, Z., Yu, F. Analysis of single extracellular vesicles for biomedical applications with especial emphasis on cancer investigations. Trends in Analytical Chemistry. 152, 116604 (2022).
- Boireau, W., Elie-Caille, C. Extracellular vesicles: Definition, isolation and characterization. Medecine Sciences: M/S. 37 (12), 1092-1100 (2021).
- Brisson, A. R., et al. Extracellular vesicles from activated platelets: A semiquantitative cryo-electron microscopy and immuno-gold labeling study. Platelets. 28 (3), 263-271 (2017).
- Yuana, Y., et al. Atomic force microscopy: A novel approach to the detection of nanosized blood microparticles. Journal of Thrombosis and Haemostasis. 8 (2), 315-323 (2010).
- Sebaihi, N., de Boeck, B., Yuana, Y., Nieuwland, R., Pétry, J. Dimensional characterization of extracellular vesicles using atomic force microscopy. Measurement Science and Technology. 28 (3), 034006 (2017).
- Beekman, P., et al. Immuno-capture of extracellular vesicles for individual multi-modal characterization using AFM, SEM and Raman spectroscopy. Lab on a Chip. 19 (15), 2526-2536 (2019).
- Malenica, M., et al. Perspectives of microscopy methods for morphology characterisation of extracellular vesicles from human biofluids. Biomedicines. 9 (6), 603 (2021).
- Verweij, F. J., et al. The power of imaging to understand extracellular vesicle biology in vivo. Nature Methods. 18 (9), 1013-1026 (2021).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): A position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Obeid, S., et al. NanoBioAnalytical characterization of extracellular vesicles in 75-nm nanofiltered human plasma for transfusion: A tool to improve transfusion safety. Nanomedicine: Nanotechnology, Biology, and Medicine. 20, 101977 (2019).
- Obeid, S., et al. Development of a NanoBioAnalytical platform for «on-chip» qualification and quantification of platelet-derived microparticles. Biosensors and Bioelectronics. 93, 250-259 (2017).
- Ridolfi, A., et al. AFM-based high-throughput nanomechanical screening of single extracellular vesicles. Analytical Chemistry. 92 (15), 10274-10282 (2020).
- Vorselen, D., et al. The fluid membrane determines mechanics of erythrocyte extracellular vesicles and is softened in hereditary spherocytosis. Nature Communications. 9 (1), 4960 (2018).
- Hardij, J., et al. Characterisation of tissue factor bearing extracellular vesicles with AFM: Comparison of air-tapping-mode AFM and liquid Peak Force AFM. Journal of Extracellular Vesicles. 2, 21045 (2013).
- Jorgensen, M., et al. Extracellular Vesicle (EV) Array: Microarray capturing of exosomes and other extracellular vesicles for multiplexed phenotyping. Journal of Extracellular Vesicles. 2, 20920 (2013).
- Remy-Martin, F., et al. Surface plasmon resonance imaging in arrays coupled with mass spectrometry (SUPRA-MS): Proof of concept of on-chip characterization of a potential breast cancer marker in human plasma. Analytical and Bioanalytical Chemistry. 404 (2), 423-432 (2012).
- Czamara, K., et al. Raman spectroscopy of lipids: A review. Journal of Raman Spectroscopy. 46 (1), 4-20 (2015).
- Penders, J., et al. Single particle automated Raman trapping analysis of breast cancer cell-derived extracellular vesicles as cancer biomarkers. ACS Nano. 15 (11), 18192-18205 (2021).
- Baek, S. J., Park, A., Ahn, Y. J., Choo, J. Baseline correction using asymmetrically reweighted penalized least squares smoothing. Analyst. 140 (1), 250-257 (2015).
- Daaboul, G. G., et al. Digital detection of exosomes by interferometric imaging. Scientific Reports. 6, 37246 (2016).
- Ertsgaard, C. T., et al. Integrated nanogap platform for sub-volt dielectrophoretic trapping and real-time Raman imaging of biological nanoparticles. Nano Letters. 18 (9), 5946-5953 (2018).
- Maas, S. L., et al. Possibilities and limitations of current technologies for quantification of biological extracellular vesicles and synthetic mimics. Journal of Controlled Release. 200, 87-96 (2015).

