Piattaforma analitica multimodale su un chip di imaging a risonanza plasmonica di superficie multiplexed per l'analisi di sottoinsiemi di vescicole extracellulari
Summary
Questo articolo propone una nuova generazione di piattaforme analitiche multiparametriche con maggiore produttività per la caratterizzazione di sottoinsiemi di vescicole extracellulari. Il metodo si basa su una combinazione di metodi di biorilevamento multiplex con analisi metrologiche e morfomeccaniche mediante microscopia a forza atomica, accoppiata con spettroscopia Raman, per qualificare bersagli vescicolari intrappolati su un biochip microarray.
Abstract
Le vescicole extracellulari (EV) sono piccole vescicole derivate dalla membrana prodotte da tutte le cellule che vanno da 50 a diverse centinaia di nanometri di diametro e sono utilizzate come mezzo di comunicazione intercellulare. Stanno emergendo come promettenti strumenti diagnostici e terapeutici per una varietà di malattie. Esistono due principali processi di biogenesi utilizzati dalle cellule per produrre EV con differenze di dimensioni, composizione e contenuto. A causa della loro elevata complessità in termini di dimensioni, composizione e origine cellulare, la loro caratterizzazione richiede una combinazione di tecniche analitiche. Questo progetto prevede lo sviluppo di una nuova generazione di piattaforme analitiche multiparametriche con maggiore produttività per la caratterizzazione di sottopopolazioni di EV. Per raggiungere questo obiettivo, il lavoro parte dalla piattaforma nanobioanalitica (NBA) stabilita dal gruppo, che consente un’indagine originale delle EV basata su una combinazione di metodi di biorilevamento multiplex con analisi metrologiche e morfomeccaniche mediante microscopia a forza atomica (AFM) di bersagli vescicolari intrappolati su un biochip microarray. L’obiettivo era quello di completare questa indagine EV con un’analisi fenotipica e molecolare mediante spettroscopia Raman. Questi sviluppi consentono la proposta di una soluzione analitica multimodale e di facile utilizzo per la discriminazione dei sottogruppi di EV nei fluidi biologici con potenziale clinico
Introduction
Il crescente interesse per la ricerca EV nella diagnosi e nella terapia 1,2,3,4,5, combinato con le sfide che questo campo deve affrontare, ha portato allo sviluppo e all’implementazione di una grande varietà di approcci e tecniche per quantificare o caratterizzare queste vescicole. I metodi più utilizzati per l’identificazione delle EV sono l’immunoblotting e la proteomica specifici per confermare l’origine delle EV, la microscopia elettronica a trasmissione (TEM) per confermare la loro struttura e l’analisi di tracciamento delle nanoparticelle (NTA) per quantificare il loro numero e la distribuzione delle dimensioni in un volume di campione.
Nessuna di queste tecniche da sola, tuttavia, fornisce tutte le informazioni necessarie per caratterizzare i sottoinsiemi EV. L’eterogeneità intrinseca dei veicoli elettrici dovuta alla diversità delle loro proprietà biochimiche e fisiche impedisce analisi globali affidabili e riproducibili, in particolare per i veicoli elettrici contenuti in una miscela (campione grezzo). I metodi di rilevamento e caratterizzazione sono pertanto necessari per i veicoli elettrici, sia singolarmente che in generale per integrare altri metodi più rapidi ma non selettivi6.
L’imaging ad alta risoluzione mediante TEM (o cryoTEM) o AFM consente la determinazione della morfologia e della metrologia dei veicoli elettrici con una risoluzione nanometrica 7,8,9,10,11,12. Tuttavia, il principale limite dell’uso della microscopia elettronica per oggetti biologici, come i veicoli elettrici, è la necessità di un vuoto per eseguire lo studio che richiede la fissazione e la disidratazione del campione. Tale preparazione rende difficile la traduzione dalle strutture osservate alla morfologia EV in soluzione. Per evitare questa disidratazione del campione, la tecnica del cryoTEM è la più adatta per la caratterizzazione EV13. È ampiamente utilizzato per determinare l’ultrastruttura dei veicoli elettrici. L’immunomarcatura delle vescicole mediante nanoparticelle d’oro biofunzionalizzate consente inoltre di identificare specifiche sottopopolazioni di EV e distinguerle da altre particelle presenti in un campione biologico complesso. Tuttavia, a causa del basso numero di EV analizzate al microscopio elettronico, è spesso difficile eseguire una caratterizzazione rappresentativa di un campione complesso ed eterogeneo.
Per rivelare questa eterogeneità di dimensioni, l’International Society for Extracellular Vesicles (ISEV) suggerisce di analizzare un numero sufficiente di immagini a campo ampio, accompagnate da immagini più piccole, per rivelare singoli EV ad alta risoluzione14. L’AFM è un’alternativa agli approcci ottici e alle tecniche di diffrazione elettronica per lo studio dei veicoli elettrici. Questa tecnica utilizza una punta affilata tenuta da un cantilever flessibile che scansiona il campione depositato su un supporto, linea per linea, e regola la distanza tra la punta e gli elementi presenti attraverso un anello di feedback. Ciò consente di caratterizzare la topografia del campione e raccogliere informazioni morfomeccaniche15,16,17,18. Le EV possono essere scansionate mediante AFM sia dopo essere state depositate su un substrato atomicamente piatto o dopo essere state catturate su un substrato specifico funzionalizzato da anticorpi, peptidi o aptameri per caratterizzare le varie sottopopolazioni18,19. Grazie alla sua capacità di quantificare e sondare simultaneamente la struttura, la biomeccanica e il contenuto biomolecolare membranoso delle EV all’interno di campioni biologici complessi senza la necessità di pretrattamento, etichettatura o disidratazione, l’AFM è ora sempre più utilizzato per caratterizzare le EV in modo fine e multiparametrico in condizioni fisiologiche di temperatura e mezzo.
Questo articolo propone una metodologia che utilizza un biochip d’oro in grado di essere (bio)funzionalizzato chimicamente in un formato multiplexato. Questo substrato è la pietra angolare di una potente piattaforma analitica che combina la biorilevazione di sottoinsiemi di EV mediante risonanza plasmonica di superficie e, una volta che gli EV sono adsorbiti / innestati o immunocatturati sul chip, AFM consente la caratterizzazione metrologica e morfomeccanica degli EV. Accoppiata con la firma Raman dei sottoinsiemi EV catturati sul chip, questa piattaforma analitica consente la qualificazione dei veicoli elettrici presenti nei campioni biologici in modo label-free e senza alcuna necessità di passaggi preanalitici. Questo documento mostra che la combinazione di potenti tecniche, assistite da una metodologia altamente rigorosa nella preparazione del substrato e nell’acquisizione dei dati, rende l’analisi EV profonda, definitiva e robusta.
Il principio dell’approccio proposto è quello di preparare un substrato d’oro, di assorbire/innestare o catturare i sottotipi EV e di scansionarli mediante AFM per stimare le dimensioni e la morfologia di ciascun sottoinsieme EV. Inoltre, questi EV adsorbiti vengono analizzati mediante spettroscopia Raman. Questo substrato può, infatti, presentare tre tipi di interfacce di crescente complessità: nudi, chimicamente funzionalizzati o microarray di ligando. Prima di descrivere le diverse fasi del protocollo, i lettori sono rimandati alla presentazione schematica dell’approccio della piattaforma nanobioanalitica (NBA) nella Figura 1, combinando la risonanza plasmonica di superficie (SPRi), AFM e spettroscopia.
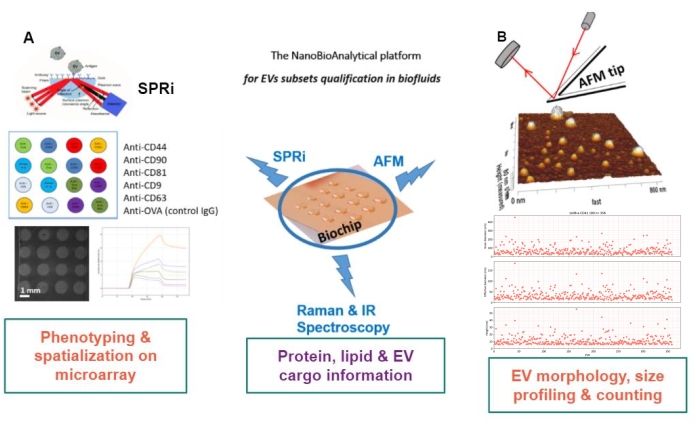
Figura 1: La piattaforma NanoBioAnalitica. L’approccio combina (A) risonanza plasmonica di superficie, (B) microscopia a forza atomica e spettroscopia infrarossa / Raman (nano) spettroscopia, tutti impegnati sullo stesso substrato: un chip d’oro multiplexato. Abbreviazioni: NBA = piattaforma NanoBioAnalitica; SPRi = risonanza plasmonica di superficie; AFM = microscopia a forza atomica; EV = vescicola extracellulare. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Il biochip d’oro costituisce il cuore della piattaforma poiché tutte le tecniche di caratterizzazione label-free sono condotte su questo biochip. In base alle esigenze della caratterizzazione dei veicoli elettrici (EV globali / totali o sottoinsiemi di EV) e ai limiti / richieste dei metodi utilizzati, sono stati sviluppati tre tipi di superfici di biochip d’oro: “nude”, chimicamente funzionalizzate “C11 / C16” o biofunzionalizzate con ligando, chiamate superficie d’oro “ligando”.
Il biochip nudo, chiamato “naked“, consente il semplice adsorbimento di veicoli elettrici sull’oro. E’ possibile selezionare il tampone utilizzato e realizzare questo adsorbimento sia in modo passivo (fasi di incubazione e poi risciacquo) sia monitorarlo sotto flusso (in SPRi). Inoltre, questo adsorbimento passivo può essere realizzato sia sull’intero chip (come macroarray) che localizzato in microarray utilizzando un micropipette spotter. La “procedura under flow” consente agli investigatori di seguire la cinetica e il livello di adsorbimento EV. Questo approccio sul substrato d’oro nudo viene adottato quando l’interfaccia dello strato chimico può interferire con il metodo analitico (ad esempio, per la spettroscopia Raman).
Il biochip funzionalizzato chimicamente, chiamato “C11/C16“, viene utilizzato per creare un “tappeto” denso e robusto di EV legati covalentemente sulla superficie dell’oro formando legami ammidici primari con i tiolati quando l’obiettivo è quello di avere una visione globale del campione EV. Infatti, in questo caso, l’oro è funzionalizzato da una miscela tiolata di mercapto-1-undecanolo (11-MUOH: “C11”) e acido mercapto-1-esadecanoico (16-MHA: “C16”), e una frazione dei tiolati viene attivata chimicamente per stabilire un legame covalente con i bersagli. Ancora una volta, questa strategia può essere realizzata passivamente (fasi di incubazione e poi risciacquo, sia in “macroarray” che in microarray multipli utilizzando uno spotter di micropipette) o sotto portate (in SPRi) per seguire la cinetica e il livello di innesto EV sulla superficie dell’oro.
Il biochip biofunzionalizzato del ligando, chiamato “ligandi“, è attivato chimicamente per innestare covalentemente diversi ligandi (ad esempio, anticorpi, recettori) per catturare selettivamente (con affinità) diversi sottoinsiemi di EV che coesistono nel campione biologico.
Protocol
Representative Results
Discussion
I metodi recenti per l’identificazione delle EV che sono i più utilizzati sono l’immunoblotting protein-specific per confermare l’origine delle EV, TEM per confermare la loro struttura e NTA per quantificare il loro numero e la distribuzione delle dimensioni in un volume campione3. Tuttavia, l’elevato interesse per i veicoli elettrici nella ricerca (bio)medica e i limiti degli strumenti analitici esistenti hanno spinto la comunità scientifica a sviluppare nuovi metodi per la caratterizzazione, l…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Kelly Aubertin e Fabien Picot della struttura centrale IVETh (Parigi) sono riconosciuti per gli esperimenti di imaging Raman. Thierry Burnouf (Taipei Medical University, Taiwan) e Zuzana Krupova (di Helincourt, Francia) sono riconosciuti per aver fornito i campioni EV derivati rispettivamente da campioni di piastrine nel sangue e latte bovino. Il lavoro è stato sostenuto dalla regione Bourgogne Franche-Comté e dalla scuola di specializzazione EUR EIPHI (progetto NOVICE, 2021-2024). Parte di questo lavoro è stato svolto utilizzando la piattaforma CLIPP e nelle camere bianche RENATECH in FEMTO-ENGINEERING, per le quali ringraziamo Rabah Zeggari.
Materials
| CD41a antibody | Diaclone SAS (France) | 447528 | |
| CP920 | Microparticles GmbH, Germany | 448303 | |
| DXR3xi | Thermo Fisher Scientific | T1502 | |
| EDC | Sigma | A6272 | |
| Ethanolamine | Sigma | P5368-10PAK | |
| Evs derived from platelet concentrates | Collaboration : Pr T. Burnouf (TMU, Taipei) | S2889 | |
| Evs from bovine milk | Collaboration : Dr Z. Krupova (Excilone, Helincourt – France) | 3450 | |
| Glutaraldehyde | Sigma | 56845 | |
| Gwyddion | 853.223.020 | ||
| Magnetron sputtering | PLASSYS | SAB5300165 | |
| mercapto-1-hexadecanoic acid | Sigma | G5882 | |
| Mercapto-1-undecanol | Sigma | O8001 | |
| Mountains SPIP ones | Digital Surf | ||
| NanoWizard 3 Bioscience | Bruker-JPK | ||
| Octyl Glucoside (OG) | Sigma | ||
| Ovalbumine antibody | Sigma | ||
| Phosphate Buffer Saline (PBS) | Sigma | ||
| Rat Albumin Serum (RSA) | Sigma | ||
| Sodium acetate buffer | Sigma | ||
| SPR-Biacore 3000 | GE Healthcare/ Cytiva life sciences | ||
| SPRi Biochip | MIMENTO technology platform | The biochips were produced in-house in the clean room, Besancon | |
| SPRi Plex II | Horiba Scientific | ||
| Sulfo-NHS | Sigma |
Riferimenti
- Silva, A. K. A., et al. Development of extracellular vesicle-based medicinal products: A position paper of the group "Extracellular Vesicle translatiOn to clinicaL perspectiVEs – EVOLVE France". Advanced Drug Delivery Reviews. 179, 114001 (2021).
- Xunian, Z., Kalluri, R. Biology and therapeutic potential of mesenchymal stem cell-derived exosomes. Cancer Science. 111 (9), 3100-3110 (2020).
- Hartjes, T. A., et al. Extracellular vesicle quantification and characterization: Common methods and emerging approaches. Bioingegneria. 6 (1), 7 (2019).
- Xing, Y., et al. Analysis of extracellular vesicles as emerging theranostic nanoplatforms. Coordination Chemistry Reviews. 424, 213506 (2020).
- Wang, T., Xing, Y., Cheng, Z., Yu, F. Analysis of single extracellular vesicles for biomedical applications with especial emphasis on cancer investigations. Trends in Analytical Chemistry. 152, 116604 (2022).
- Boireau, W., Elie-Caille, C. Extracellular vesicles: Definition, isolation and characterization. Medecine Sciences: M/S. 37 (12), 1092-1100 (2021).
- Brisson, A. R., et al. Extracellular vesicles from activated platelets: A semiquantitative cryo-electron microscopy and immuno-gold labeling study. Platelets. 28 (3), 263-271 (2017).
- Yuana, Y., et al. Atomic force microscopy: A novel approach to the detection of nanosized blood microparticles. Journal of Thrombosis and Haemostasis. 8 (2), 315-323 (2010).
- Sebaihi, N., de Boeck, B., Yuana, Y., Nieuwland, R., Pétry, J. Dimensional characterization of extracellular vesicles using atomic force microscopy. Measurement Science and Technology. 28 (3), 034006 (2017).
- Beekman, P., et al. Immuno-capture of extracellular vesicles for individual multi-modal characterization using AFM, SEM and Raman spectroscopy. Lab on a Chip. 19 (15), 2526-2536 (2019).
- Malenica, M., et al. Perspectives of microscopy methods for morphology characterisation of extracellular vesicles from human biofluids. Biomedicines. 9 (6), 603 (2021).
- Verweij, F. J., et al. The power of imaging to understand extracellular vesicle biology in vivo. Nature Methods. 18 (9), 1013-1026 (2021).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): A position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Obeid, S., et al. NanoBioAnalytical characterization of extracellular vesicles in 75-nm nanofiltered human plasma for transfusion: A tool to improve transfusion safety. Nanomedicine: Nanotechnology, Biology, and Medicine. 20, 101977 (2019).
- Obeid, S., et al. Development of a NanoBioAnalytical platform for «on-chip» qualification and quantification of platelet-derived microparticles. Biosensors and Bioelectronics. 93, 250-259 (2017).
- Ridolfi, A., et al. AFM-based high-throughput nanomechanical screening of single extracellular vesicles. Analytical Chemistry. 92 (15), 10274-10282 (2020).
- Vorselen, D., et al. The fluid membrane determines mechanics of erythrocyte extracellular vesicles and is softened in hereditary spherocytosis. Nature Communications. 9 (1), 4960 (2018).
- Hardij, J., et al. Characterisation of tissue factor bearing extracellular vesicles with AFM: Comparison of air-tapping-mode AFM and liquid Peak Force AFM. Journal of Extracellular Vesicles. 2, 21045 (2013).
- Jorgensen, M., et al. Extracellular Vesicle (EV) Array: Microarray capturing of exosomes and other extracellular vesicles for multiplexed phenotyping. Journal of Extracellular Vesicles. 2, 20920 (2013).
- Remy-Martin, F., et al. Surface plasmon resonance imaging in arrays coupled with mass spectrometry (SUPRA-MS): Proof of concept of on-chip characterization of a potential breast cancer marker in human plasma. Analytical and Bioanalytical Chemistry. 404 (2), 423-432 (2012).
- Czamara, K., et al. Raman spectroscopy of lipids: A review. Journal of Raman Spectroscopy. 46 (1), 4-20 (2015).
- Penders, J., et al. Single particle automated Raman trapping analysis of breast cancer cell-derived extracellular vesicles as cancer biomarkers. ACS Nano. 15 (11), 18192-18205 (2021).
- Baek, S. J., Park, A., Ahn, Y. J., Choo, J. Baseline correction using asymmetrically reweighted penalized least squares smoothing. Analyst. 140 (1), 250-257 (2015).
- Daaboul, G. G., et al. Digital detection of exosomes by interferometric imaging. Scientific Reports. 6, 37246 (2016).
- Ertsgaard, C. T., et al. Integrated nanogap platform for sub-volt dielectrophoretic trapping and real-time Raman imaging of biological nanoparticles. Nano Letters. 18 (9), 5946-5953 (2018).
- Maas, S. L., et al. Possibilities and limitations of current technologies for quantification of biological extracellular vesicles and synthetic mimics. Journal of Controlled Release. 200, 87-96 (2015).

