Multimodal analytisk platform på en multiplexeret overfladeplasmonresonansbilleddannelseschip til analyse af ekstracellulære vesikelundergrupper
Summary
Dette papir foreslår en ny generation af multiparametriske analytiske platforme med øget gennemstrømning til karakterisering af ekstracellulære vesikelundergrupper. Metoden er baseret på en kombination af multipleksede biosensingmetoder med metrologiske og morfomekaniske analyser ved atomkraftmikroskopi, kombineret med Raman-spektroskopi, for at kvalificere vesikulære mål fanget på en mikroarray-biochip.
Abstract
Ekstracellulære vesikler (EV’er) er membranafledte, små vesikler produceret af alle celler, der spænder fra 50 til flere hundrede nanometer i diameter og bruges som et middel til intercellulær kommunikation. De fremstår som lovende diagnostiske og terapeutiske værktøjer til en række sygdomme. Der er to primære biogeneseprocesser, der anvendes af celler til at producere elbiler med forskelle i størrelse, sammensætning og indhold. På grund af deres høje kompleksitet i størrelse, sammensætning og celleoprindelse kræver deres karakterisering en kombination af analytiske teknikker. Dette projekt involverer udvikling af en ny generation af multiparametriske analytiske platforme med øget gennemstrømning til karakterisering af delpopulationer af elbiler. For at nå dette mål starter arbejdet fra den nanobioanalytiske platform (NBA), der er etableret af gruppen, som muliggør en original undersøgelse af elbiler baseret på en kombination af multipleksede biosensingmetoder med metrologiske og morfomekaniske analyser ved atomkraftmikroskopi (AFM) af vesikulære mål fanget på en mikroarray-biochip. Målet var at afslutte denne EV-undersøgelse med en fænotypisk og molekylær analyse ved Raman-spektroskopi. Denne udvikling gør det muligt at foreslå en multimodal og brugervenlig analytisk løsning til diskriminering af EV-undergrupper i biologiske væsker med klinisk potentiale
Introduction
Den stigende interesse for EV-forskning i diagnose og terapi 1,2,3,4,5 kombineret med de udfordringer, dette felt står over for, har resulteret i udvikling og implementering af en lang række tilgange og teknikker til kvantificering eller karakterisering af disse vesikler. De mest anvendte metoder til EV-identifikation er proteinspecifik immunblotting og proteomics for at bekræfte oprindelsen af EV’er, transmissionselektronmikroskopi (TEM) for at bekræfte deres struktur og nanopartikelsporingsanalyse (NTA) for at kvantificere deres antal og størrelsesfordeling i et prøvevolumen.
Ingen af disse teknikker alene giver dog alle de oplysninger, der kræves for at karakterisere EV-undergrupper. Elbilers iboende heterogenitet på grund af mangfoldigheden i deres biokemiske og fysiske egenskaber hindrer globale analyser, der er pålidelige og reproducerbare, især for elbiler indeholdt i en blanding (råprøve). Der er derfor behov for detektions- og karakteriseringsmetoder for elektriske køretøjer, både individuelt og generelt for at supplere andre metoder, der er hurtigere, men ikke selektive6.
Billeddannelse i høj opløsning ved hjælp af TEM (eller cryoTEM) eller AFM gør det muligt at bestemme morfologien og metrologien for elbiler med en nanometrisk opløsningpå 7,8,9,10,11,12. Den største begrænsning ved brugen af elektronmikroskopi til biologiske objekter, såsom elbiler, er imidlertid behovet for et vakuum for at udføre undersøgelsen, som kræver fiksering og dehydrering af prøven. En sådan forberedelse gør det vanskeligt at oversætte fra de observerede strukturer til EV-morfologien i opløsningen. For at undgå denne dehydrering af prøven er kryoTEM-teknikken den mest egnede til EV-karakterisering13. Det bruges i vid udstrækning til bestemmelse af elbilers ultrastruktur. Immunmærkning af vesikler med biofunktionaliserede guldnanopartikler gør det også muligt at identificere specifikke underpopulationer af EV’er og skelne dem fra andre partikler, der er til stede i en kompleks biologisk prøve. På grund af det lave antal elbiler, der analyseres ved elektronisk mikroskopi, er det imidlertid ofte vanskeligt at udføre en karakterisering, der er repræsentativ for en kompleks og heterogen prøve.
For at afsløre denne størrelsesheterogenitet foreslår International Society for Extracellular Vesicles (ISEV) at analysere et tilstrækkeligt antal widefield-billeder, ledsaget af mindre billeder, til at afsløre individuelle elbiler med høj opløsning14. AFM er et alternativ til optiske tilgange og elektroniske diffraktionsteknikker til undersøgelse af elbiler. Denne teknik bruger en skarp spids, der holdes af en fleksibel udkragning, der scanner prøven deponeret på en understøtning, linje for linje, og justerer afstanden mellem spidsen og de elementer, der er til stede gennem en feedback-sløjfe. Dette gør det muligt at karakterisere prøvens topografi og indsamle morfomekaniske oplysninger15,16,17,18. EV’erne kan scannes af AFM enten efter at være blevet deponeret på et atomisk fladt substrat eller efter at være blevet fanget på et specifikt substrat, der er funktionaliseret af antistoffer, peptider eller aptamerer for at karakterisere de forskellige subpopulationer18,19. På grund af dets evne til at kvantificere og samtidig undersøge strukturen, biomekanikken og det membranøse biomolekylære indhold af EV’er i komplekse biologiske prøver uden behov for forbehandling, mærkning eller dehydrering, bruges AFM nu i stigende grad til at karakterisere elbiler på en fin og multiparametrisk måde under fysiologiske forhold for temperatur og medium.
Dette papir foreslår en metode ved hjælp af en kerneguldbiochip, der er i stand til at blive (bio) kemisk funktionaliseret i et multiplexet format. Dette substrat er hjørnestenen i en kraftfuld analytisk platform, der kombinerer biodetektion af EV-delmængder ved overfladeplasmonresonans, og når EV’erne er adsorberet/podet eller immunfanget på chippen, muliggør AFM den metrologiske og morfomekaniske karakterisering af EV’erne. Sammen med Raman-signaturen af EV-undergrupperne, der er fanget på chippen, muliggør denne analytiske platform kvalificering af de EV’er, der er til stede i biologiske prøver, på en etiketfri måde og uden behov for præanalytiske trin. Dette papir viser, at kombinationen af kraftfulde teknikker, assisteret af en meget streng metode til substratforberedelse og dataindsamling, gør EV-analysen dyb, definitiv og robust.
Princippet i den foreslåede tilgang er at forberede et guldsubstrat, at adsorbere/pode eller fange EV-undertyperne og at scanne dem ved hjælp af AFM for at estimere størrelsen og morfologien af hver EV-delmængde. Derudover analyseres disse adsorberede elbiler ved Raman-spektroskopi. Dette substrat kan faktisk præsentere tre typer grænseflader af voksende kompleksitet: nøgne, kemisk funktionaliserede eller ligandmikroarrays. Før de forskellige trin i protokollen beskrives, henvises læserne til den skematiske præsentation af den nanobioanalytiske platform (NBA) tilgang i figur 1, der kombinerer overfladeplasmonresonansbilleddannelse (SPRi), AFM og spektroskopi.
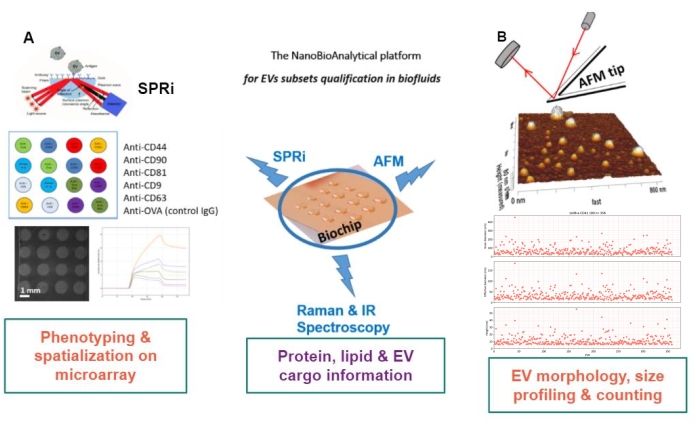
Figur 1: Den nanobioanalytiske platform. Fremgangsmåden kombinerer (A) overfladeplasmonresonansbilleddannelse, (B) atomkraftmikroskopi og infrarød / Raman (nano) spektroskopi, alle involveret på det samme substrat – en multiplekset guldchip. Forkortelser: NBA = NanoBioAnalytical platform; SPRi = billeddannelse af overfladeplasmonresonans; AFM = atomkraftmikroskopi; EV = ekstracellulær vesikel. Klik her for at se en større version af denne figur.
Kerneguldbiochippen udgør hjertet i platformen, da alle de etiketfrie karakteriseringsteknikker udføres på denne biochip. I henhold til behovene for EV-karakterisering (enten globale / samlede EV’er eller EV-delmængder) og begrænsningerne / kravene til de anvendte metoder er der udviklet tre typer guldbiochipoverflader: enten “nøgne”, kemisk funktionaliserede “C11 / C16” eller ligand-biofunktionelle, kaldet “ligand” guldoverflade.
Den nøgne biochip, kaldet “naked“, muliggør simpel adsorption af elbiler på guld. Det er muligt at vælge den anvendte buffer og realisere denne adsorption enten på en passiv måde (inkubation og derefter skylletrin) eller at overvåge den under flow (i SPRi). Desuden kan denne passive adsorption realiseres enten på hele chippen (som et makroarray) eller lokaliseret i mikroarrays ved hjælp af en mikropipettespotter. “Under flow-proceduren” gør det muligt for efterforskere at følge kinetikken og niveauet af EV-adsorption. Denne fremgangsmåde på det nøgne guldsubstrat anvendes, når grænsefladen mellem det kemiske lag kan interferere med analysemetoden (f.eks. til Raman-spektroskopi).
Den kemisk funktionaliserede biochip, kaldet “C11/C16“, bruges til at skabe et tæt og robust “tæppe” af elbiler, der er kovalent bundet på guldoverfladen ved at danne primære amidbindinger med thiolaterne, når målet er at få et globalt overblik over EV-prøven. Faktisk er guldet i dette tilfælde funktionaliseret af en thiolatblanding af mercapto-1-undecanol (11-MUOH: “C11”) og mercapto-1-hexadecansyre (16-MHA: “C16”), og en brøkdel af thiolaterne aktiveres kemisk for at etablere kovalent binding med målene. Igen kan denne strategi realiseres enten passivt (inkubation og derefter skylletrin, enten i “macroarray” eller i flere mikroarrays ved hjælp af en mikropipettespotter) eller under strømningshastigheder (i SPRi) for at følge kinetikken og niveauet af EV-podning på guldoverfladen.
Den ligand-biofunktionaliserede biochip, kaldet “ligander”, aktiveres kemisk til kovalent podning af forskellige ligander (f.eks. Antistoffer, receptorer) for selektivt at fange (med affinitet) forskellige EV-undergrupper, der sameksisterer i den biologiske prøve.
Protocol
Representative Results
Discussion
De seneste metoder til EV-identifikation, der er mest anvendt, er proteinspecifik immunblotting for at bekræfte oprindelsen af EV’er, TEM for at bekræfte deres struktur og NTA for at kvantificere deres antal og størrelsesfordeling i et prøvevolumen3. Ikke desto mindre har den store interesse for elbiler i (bio)medicinsk forskning og begrænsningerne i eksisterende analytiske værktøjer fået det videnskabelige samfund til at udvikle nye metoder til karakterisering, diskrimination og kvantific…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Kelly Aubertin og Fabien Picot fra IVETh-kerneanlægget (Paris) er anerkendt for Raman-billeddannelseseksperimenterne. Thierry Burnouf (Taipei Medical University, Taiwan) og Zuzana Krupova (fra Helincourt, Frankrig) er anerkendt for at levere EV-prøverne fra henholdsvis blodplade- og komælksprøver. Arbejdet blev støttet af regionen Bourgogne Franche-Comté og EUR EIPHI graduate school (NOVICE-projektet, 2021-2024). En del af dette arbejde blev udført ved hjælp af CLIPP-platformen og i RENATECH renrumsfaciliteter i FEMTO-ENGINEERING, hvilket vi takker Rabah Zeggari for.
Materials
| CD41a antibody | Diaclone SAS (France) | 447528 | |
| CP920 | Microparticles GmbH, Germany | 448303 | |
| DXR3xi | Thermo Fisher Scientific | T1502 | |
| EDC | Sigma | A6272 | |
| Ethanolamine | Sigma | P5368-10PAK | |
| Evs derived from platelet concentrates | Collaboration : Pr T. Burnouf (TMU, Taipei) | S2889 | |
| Evs from bovine milk | Collaboration : Dr Z. Krupova (Excilone, Helincourt – France) | 3450 | |
| Glutaraldehyde | Sigma | 56845 | |
| Gwyddion | 853.223.020 | ||
| Magnetron sputtering | PLASSYS | SAB5300165 | |
| mercapto-1-hexadecanoic acid | Sigma | G5882 | |
| Mercapto-1-undecanol | Sigma | O8001 | |
| Mountains SPIP ones | Digital Surf | ||
| NanoWizard 3 Bioscience | Bruker-JPK | ||
| Octyl Glucoside (OG) | Sigma | ||
| Ovalbumine antibody | Sigma | ||
| Phosphate Buffer Saline (PBS) | Sigma | ||
| Rat Albumin Serum (RSA) | Sigma | ||
| Sodium acetate buffer | Sigma | ||
| SPR-Biacore 3000 | GE Healthcare/ Cytiva life sciences | ||
| SPRi Biochip | MIMENTO technology platform | The biochips were produced in-house in the clean room, Besancon | |
| SPRi Plex II | Horiba Scientific | ||
| Sulfo-NHS | Sigma |
Riferimenti
- Silva, A. K. A., et al. Development of extracellular vesicle-based medicinal products: A position paper of the group "Extracellular Vesicle translatiOn to clinicaL perspectiVEs – EVOLVE France". Advanced Drug Delivery Reviews. 179, 114001 (2021).
- Xunian, Z., Kalluri, R. Biology and therapeutic potential of mesenchymal stem cell-derived exosomes. Cancer Science. 111 (9), 3100-3110 (2020).
- Hartjes, T. A., et al. Extracellular vesicle quantification and characterization: Common methods and emerging approaches. Bioingegneria. 6 (1), 7 (2019).
- Xing, Y., et al. Analysis of extracellular vesicles as emerging theranostic nanoplatforms. Coordination Chemistry Reviews. 424, 213506 (2020).
- Wang, T., Xing, Y., Cheng, Z., Yu, F. Analysis of single extracellular vesicles for biomedical applications with especial emphasis on cancer investigations. Trends in Analytical Chemistry. 152, 116604 (2022).
- Boireau, W., Elie-Caille, C. Extracellular vesicles: Definition, isolation and characterization. Medecine Sciences: M/S. 37 (12), 1092-1100 (2021).
- Brisson, A. R., et al. Extracellular vesicles from activated platelets: A semiquantitative cryo-electron microscopy and immuno-gold labeling study. Platelets. 28 (3), 263-271 (2017).
- Yuana, Y., et al. Atomic force microscopy: A novel approach to the detection of nanosized blood microparticles. Journal of Thrombosis and Haemostasis. 8 (2), 315-323 (2010).
- Sebaihi, N., de Boeck, B., Yuana, Y., Nieuwland, R., Pétry, J. Dimensional characterization of extracellular vesicles using atomic force microscopy. Measurement Science and Technology. 28 (3), 034006 (2017).
- Beekman, P., et al. Immuno-capture of extracellular vesicles for individual multi-modal characterization using AFM, SEM and Raman spectroscopy. Lab on a Chip. 19 (15), 2526-2536 (2019).
- Malenica, M., et al. Perspectives of microscopy methods for morphology characterisation of extracellular vesicles from human biofluids. Biomedicines. 9 (6), 603 (2021).
- Verweij, F. J., et al. The power of imaging to understand extracellular vesicle biology in vivo. Nature Methods. 18 (9), 1013-1026 (2021).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): A position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Obeid, S., et al. NanoBioAnalytical characterization of extracellular vesicles in 75-nm nanofiltered human plasma for transfusion: A tool to improve transfusion safety. Nanomedicine: Nanotechnology, Biology, and Medicine. 20, 101977 (2019).
- Obeid, S., et al. Development of a NanoBioAnalytical platform for «on-chip» qualification and quantification of platelet-derived microparticles. Biosensors and Bioelectronics. 93, 250-259 (2017).
- Ridolfi, A., et al. AFM-based high-throughput nanomechanical screening of single extracellular vesicles. Analytical Chemistry. 92 (15), 10274-10282 (2020).
- Vorselen, D., et al. The fluid membrane determines mechanics of erythrocyte extracellular vesicles and is softened in hereditary spherocytosis. Nature Communications. 9 (1), 4960 (2018).
- Hardij, J., et al. Characterisation of tissue factor bearing extracellular vesicles with AFM: Comparison of air-tapping-mode AFM and liquid Peak Force AFM. Journal of Extracellular Vesicles. 2, 21045 (2013).
- Jorgensen, M., et al. Extracellular Vesicle (EV) Array: Microarray capturing of exosomes and other extracellular vesicles for multiplexed phenotyping. Journal of Extracellular Vesicles. 2, 20920 (2013).
- Remy-Martin, F., et al. Surface plasmon resonance imaging in arrays coupled with mass spectrometry (SUPRA-MS): Proof of concept of on-chip characterization of a potential breast cancer marker in human plasma. Analytical and Bioanalytical Chemistry. 404 (2), 423-432 (2012).
- Czamara, K., et al. Raman spectroscopy of lipids: A review. Journal of Raman Spectroscopy. 46 (1), 4-20 (2015).
- Penders, J., et al. Single particle automated Raman trapping analysis of breast cancer cell-derived extracellular vesicles as cancer biomarkers. ACS Nano. 15 (11), 18192-18205 (2021).
- Baek, S. J., Park, A., Ahn, Y. J., Choo, J. Baseline correction using asymmetrically reweighted penalized least squares smoothing. Analyst. 140 (1), 250-257 (2015).
- Daaboul, G. G., et al. Digital detection of exosomes by interferometric imaging. Scientific Reports. 6, 37246 (2016).
- Ertsgaard, C. T., et al. Integrated nanogap platform for sub-volt dielectrophoretic trapping and real-time Raman imaging of biological nanoparticles. Nano Letters. 18 (9), 5946-5953 (2018).
- Maas, S. L., et al. Possibilities and limitations of current technologies for quantification of biological extracellular vesicles and synthetic mimics. Journal of Controlled Release. 200, 87-96 (2015).

