En effektiv rydningsprotokol til undersøgelse af frøudvikling i tomat (Solanum lycopersicum L.)
Summary
Tomatfrøet er en vigtig model til undersøgelse af genetik og udviklingsbiologi under plantegengivelse. Denne protokol er nyttig til rydning af tomatfrø på forskellige udviklingsstadier for at observere den finere embryonale struktur.
Abstract
Tomat (Solanum lycopersicum L.) er en af de største salgsafgrøder på verdensplan. Tomatfrøet er en vigtig model til undersøgelse af genetik og udviklingsbiologi under plantegengivelse. Visualisering af finere embryonal struktur i et tomatfrø hæmmes ofte af frøbelægningslimhinde, flercellelags integument og en tykvægget endosperm, som skal løses ved besværlig indlejringssektion. Et enklere alternativ er at anvende vævsrensningsteknikker, der gør frøet næsten gennemsigtigt ved hjælp af kemiske agenser. Selvom konventionelle rydningsprocedurer giver mulighed for dyb indsigt i mindre frø med en tyndere frøbeklædning, er rydning af tomatfrø fortsat teknisk udfordrende, især i de sene udviklingsstadier.
Præsenteret her er en hurtig og arbejdsbesparende rydningsprotokol for at observere tomatfrøudvikling fra 3 til 23 dage efter blomstring, når embryonal morfologi er næsten færdig. Denne metode kombinerer klorhydratbaseret clearingopløsning, der i vid udstrækning anvendes i Arabidopsis med andre modifikationer, herunder udeladelse af formalin-aceto-alkohol (FAA) fiksering, tilsætning af natriumhypochloritbehandling af frø, fjernelse af den blødgjorte frøbeklædningslimhinde og vask og vakuumbehandling. Denne metode kan anvendes til effektiv rydning af tomatfrø på forskellige udviklingsstadier og er nyttig til fuld overvågning af udviklingsprocessen for mutante frø med god rumlig opløsning. Denne rydningsprotokol kan også anvendes til dyb billeddannelse af andre kommercielt vigtige arter i Solanaceae.
Introduction
Tomat (S. lycopersicum L.) er en af de vigtigste vegetabilske afgrøder rundt om i verden med en produktion på 186,8 millioner tons kødfulde frugter fra 5,1 millioner hektar i 20201. Det tilhører den store Solanaceae-familie med omkring 2.716 arter2, herunder mange kommercielt vigtige afgrøder som aubergine, peberfrugter, kartoffel og tobak. Den dyrkede tomat er en diploid art (2n = 2x = 24) med en genomstørrelse på ca. 900 Mb3. I lang tid er der gjort en stor indsats for tomat domesticering og avl ved at vælge ønskelige træk fra vilde Solanum spp. Der er over 5.000 tomattiltrædelser opført i Tomato Genetics Resource Center, og mere end 80.000 kimplasmer af tomater opbevares over hele verden4. Tomatplanten er flerårig i drivhuset og formeres af frø. Et modent tomatfrø består af tre hovedrum: et fuldvoksent embryo, endosperm af cellulær type og en hård frøbelægning 5,6 (figur 1A). Efter dobbelt befrugtning går udviklingen af endosperm af cellulær type forud for udviklingen af zygoter. Ved ~ 5-6 dage efter blomstring (DAF) observeres tocellet proembryo først, når endospermen består af seks til otte kerner7. I Solanum pimpinellifolium nærmer embryoet sin endelige størrelse efter 20 DAF, og frø er levedygtige til spiring efter 32 DAF8. Efterhånden som embryoet udvikler sig, absorberes endospermen gradvist, og kun en lille mængde endosperm forbliver i frøet. Den resterende endosperm består af mikropylar endosperm omkring radikelspidsen og lateral endosperm i resten af frøet 9,10. Den ydre frøbeklædning er udviklet fra fortykket og lignificeret ydre epidermis af integumentet, og med de døde lag af integumentrester danner de en hård skal for at beskytte embryoet og endospermen5.
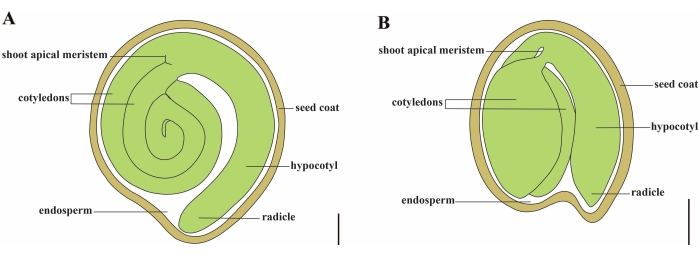
Figur 1: Skematisk repræsentation af et modent frø i Solanum lycopersicum og Arabidopsis thaliana. (A) Langsgående anatomi af et modent tomatfrø. (B) Langsgående anatomi af et modent Arabidopsisfrø. Et modent tomatfrø er ca. 70 gange større end et Arabidopsisfrø. Skalabjælker = (A) 400 μm, (B) 100 μm. Klik her for at se en større version af denne figur.
Produktion af tomatfrø af høj kvalitet afhænger af koordineringen mellem embryoet, endospermen og moderens frøkomponenter11. Dissekering af nøglegener og netværk i frøudvikling kræver en dyb og fuldsporet fænotypisk registrering af mutante frø. Konventionelle indlejrings-sektioneringsteknikker, såsom den halvtynde sektion og paraffinsektionen, anvendes bredt på tomatfrø for at observere de lokale og finere strukturer i embryoet12,13,14,15. Imidlertid er analyse af frøudviklingen fra tynde sektioner normalt besværlig og mangler z-akse rumlig opløsning. Til sammenligning er vævsrensning en hurtig og effektiv metode til at lokalisere udviklingsstadiet af embryodefekter, der mest sandsynligt vil forekomme16. Rydningsmetoden reducerer uigennemsigtigheden af internt væv ved at homogenisere brydningsindekset med et eller flere biokemiske midler16. Helvævsrensning tillader observation af en plantevævsstruktur uden at ødelægge dens integritet, og kombinationen af clearingteknologi og tredimensionel billeddannelse er blevet en ideel løsning til at få information om morfologien og udviklingstilstanden af et planteorgan17,18. I årenes løb er frørensningsteknikker blevet brugt i forskellige plantearter, herunder Arabidopsis thaliana, Hordeum vulgare og Beta vulgaris 19,20,21,22,23. Blandt disse har helmonteret ægløsningsteknologi været en effektiv tilgang til at studere frøudvikling af Arabidopsis på grund af dens lille størrelse, 4-5 lag af frøbeklædningscellen og endospermen af nuklear type24,25. Med den løbende opdatering af forskellige rydningsblandinger, såsom fremkomsten af Hoyers opløsning26, blev de indre strukturer af bygæglet afbildet med en høj grad af klarhed, selvom dets endosperm udgør størstedelen af frøene. Embryogenese af sukkerroer kan observeres ved rydning kombineret med vakuumbehandling og blødgøring med saltsyre19. I modsætning til ovennævnte arter er der imidlertid ikke rapporteret om embryologiske observationer ved rydning af protokoller i tomatfrø. Dette forhindrer detaljeret undersøgelse af tomaternes embryonale og frøudvikling.
Klorhydrat anvendes almindeligvis som en rydningsopløsning, der gør det muligt at vise de nedsænkede væv og celler på forskellige optiske planer og bevarer i væsentlig grad cellerne eller vævskomponenterne27,28,29. Klorhydratbaseret clearingprotokol er med succes blevet brugt til helmontering af frø for at observere embryoet og endospermen af Arabidopsis21,28. Denne rydningsløsning er imidlertid ikke effektiv til at rydde tomatfrø, som er mere uigennemtrængelige end Arabidopsisfrø. De fysiske barrierer omfatter: (1) tomatintegumentet har næsten 20 cellelag ved 3 til 15 DAF 30,31, (2) tomatendospermen er cellulær type, ikke nuklear type32, og (3) tomatfrø er ca. 70 gange større i størrelse33,34 og (4) producerer store mængder frøbelægningsslimhinde, som blokerer penetrationen af rydningsreagenser og påvirker visualiseringen af embryoceller.
Derfor præsenterer denne rapport en optimeret klorhydratbaseret rydningsmetode til helmonteringsrensning af tomatfrø på forskellige stadier, hvilket muliggør dyb billeddannelse af embryoudviklingsprocessen (figur 2).
Protocol
Representative Results
Discussion
Sammenlignet med mekanisk sektionering er clearingteknologien mere fordelagtig til tredimensionel billeddannelse, da den bevarer integriteten af plantevæv eller organer16. Konventionelle rydningsprotokoller er ofte begrænset til små prøver på grund af lettere indtrængning af kemiske opløsninger. Tomatfrø er en problematisk prøve til vævsrensning, fordi den er ca. 70 gange større end et Arabidopsis-frø i størrelse og har flere permeabilitetsbarrierer. Arabidopsis frø…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Forfatterne er taknemmelige for Dr. Jie Le og Dr. Xiufen Song for deres nyttige forslag til henholdsvis differentiel interferenskontrastmikroskopi og konventionel clearingmetode. Denne forskning blev finansieret af National Natural Science Foundation of China (31870299) og Youth Innovation Promotion Association fra det kinesiske videnskabsakademi. Figur 2 blev oprettet med BioRender.com.
Materials
| 1,000 µL pipette | GILSON | FA10006M | |
| 1,000 µL pipette tips | Corning | T-1000-B | |
| 2 ml centrifuge tube | Axygen | MCT-200-C | |
| 37% formaldehyde | DAMAO | 685-2013 | |
| 5,000 µL pipette | Eppendorf | 3120000275 | |
| 5,000 µL pipette tips | biosharp | BS-5000-TL | |
| 50 ml centrifuge tube | Corning | 430829 | |
| Absolute Ethanol | BOYUAN | 678-2002 | |
| Bottle glass | Fisher | FB800-100 | |
| Chloral Hydrate | Meryer | M13315-100G | |
| Coverslip | Leica | 384200 | |
| DIC microscope | Zeiss | Axio Imager A1 | 10x, 20x and 40x magnification |
| Disinfectant | QIKELONGAN | 17-9185 | |
| Dissecting needle | Bioroyee | 17-9140 | |
| Flower nutrient soil | FANGJIE | ||
| Forceps | HAIOU | 4-94 | |
| Glacial Acetic Acid | BOYUAN | 676-2007 | |
| Glycerol | Solarbio | G8190 | |
| Magnetic stirrer | IKA | RET basic | |
| Micro-Tom | Tomato Genetics Resource Center | LA3911 | |
| Orbital shaker | QILINBEIER | QB-206 | |
| Seeding substrate | PINDSTRUP | LV713/018-LV252 | Screening:0-10 mm |
| Single concave slide | HUABODEYI | HBDY1895 | |
| Slide | Leica | 3800381 | |
| Stereomicroscope | Leica | S8 APO | 1x to 4x magnification |
| Tin foil | ZAOWUFANG | 613 | |
| Tween 20 | Sigma | P1379 | |
| Vacuum pump | SHIDING | SHB-III | |
| Vortex meter | Silogex | MX-S |
Riferimenti
- . FAOSTAT Available from: https://www.fao.org/faostat/en/#data/QCL (2022)
- Olmstead, R. G., Bohs, L. A summary of molecular systematic research in Solanaceae: 1982-2006. Acta Horticulturae. 745, 255-268 (2007).
- Consortium, T. G. The tomato genome sequence provides insights into fleshy fruit evolution. Nature. 485 (7400), 635-641 (2012).
- Ebert, A. W., Chou, Y. Y. The tomato collection maintained by AVRDC – The World Vegetable Center: composition, germplasm dissemination and use in breeding. Acta Horticulturae. 1101, 169-176 (2015).
- Hilhorst, H., Groot, S., Bino, R. J. The tomato seed as a model system to study seed development and germination. Acta Botanica Neerlandica. 47, 169-183 (1998).
- Chaban, I. A., Gulevich, A. A., Kononenko, N. V., Khaliluev, M. R., Baranova, E. N. Morphological and structural details of tomato seed coat formation: A different functional role of the inner and outer epidermises in unitegmic ovule. Plants-Basel. 11 (9), 1101 (2022).
- Iwahori, S. High temperature injuries in tomato. V. Fertilization and development of embryo with special reference to the abnormalities caused by high temperature. Journal of The Japanese Society for Horticultural Science. 35 (4), 379-386 (1966).
- Xiao, H., et al. Integration of tomato reproductive developmental landmarks and expression profiles, and the effect of SUN. on fruit shape. BMC Plant Biology. 9 (1), 49 (2009).
- Karssen, C. M., Haigh, A. M., Toorn, P., Weges, R., Taylorson, R. B. Physiological mechanisms involved in seed priming. Recent advances in the development and germination of seeds. NATO ASI Series. 187, (1989).
- Nonogaki, H. Seed dormancy and germination-emerging mechanisms and new hypotheses. Frontiers in Plant Science. 5, 233 (2014).
- Doll, N. M., Ingram, G. C. Embryo-endosperm interactions. Annual Review of Plant Biology. 73, 293-321 (2022).
- Serrani, J. C., Fos, M., Atarés, A., García-Martínez, J. L. Effect of gibberellin and auxin on parthenocarpic fruit growth induction in the cv micro-tom of tomato. Journal of Plant Growth Regulation. 26 (3), 211-221 (2007).
- Yang, C., et al. A regulatory gene induces trichome formation and embryo lethality in tomato. Proceedings of the National Academy of Sciences USA. 108 (29), 11836-11841 (2011).
- Goetz, S., et al. Role of cis-12-oxo-phytodienoic acid in tomato embryo development. Plant Physiology. 158 (4), 1715-1727 (2012).
- Ko, H. Y., Ho, L. H., Neuhaus, H. E., Guo, W. J. Transporter SlSWEET15 unloads sucrose from phloem and seed coat for fruit and seed development in tomato. Plant Physiology. 187 (4), 2230-2245 (2021).
- Richardson, D. S., Lichtman, J. W. Clarifying tissue clearing. Cell. 162 (2), 246-257 (2015).
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: A rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Vieites-Prado, A., Renier, N. Tissue clearing and 3D imaging in developmental biology. Development. 148 (18), (2021).
- Kwiatkowska, M., Kadłuczka, D., Wędzony, M., Dedicova, B., Grzebelus, E. Refinement of a clearing protocol to study crassinucellate ovules of the sugar beet (Beta vulgaris L., Amaranthaceae). Plant Methods. 15, 71 (2019).
- Ponitka, A., Ślusarkiewicz-Jarzina, A. Cleared-ovule technique used for rapid access to early embryo development in Secale cereale × Zea mays crosses. Acta Biologica Cracoviensia. Series Botanica. 46, 133-137 (2014).
- Ceccato, L., et al. Maternal control of PIN1 is required for female gametophyte development in Arabidopsis. PLoS One. 8 (6), 66148 (2013).
- Wilkinson, L. G., Tucker, M. R. An optimised clearing protocol for the quantitative assessment of sub-epidermal ovule tissues within whole cereal pistils. Plant Methods. 13, 67 (2017).
- Hedhly, A., Vogler, H., Eichenberger, C., Grossniklaus, U. Whole-mount clearing and staining of Arabidopsis flower organs and Siliques. Journal of Visualized Experiments. (134), e56441 (2018).
- Creff, A., Brocard, L., Ingram, G. A mechanically sensitive cell layer regulates the physical properties of the Arabidopsis seed coat. Nature Communications. 6, 6382 (2015).
- Yang, T., et al. The B3 domain-containing transcription factor ZmABI19 coordinates expression of key factors required for maize seed development and grain filling. Plant Cell. 33 (1), 104-128 (2021).
- Anderson, L. E. Hoyer’s solution as a rapid permanent mounting medium for bryophytes. Bryologist. 57 (3), 242-244 (1954).
- Herr, J. M. A new clearing-squash technique for the study of ovule development in angiosperms. American Journal of Botany. 58 (8), 785-790 (1971).
- Yadegari, R., et al. Cell differentiation and morphogenesis are uncoupled in Arabidopsis raspberry embryos. The Plant Cell. 6 (12), 1713-1729 (1995).
- Grini, P. E., Jurgens, G., Hulskamp, M. Embryo and endosperm development is disrupted in the female gametophytic capulet mutants of Arabidopsis. Genetica. 162 (4), 1911-1925 (2002).
- Kataoka, K., Uemachi, A., Yazawa, S. Fruit growth and pseudoembryo development affected by uniconazole, an inhibitor of gibberellin biosynthesis, in pat-2 and auxin-Induced parthenocarpic tomato fruits. Scientia Horticulturae. 98 (1), 9-16 (2003).
- de Jong, M., Wolters-Arts, M., Feron, R., Mariani, C., Vriezen, W. H. The Solanum lycopersicum auxin response factor 7 (SlARF7) regulates auxin signaling during tomato fruit set and development. Plant Journal. 57 (1), 160-170 (2009).
- Roth, M., Florez-Rueda, A. M., Paris, M., Stadler, T. Wild tomato endosperm transcriptomes reveal common roles of genomic imprinting in both nuclear and cellular endosperm. Plant Journal. 95 (6), 1084-1101 (2018).
- Orsi, C. H., Tanksley, S. D. Natural variation in an ABC transporter gene associated with seed size evolution in tomato species. PLoS Genetics. 5 (1), 1000347 (2009).
- Herridge, R. P., Day, R. C., Baldwin, S., Macknight, R. C. Rapid analysis of seed size in Arabidopsis for mutant and QTL discovery. Plant Methods. 7 (1), 3 (2011).
- Xu, T. T., Ren, S. C., Song, X. F., Liu, C. M. CLE19 expressed in the embryo regulates both cotyledon establishment and endosperm development in Arabidopsis. Journal of Experimental Botany. 66 (17), 5217-5227 (2015).
- Ghadiri Alamdari, N., Salmasi, S., Almasi, H. Tomato seed mucilage as a new source of biodegradable film-forming material: effect of glycerol and cellulose nanofibers on the characteristics of resultant films. Food and Bioprocess Technology. 14 (12), 2380-2400 (2021).
- Gardner, R. O. An overview of botanical clearing technique. Stain Technology. 50 (2), 99-105 (1975).
- Beresniewicz, M. M., Taylor, A. G., Goffinet, M. C., Terhune, B. T. Characterization and location of a semipermeable layer in seed coats of leek and onion (Liliaceae), tomato and pepper (Solanaceae). Seed Science and Technology. 23 (1), 123-134 (1995).
- Stebbins, G. L. A bleaching and clearing method for plant tissues. Science. 87 (2245), 21-22 (1938).
- Debenham, E. M. A modified technique for the microscopic examination of the xylem of whole plants or plant organs. Annals of Botany. 3 (2), 369-373 (1939).
- Morley, T. Accelerated clearing of plant leaves by NaOH in association with oxygen. Stain Technology. 43 (6), 315-319 (1968).

