Een efficiënt clearingprotocol voor de studie van zaadontwikkeling in tomaat (Solanum lycopersicum L.)
Summary
Het tomatenzaad is een belangrijk model voor het bestuderen van genetica en ontwikkelingsbiologie tijdens de voortplanting van planten. Dit protocol is nuttig voor het opruimen van tomatenzaden in verschillende ontwikkelingsstadia om de fijnere embryonale structuur te observeren.
Abstract
Tomaat (Solanum lycopersicum L.) is een van de belangrijkste cash crops wereldwijd. Het tomatenzaad is een belangrijk model voor het bestuderen van genetica en ontwikkelingsbiologie tijdens de voortplanting van planten. Visualisatie van de fijnere embryonale structuur in een tomatenzaad wordt vaak belemmerd door zaadlaagslijm, meercellige gelaagde omhulling en een dikwandig endosperm, dat moet worden opgelost door moeizame inbeddingssectie. Een eenvoudiger alternatief is om weefselzuiveringstechnieken te gebruiken die het zaad bijna transparant maken met behulp van chemische middelen. Hoewel conventionele opruimprocedures diep inzicht bieden in kleinere zaden met een dunnere zaadlaag, blijft het opruimen van tomatenzaden technisch uitdagend, vooral in de late ontwikkelingsstadia.
Hier wordt een snel en arbeidsbesparend clearingprotocol gepresenteerd om de ontwikkeling van tomatenzaad te observeren van 3 tot 23 dagen na de bloei wanneer de embryonale morfologie bijna voltooid is. Deze methode combineert op chloraalhydraat gebaseerde clearingoplossing die veel wordt gebruikt in Arabidopsis met andere modificaties, waaronder het weglaten van Formaline-Aceto-Alcohol (FAA) fixatie, de toevoeging van natriumhypochlorietbehandeling van zaden, verwijdering van het verzachte zaadlaagslijm en wassen en vacuümbehandeling. Deze methode kan worden toegepast voor het efficiënt opruimen van tomatenzaden in verschillende ontwikkelingsstadia en is nuttig bij volledige monitoring van het ontwikkelingsproces van mutante zaden met een goede ruimtelijke resolutie. Dit clearingprotocol kan ook worden toegepast op diepe beeldvorming van andere commercieel belangrijke soorten in de Solanaceae.
Introduction
Tomaat (S. lycopersicum L.) is een van de belangrijkste groentegewassen ter wereld, met een output van 186,8 miljoen ton vlezig fruit van 5,1 miljoen hectare in 20201. Het behoort tot de grote Solanaceae-familie met ongeveer 2.716 soorten2, waaronder veel commercieel belangrijke gewassen zoals aubergine, paprika’s, aardappelen en tabak. De gekweekte tomaat is een diploïde soort (2n = 2x = 24) met een genoomgrootte van ongeveer 900 Mb3. Lange tijd is er veel moeite gedaan voor het domesticeren en veredelen van tomaten door het selecteren van gewenste eigenschappen uit wilde Solanum spp. Er zijn meer dan 5.000 tomatentoetredingen vermeld in het Tomato Genetics Resource Center en meer dan 80.000 kiemplasma van tomaten worden wereldwijd opgeslagen4. De tomatenplant is overblijvend in de kas en vermeerdert zich door zaden. Een rijp tomatenzaad bestaat uit drie belangrijke compartimenten: een volgroeid embryo, resterend cellulair endosperm en een harde zaadlaag 5,6 (figuur 1A). Na dubbele bevruchting gaat de ontwikkeling van cellulair endosperm vooraf aan de ontwikkeling van zygoten. Bij ~5-6 dagen na de bloei (DAF) wordt tweecellige proembryo voor het eerst waargenomen wanneer het endosperm bestaat uit zes tot acht kernen7. In Solanum pimpinellifolium nadert het embryo zijn uiteindelijke grootte na 20 DAF en zijn zaden levensvatbaar voor ontkieming na 32 DAF8. Naarmate het embryo zich ontwikkelt, wordt het endosperm geleidelijk geabsorbeerd en blijft er slechts een kleine hoeveelheid endosperm in het zaad achter. Het resterende endosperm bestaat uit micropylar endosperm rond de radikelpunt en lateraal endosperm in de rest van het zaad 9,10. De buitenste zaadlaag is ontwikkeld uit verdikte en gelamineerde buitenste epidermis van het integument, en met de dode lagen van integumentresten vormen ze een harde schaal om het embryo en endosperm5 te beschermen.
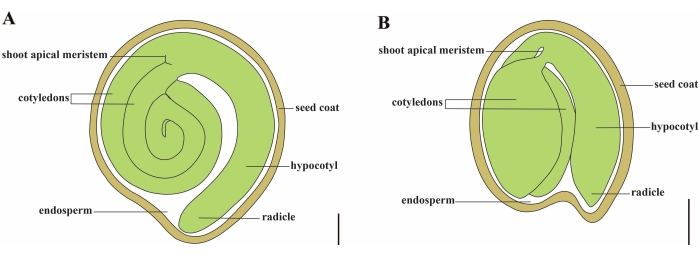
Figuur 1: Schematische weergave van een rijp zaad in Solanum lycopersicum en Arabidopsis thaliana. (A) Longitudinale anatomie van een rijp tomatenzaad. (B) Longitudinale anatomie van een volwassen Arabidopsis zaad. Een volwassen tomatenzaad is ongeveer 70 keer groter dan een Arabidopsiszaadje . Schaalbalken = (A) 400 μm, (B) 100 μm. Klik hier om een grotere versie van dit cijfer te bekijken.
De productie van hoogwaardige tomatenzaden hangt af van de coördinatie tussen het embryo, het endosperm en de maternale zaadcomponenten11. Het ontleden van belangrijke genen en netwerken in zaadontwikkeling vereist een diepe en full-track fenotypische opname van gemuteerde zaden. Conventionele inbeddingstechnieken, zoals de halfdunne sectie en paraffinesectie, worden op grote schaal toegepast op tomatenzaden om de lokale en fijnere structuren van het embryo te observeren 12,13,14,15. Het analyseren van de zaadontwikkeling vanuit dunne secties is echter meestal bewerkelijk en mist de ruimtelijke resolutie van de z-as. Ter vergelijking: weefselopruiming is een snelle en efficiënte methode om het ontwikkelingsstadium van embryodefecten te lokaliseren die het meest waarschijnlijk optreden16. De clearingmethode vermindert de ondoorzichtigheid van inwendig weefsel door de brekingsindex te homogeniseren met een of meer biochemische agentia16. Het opruimen van hele weefsels maakt observatie van een plantenweefselstructuur mogelijk zonder de integriteit ervan te vernietigen, en de combinatie van clearingtechnologie en driedimensionale beeldvorming is een ideale oplossing geworden om informatie te verkrijgen over de morfologie en ontwikkelingstoestand van een plantenorgaan17,18. In de loop der jaren zijn zaadzuiveringstechnieken gebruikt bij verschillende plantensoorten, waaronder Arabidopsis thaliana, Hordeum vulgare en Beta vulgaris 19,20,21,22,23. Onder deze, de hele-mount ovule clearing technologie is een efficiënte benadering geweest voor het bestuderen van zaadontwikkeling van Arabidopsis, vanwege zijn kleine formaat, 4-5 lagen van de zaadlaagcel, en het nucleaire type endosperm24,25. Met de voortdurende actualisering van verschillende clearingmengsels, zoals de opkomst van Hoyer’s oplossing26, werden interne structuren van de gerst-eicel met een hoge mate van helderheid in beeld gebracht, hoewel het endosperm het grootste deel van de zaden uitmaakt. Embryogenese van suikerbieten kan worden waargenomen door opklaring in combinatie met vacuümbehandeling en verzachting met zoutzuur19. Niettemin zijn, in tegenstelling tot de hierboven genoemde soorten, embryologische waarnemingen door clearingprotocollen in tomatenzaden niet gemeld. Dit voorkomt gedetailleerd onderzoek naar de embryonale en zaadontwikkeling van tomaten.
Chloraalhydraat wordt vaak gebruikt als een opruimoplossing waarmee de ondergedompelde weefsels en cellen op verschillende optische vlakken kunnen worden weergegeven en de cellen of weefselcomponenten aanzienlijk behouden 27,28,29. Het op chloraalhydraat gebaseerde clearingprotocol is met succes gebruikt voor het volledig opruimen van zaden om het embryo en endosperm van Arabidopsis21,28 te observeren. Deze clearingoplossing is echter niet efficiënt bij het opruimen van tomatenzaden, die ondoordringbaarder zijn dan Arabidopsis-zaden. De fysieke barrières omvatten: (1) het tomatenintegument heeft bijna 20 cellagen bij 3 tot 15 DAF30,31, (2) het tomatenendosperm is cellulair type, niet nucleair type32, en (3) tomatenzaden zijn ongeveer 70 keer groter in grootte33,34 en (4) produceren grote hoeveelheden zaadlaagslijm, wat de penetratie van clearingreagentia blokkeert en de visualisatie van embryocellen beïnvloedt.
Daarom presenteert dit rapport een geoptimaliseerde op chloraalhydraat gebaseerde clearingmethode voor het volledig opruimen van tomatenzaden in verschillende stadia, waardoor diepe beeldvorming van het embryo-ontwikkelingsproces mogelijk is (figuur 2).
Protocol
Representative Results
Discussion
In vergelijking met mechanische secties is de clearingtechnologie voordeliger voor driedimensionale beeldvorming omdat deze de integriteit van plantenweefsels of organen behoudt16. Conventionele clearingprotocollen zijn vaak beperkt tot kleine monsters vanwege de gemakkelijkere penetratie van chemische oplossingen. Tomatenzaad is een problematisch monster voor weefselzuivering omdat het ongeveer 70 keer groter is dan een Arabidopsis-zaad in grootte en meer permeabiliteitsbarrières heeft….
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
De auteurs zijn Dr. Jie Le en Dr. Xiufen Song dankbaar voor hun nuttige suggesties over respectievelijk differentiële interferentiecontrastmicroscopie en conventionele clearingmethode. Dit onderzoek werd gefinancierd door de National Natural Science Foundation of China (31870299) en de Youth Innovation Promotion Association van de Chinese Academy of Sciences. Figuur 2 is gemaakt met BioRender.com.
Materials
| 1,000 µL pipette | GILSON | FA10006M | |
| 1,000 µL pipette tips | Corning | T-1000-B | |
| 2 ml centrifuge tube | Axygen | MCT-200-C | |
| 37% formaldehyde | DAMAO | 685-2013 | |
| 5,000 µL pipette | Eppendorf | 3120000275 | |
| 5,000 µL pipette tips | biosharp | BS-5000-TL | |
| 50 ml centrifuge tube | Corning | 430829 | |
| Absolute Ethanol | BOYUAN | 678-2002 | |
| Bottle glass | Fisher | FB800-100 | |
| Chloral Hydrate | Meryer | M13315-100G | |
| Coverslip | Leica | 384200 | |
| DIC microscope | Zeiss | Axio Imager A1 | 10x, 20x and 40x magnification |
| Disinfectant | QIKELONGAN | 17-9185 | |
| Dissecting needle | Bioroyee | 17-9140 | |
| Flower nutrient soil | FANGJIE | ||
| Forceps | HAIOU | 4-94 | |
| Glacial Acetic Acid | BOYUAN | 676-2007 | |
| Glycerol | Solarbio | G8190 | |
| Magnetic stirrer | IKA | RET basic | |
| Micro-Tom | Tomato Genetics Resource Center | LA3911 | |
| Orbital shaker | QILINBEIER | QB-206 | |
| Seeding substrate | PINDSTRUP | LV713/018-LV252 | Screening:0-10 mm |
| Single concave slide | HUABODEYI | HBDY1895 | |
| Slide | Leica | 3800381 | |
| Stereomicroscope | Leica | S8 APO | 1x to 4x magnification |
| Tin foil | ZAOWUFANG | 613 | |
| Tween 20 | Sigma | P1379 | |
| Vacuum pump | SHIDING | SHB-III | |
| Vortex meter | Silogex | MX-S |
Riferimenti
- . FAOSTAT Available from: https://www.fao.org/faostat/en/#data/QCL (2022)
- Olmstead, R. G., Bohs, L. A summary of molecular systematic research in Solanaceae: 1982-2006. Acta Horticulturae. 745, 255-268 (2007).
- Consortium, T. G. The tomato genome sequence provides insights into fleshy fruit evolution. Nature. 485 (7400), 635-641 (2012).
- Ebert, A. W., Chou, Y. Y. The tomato collection maintained by AVRDC – The World Vegetable Center: composition, germplasm dissemination and use in breeding. Acta Horticulturae. 1101, 169-176 (2015).
- Hilhorst, H., Groot, S., Bino, R. J. The tomato seed as a model system to study seed development and germination. Acta Botanica Neerlandica. 47, 169-183 (1998).
- Chaban, I. A., Gulevich, A. A., Kononenko, N. V., Khaliluev, M. R., Baranova, E. N. Morphological and structural details of tomato seed coat formation: A different functional role of the inner and outer epidermises in unitegmic ovule. Plants-Basel. 11 (9), 1101 (2022).
- Iwahori, S. High temperature injuries in tomato. V. Fertilization and development of embryo with special reference to the abnormalities caused by high temperature. Journal of The Japanese Society for Horticultural Science. 35 (4), 379-386 (1966).
- Xiao, H., et al. Integration of tomato reproductive developmental landmarks and expression profiles, and the effect of SUN. on fruit shape. BMC Plant Biology. 9 (1), 49 (2009).
- Karssen, C. M., Haigh, A. M., Toorn, P., Weges, R., Taylorson, R. B. Physiological mechanisms involved in seed priming. Recent advances in the development and germination of seeds. NATO ASI Series. 187, (1989).
- Nonogaki, H. Seed dormancy and germination-emerging mechanisms and new hypotheses. Frontiers in Plant Science. 5, 233 (2014).
- Doll, N. M., Ingram, G. C. Embryo-endosperm interactions. Annual Review of Plant Biology. 73, 293-321 (2022).
- Serrani, J. C., Fos, M., Atarés, A., García-Martínez, J. L. Effect of gibberellin and auxin on parthenocarpic fruit growth induction in the cv micro-tom of tomato. Journal of Plant Growth Regulation. 26 (3), 211-221 (2007).
- Yang, C., et al. A regulatory gene induces trichome formation and embryo lethality in tomato. Proceedings of the National Academy of Sciences USA. 108 (29), 11836-11841 (2011).
- Goetz, S., et al. Role of cis-12-oxo-phytodienoic acid in tomato embryo development. Plant Physiology. 158 (4), 1715-1727 (2012).
- Ko, H. Y., Ho, L. H., Neuhaus, H. E., Guo, W. J. Transporter SlSWEET15 unloads sucrose from phloem and seed coat for fruit and seed development in tomato. Plant Physiology. 187 (4), 2230-2245 (2021).
- Richardson, D. S., Lichtman, J. W. Clarifying tissue clearing. Cell. 162 (2), 246-257 (2015).
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: A rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Vieites-Prado, A., Renier, N. Tissue clearing and 3D imaging in developmental biology. Development. 148 (18), (2021).
- Kwiatkowska, M., Kadłuczka, D., Wędzony, M., Dedicova, B., Grzebelus, E. Refinement of a clearing protocol to study crassinucellate ovules of the sugar beet (Beta vulgaris L., Amaranthaceae). Plant Methods. 15, 71 (2019).
- Ponitka, A., Ślusarkiewicz-Jarzina, A. Cleared-ovule technique used for rapid access to early embryo development in Secale cereale × Zea mays crosses. Acta Biologica Cracoviensia. Series Botanica. 46, 133-137 (2014).
- Ceccato, L., et al. Maternal control of PIN1 is required for female gametophyte development in Arabidopsis. PLoS One. 8 (6), 66148 (2013).
- Wilkinson, L. G., Tucker, M. R. An optimised clearing protocol for the quantitative assessment of sub-epidermal ovule tissues within whole cereal pistils. Plant Methods. 13, 67 (2017).
- Hedhly, A., Vogler, H., Eichenberger, C., Grossniklaus, U. Whole-mount clearing and staining of Arabidopsis flower organs and Siliques. Journal of Visualized Experiments. (134), e56441 (2018).
- Creff, A., Brocard, L., Ingram, G. A mechanically sensitive cell layer regulates the physical properties of the Arabidopsis seed coat. Nature Communications. 6, 6382 (2015).
- Yang, T., et al. The B3 domain-containing transcription factor ZmABI19 coordinates expression of key factors required for maize seed development and grain filling. Plant Cell. 33 (1), 104-128 (2021).
- Anderson, L. E. Hoyer’s solution as a rapid permanent mounting medium for bryophytes. Bryologist. 57 (3), 242-244 (1954).
- Herr, J. M. A new clearing-squash technique for the study of ovule development in angiosperms. American Journal of Botany. 58 (8), 785-790 (1971).
- Yadegari, R., et al. Cell differentiation and morphogenesis are uncoupled in Arabidopsis raspberry embryos. The Plant Cell. 6 (12), 1713-1729 (1995).
- Grini, P. E., Jurgens, G., Hulskamp, M. Embryo and endosperm development is disrupted in the female gametophytic capulet mutants of Arabidopsis. Genetica. 162 (4), 1911-1925 (2002).
- Kataoka, K., Uemachi, A., Yazawa, S. Fruit growth and pseudoembryo development affected by uniconazole, an inhibitor of gibberellin biosynthesis, in pat-2 and auxin-Induced parthenocarpic tomato fruits. Scientia Horticulturae. 98 (1), 9-16 (2003).
- de Jong, M., Wolters-Arts, M., Feron, R., Mariani, C., Vriezen, W. H. The Solanum lycopersicum auxin response factor 7 (SlARF7) regulates auxin signaling during tomato fruit set and development. Plant Journal. 57 (1), 160-170 (2009).
- Roth, M., Florez-Rueda, A. M., Paris, M., Stadler, T. Wild tomato endosperm transcriptomes reveal common roles of genomic imprinting in both nuclear and cellular endosperm. Plant Journal. 95 (6), 1084-1101 (2018).
- Orsi, C. H., Tanksley, S. D. Natural variation in an ABC transporter gene associated with seed size evolution in tomato species. PLoS Genetics. 5 (1), 1000347 (2009).
- Herridge, R. P., Day, R. C., Baldwin, S., Macknight, R. C. Rapid analysis of seed size in Arabidopsis for mutant and QTL discovery. Plant Methods. 7 (1), 3 (2011).
- Xu, T. T., Ren, S. C., Song, X. F., Liu, C. M. CLE19 expressed in the embryo regulates both cotyledon establishment and endosperm development in Arabidopsis. Journal of Experimental Botany. 66 (17), 5217-5227 (2015).
- Ghadiri Alamdari, N., Salmasi, S., Almasi, H. Tomato seed mucilage as a new source of biodegradable film-forming material: effect of glycerol and cellulose nanofibers on the characteristics of resultant films. Food and Bioprocess Technology. 14 (12), 2380-2400 (2021).
- Gardner, R. O. An overview of botanical clearing technique. Stain Technology. 50 (2), 99-105 (1975).
- Beresniewicz, M. M., Taylor, A. G., Goffinet, M. C., Terhune, B. T. Characterization and location of a semipermeable layer in seed coats of leek and onion (Liliaceae), tomato and pepper (Solanaceae). Seed Science and Technology. 23 (1), 123-134 (1995).
- Stebbins, G. L. A bleaching and clearing method for plant tissues. Science. 87 (2245), 21-22 (1938).
- Debenham, E. M. A modified technique for the microscopic examination of the xylem of whole plants or plant organs. Annals of Botany. 3 (2), 369-373 (1939).
- Morley, T. Accelerated clearing of plant leaves by NaOH in association with oxygen. Stain Technology. 43 (6), 315-319 (1968).

