Ett effektivt clearingprotokoll för studier av fröutveckling i tomat (Solanum lycopersicum L.)
Summary
Tomatfröet är en viktig modell för att studera genetik och utvecklingsbiologi under växtreproduktion. Detta protokoll är användbart för att rensa tomatfrön i olika utvecklingsstadier för att observera den finare embryonala strukturen.
Abstract
Tomat (Solanum lycopersicum L.) är en av de största kontantgrödorna i världen. Tomatfröet är en viktig modell för att studera genetik och utvecklingsbiologi under växtreproduktion. Visualisering av finare embryonal struktur i ett tomatfrö hindras ofta av fröskiktsmucilage, flercellskiktat integument och en tjockväggig endosperm, som måste lösas genom mödosam inbäddningssektionering. Ett enklare alternativ är att använda vävnadsrensningstekniker som gör fröet nästan transparent med kemiska medel. Även om konventionella röjningsprocedurer möjliggör djup insikt i mindre frön med en tunnare fröbeläggning, fortsätter det att vara tekniskt utmanande att rensa tomatfrön, särskilt i de sena utvecklingsstadierna.
Här presenteras ett snabbt och arbetsbesparande röjningsprotokoll för att observera tomatfröutveckling från 3 till 23 dagar efter blomningen när embryonal morfologi är nästan klar. Denna metod kombinerar klorhydratbaserad clearinglösning som ofta används i Arabidopsis med andra modifieringar, inklusive utelämnande av formalin-aceto-alkohol (FAA) fixering, tillsats av natriumhypokloritbehandling av frön, avlägsnande av den mjukade fröbeläggningsmucilage och tvätt- och vakuumbehandling. Denna metod kan tillämpas för effektiv rensning av tomatfrön i olika utvecklingsstadier och är användbar vid fullständig övervakning av utvecklingsprocessen för mutanta frön med god rumslig upplösning. Detta röjningsprotokoll kan också tillämpas på djupavbildning av andra kommersiellt viktiga arter i Solanaceae.
Introduction
Tomat (S. lycopersicum L.) är en av de viktigaste grönsaksgrödorna runt om i världen, med en produktion på 186,8 miljoner ton köttiga frukter från 5,1 miljoner hektar 20201. Den tillhör den stora familjen Solanaceae med cirka 2 716 arter2, inklusive många kommersiellt viktiga grödor som aubergine, paprika, potatis och tobak. Den odlade tomaten är en diploid art (2n = 2x = 24) med en genomstorlek på cirka 900 Mb3. Under lång tid har stora ansträngningar gjorts för tomattämjning och avel genom att välja önskvärda egenskaper från vilda Solanum spp. Det finns över 5 000 tomatanslutningar listade i Tomato Genetics Resource Center och mer än 80 000 bakterieplasma av tomater lagras över hela världen4. Tomatplantan är flerårig i växthuset och förökas av frön. Ett moget tomatfrö består av tre huvudfack: ett fullvuxet embryo, kvarvarande endosperm av cellulär typ och en hårdfröbeläggning 5,6 (figur 1A). Efter dubbel befruktning föregår utvecklingen av endosperm av cellulär typ utvecklingen av zygoter. Vid ~ 5-6 dagar efter blomning (DAF) observeras tvåcellig proembryo först när endospermen består av sex till åtta kärnor7. I Solanum pimpinellifolium närmar sig embryot sin slutliga storlek efter 20 DAF, och frön är livskraftiga för spiring efter 32 DAF8. När embryot utvecklas absorberas endospermen gradvis och endast en liten mängd endosperm kvarstår i fröet. Den återstående endospermen består av mikropylar endosperm som omger radikelspetsen och lateral endosperm i resten av fröet 9,10. Den yttre fröbeläggningen är utvecklad från förtjockad och lignifierad yttre epidermis av integumentet, och med de döda lagren av integumentrester bildar de ett hårt skal för att skydda embryot och endospermen5.
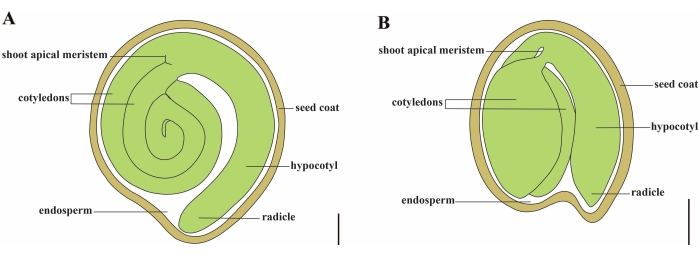
Figur 1: Schematisk representation av ett moget frö i Solanum lycopersicum och Arabidopsis thaliana. (A) Longitudinell anatomi hos ett moget tomatfrö. B) Longitudinell anatomi hos ett moget Arabidopsisfrö. Ett moget tomatfrö är ungefär 70 gånger större än ett Arabidopsis-frö. Skalstänger = (A) 400 μm, (B) 100 μm. Klicka här för att se en större version av denna figur.
Produktion av högkvalitativa tomatfrön beror på samordningen mellan embryot, endospermen och moderfrökomponenterna11. Att dissekera viktiga gener och nätverk i fröutveckling kräver en djup och fullständig fenotypisk registrering av mutanta frön. Konventionella inbäddnings-sektionstekniker, såsom den halvtunna sektionen och paraffinsektionen, används i stor utsträckning på tomatfrön för att observera de lokala och finare strukturerna hos embryot12,13,14,15. Att analysera fröutvecklingen från tunna sektioner är dock vanligtvis mödosamt och saknar z-axelns rumsliga upplösning. I jämförelse är vävnadsrensning en snabb och effektiv metod för att fastställa utvecklingsstadiet för embryodefekter som mest sannolikt kommer att inträffa16. Clearingmetoden minskar ogenomskinligheten hos inre vävnad genom att homogenisera brytningsindexet med ett eller flera biokemiska medel16. Rensning av hela vävnader möjliggör observation av en växtvävnadsstruktur utan att förstöra dess integritet, och kombinationen av röjningsteknik och tredimensionell avbildning har blivit en idealisk lösning för att få information om morfologin och utvecklingstillståndet hos ett växtorgan17,18. Under åren har fröröjningstekniker använts i olika växtarter, inklusive Arabidopsis thaliana, Hordeum vulgare och Beta vulgaris 19,20,21,22,23. Bland dessa har den helmonterade ägglossningstekniken varit ett effektivt tillvägagångssätt för att studera fröutveckling av Arabidopsis, på grund av dess lilla storlek, 4-5 lager av fröskiktcellen och endospermen av kärntyp24,25. Med den kontinuerliga uppdateringen av olika clearingblandningar, såsom framväxten av Hoyers lösning26, avbildades inre strukturer i kornäggstocken med hög grad av klarhet även om dess endosperm utgör huvuddelen av fröna. Embryogenes av sockerbetor kan observeras genom rensning i kombination med vakuumbehandling och mjukning med saltsyra19. Till skillnad från de arter som nämns ovan har dock embryologiska observationer genom rensningsprotokoll i tomatfrön inte rapporterats. Detta förhindrar detaljerad undersökning av embryonal och fröutveckling av tomater.
Klorhydrat används ofta som en clearinglösning som gör att de nedsänkta vävnaderna och cellerna kan visas på olika optiska plan och bevarar cellerna eller vävnadskomponenterna27,28,29. Klorhydratbaserat clearingprotokoll har framgångsrikt använts för helmontering av frön för att observera embryot och endospermen av Arabidopsis21,28. Denna clearinglösning är emellertid inte effektiv för att rensa tomatfrön, som är mer ogenomträngliga än Arabidopsisfrön. De fysiska barriärerna inkluderar: (1) tomatintegumentet har nästan 20 cellskikt vid 3 till 15 DAF 30,31, (2) tomatendospermen är cellulär, inte kärntyp32, och (3) tomatfrön är cirka 70 gånger större i storlek33,34 och (4) producerar stora mängder fröskiktsmucilage, vilket blockerar penetrationen av clearingreagens och påverkar visualiseringen av embryoceller.
Därför presenterar denna rapport en optimerad klorhydratbaserad röjningsmetod för helmonterad rensning av tomatfrön i olika stadier, vilket möjliggör djup avbildning av embryoutvecklingsprocessen (figur 2).
Protocol
Representative Results
Discussion
Jämfört med mekanisk sektionering är röjningstekniken mer fördelaktig för tredimensionell avbildning eftersom den behåller integriteten hos växtvävnader eller organ16. Konventionella clearingprotokoll är ofta begränsade till små prover på grund av enklare penetration av kemiska lösningar. Tomatfrö är ett problematiskt prov för vävnadsrensning eftersom det är cirka 70 gånger större än ett Arabidopsis-frö i storlek och har fler permeabilitetsbarriärer. Arabidopsi…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Författarna är tacksamma mot Dr. Jie Le och Dr. Xiufen Song för deras användbara förslag om differentiell interferenskontrastmikroskopi respektive konventionell clearingmetod. Denna forskning finansierades av National Natural Science Foundation of China (31870299) och Youth Innovation Promotion Association vid Chinese Academy of Sciences. Figur 2 skapades med BioRender.com.
Materials
| 1,000 µL pipette | GILSON | FA10006M | |
| 1,000 µL pipette tips | Corning | T-1000-B | |
| 2 ml centrifuge tube | Axygen | MCT-200-C | |
| 37% formaldehyde | DAMAO | 685-2013 | |
| 5,000 µL pipette | Eppendorf | 3120000275 | |
| 5,000 µL pipette tips | biosharp | BS-5000-TL | |
| 50 ml centrifuge tube | Corning | 430829 | |
| Absolute Ethanol | BOYUAN | 678-2002 | |
| Bottle glass | Fisher | FB800-100 | |
| Chloral Hydrate | Meryer | M13315-100G | |
| Coverslip | Leica | 384200 | |
| DIC microscope | Zeiss | Axio Imager A1 | 10x, 20x and 40x magnification |
| Disinfectant | QIKELONGAN | 17-9185 | |
| Dissecting needle | Bioroyee | 17-9140 | |
| Flower nutrient soil | FANGJIE | ||
| Forceps | HAIOU | 4-94 | |
| Glacial Acetic Acid | BOYUAN | 676-2007 | |
| Glycerol | Solarbio | G8190 | |
| Magnetic stirrer | IKA | RET basic | |
| Micro-Tom | Tomato Genetics Resource Center | LA3911 | |
| Orbital shaker | QILINBEIER | QB-206 | |
| Seeding substrate | PINDSTRUP | LV713/018-LV252 | Screening:0-10 mm |
| Single concave slide | HUABODEYI | HBDY1895 | |
| Slide | Leica | 3800381 | |
| Stereomicroscope | Leica | S8 APO | 1x to 4x magnification |
| Tin foil | ZAOWUFANG | 613 | |
| Tween 20 | Sigma | P1379 | |
| Vacuum pump | SHIDING | SHB-III | |
| Vortex meter | Silogex | MX-S |
Riferimenti
- . FAOSTAT Available from: https://www.fao.org/faostat/en/#data/QCL (2022)
- Olmstead, R. G., Bohs, L. A summary of molecular systematic research in Solanaceae: 1982-2006. Acta Horticulturae. 745, 255-268 (2007).
- Consortium, T. G. The tomato genome sequence provides insights into fleshy fruit evolution. Nature. 485 (7400), 635-641 (2012).
- Ebert, A. W., Chou, Y. Y. The tomato collection maintained by AVRDC – The World Vegetable Center: composition, germplasm dissemination and use in breeding. Acta Horticulturae. 1101, 169-176 (2015).
- Hilhorst, H., Groot, S., Bino, R. J. The tomato seed as a model system to study seed development and germination. Acta Botanica Neerlandica. 47, 169-183 (1998).
- Chaban, I. A., Gulevich, A. A., Kononenko, N. V., Khaliluev, M. R., Baranova, E. N. Morphological and structural details of tomato seed coat formation: A different functional role of the inner and outer epidermises in unitegmic ovule. Plants-Basel. 11 (9), 1101 (2022).
- Iwahori, S. High temperature injuries in tomato. V. Fertilization and development of embryo with special reference to the abnormalities caused by high temperature. Journal of The Japanese Society for Horticultural Science. 35 (4), 379-386 (1966).
- Xiao, H., et al. Integration of tomato reproductive developmental landmarks and expression profiles, and the effect of SUN. on fruit shape. BMC Plant Biology. 9 (1), 49 (2009).
- Karssen, C. M., Haigh, A. M., Toorn, P., Weges, R., Taylorson, R. B. Physiological mechanisms involved in seed priming. Recent advances in the development and germination of seeds. NATO ASI Series. 187, (1989).
- Nonogaki, H. Seed dormancy and germination-emerging mechanisms and new hypotheses. Frontiers in Plant Science. 5, 233 (2014).
- Doll, N. M., Ingram, G. C. Embryo-endosperm interactions. Annual Review of Plant Biology. 73, 293-321 (2022).
- Serrani, J. C., Fos, M., Atarés, A., García-Martínez, J. L. Effect of gibberellin and auxin on parthenocarpic fruit growth induction in the cv micro-tom of tomato. Journal of Plant Growth Regulation. 26 (3), 211-221 (2007).
- Yang, C., et al. A regulatory gene induces trichome formation and embryo lethality in tomato. Proceedings of the National Academy of Sciences USA. 108 (29), 11836-11841 (2011).
- Goetz, S., et al. Role of cis-12-oxo-phytodienoic acid in tomato embryo development. Plant Physiology. 158 (4), 1715-1727 (2012).
- Ko, H. Y., Ho, L. H., Neuhaus, H. E., Guo, W. J. Transporter SlSWEET15 unloads sucrose from phloem and seed coat for fruit and seed development in tomato. Plant Physiology. 187 (4), 2230-2245 (2021).
- Richardson, D. S., Lichtman, J. W. Clarifying tissue clearing. Cell. 162 (2), 246-257 (2015).
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: A rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Vieites-Prado, A., Renier, N. Tissue clearing and 3D imaging in developmental biology. Development. 148 (18), (2021).
- Kwiatkowska, M., Kadłuczka, D., Wędzony, M., Dedicova, B., Grzebelus, E. Refinement of a clearing protocol to study crassinucellate ovules of the sugar beet (Beta vulgaris L., Amaranthaceae). Plant Methods. 15, 71 (2019).
- Ponitka, A., Ślusarkiewicz-Jarzina, A. Cleared-ovule technique used for rapid access to early embryo development in Secale cereale × Zea mays crosses. Acta Biologica Cracoviensia. Series Botanica. 46, 133-137 (2014).
- Ceccato, L., et al. Maternal control of PIN1 is required for female gametophyte development in Arabidopsis. PLoS One. 8 (6), 66148 (2013).
- Wilkinson, L. G., Tucker, M. R. An optimised clearing protocol for the quantitative assessment of sub-epidermal ovule tissues within whole cereal pistils. Plant Methods. 13, 67 (2017).
- Hedhly, A., Vogler, H., Eichenberger, C., Grossniklaus, U. Whole-mount clearing and staining of Arabidopsis flower organs and Siliques. Journal of Visualized Experiments. (134), e56441 (2018).
- Creff, A., Brocard, L., Ingram, G. A mechanically sensitive cell layer regulates the physical properties of the Arabidopsis seed coat. Nature Communications. 6, 6382 (2015).
- Yang, T., et al. The B3 domain-containing transcription factor ZmABI19 coordinates expression of key factors required for maize seed development and grain filling. Plant Cell. 33 (1), 104-128 (2021).
- Anderson, L. E. Hoyer’s solution as a rapid permanent mounting medium for bryophytes. Bryologist. 57 (3), 242-244 (1954).
- Herr, J. M. A new clearing-squash technique for the study of ovule development in angiosperms. American Journal of Botany. 58 (8), 785-790 (1971).
- Yadegari, R., et al. Cell differentiation and morphogenesis are uncoupled in Arabidopsis raspberry embryos. The Plant Cell. 6 (12), 1713-1729 (1995).
- Grini, P. E., Jurgens, G., Hulskamp, M. Embryo and endosperm development is disrupted in the female gametophytic capulet mutants of Arabidopsis. Genetica. 162 (4), 1911-1925 (2002).
- Kataoka, K., Uemachi, A., Yazawa, S. Fruit growth and pseudoembryo development affected by uniconazole, an inhibitor of gibberellin biosynthesis, in pat-2 and auxin-Induced parthenocarpic tomato fruits. Scientia Horticulturae. 98 (1), 9-16 (2003).
- de Jong, M., Wolters-Arts, M., Feron, R., Mariani, C., Vriezen, W. H. The Solanum lycopersicum auxin response factor 7 (SlARF7) regulates auxin signaling during tomato fruit set and development. Plant Journal. 57 (1), 160-170 (2009).
- Roth, M., Florez-Rueda, A. M., Paris, M., Stadler, T. Wild tomato endosperm transcriptomes reveal common roles of genomic imprinting in both nuclear and cellular endosperm. Plant Journal. 95 (6), 1084-1101 (2018).
- Orsi, C. H., Tanksley, S. D. Natural variation in an ABC transporter gene associated with seed size evolution in tomato species. PLoS Genetics. 5 (1), 1000347 (2009).
- Herridge, R. P., Day, R. C., Baldwin, S., Macknight, R. C. Rapid analysis of seed size in Arabidopsis for mutant and QTL discovery. Plant Methods. 7 (1), 3 (2011).
- Xu, T. T., Ren, S. C., Song, X. F., Liu, C. M. CLE19 expressed in the embryo regulates both cotyledon establishment and endosperm development in Arabidopsis. Journal of Experimental Botany. 66 (17), 5217-5227 (2015).
- Ghadiri Alamdari, N., Salmasi, S., Almasi, H. Tomato seed mucilage as a new source of biodegradable film-forming material: effect of glycerol and cellulose nanofibers on the characteristics of resultant films. Food and Bioprocess Technology. 14 (12), 2380-2400 (2021).
- Gardner, R. O. An overview of botanical clearing technique. Stain Technology. 50 (2), 99-105 (1975).
- Beresniewicz, M. M., Taylor, A. G., Goffinet, M. C., Terhune, B. T. Characterization and location of a semipermeable layer in seed coats of leek and onion (Liliaceae), tomato and pepper (Solanaceae). Seed Science and Technology. 23 (1), 123-134 (1995).
- Stebbins, G. L. A bleaching and clearing method for plant tissues. Science. 87 (2245), 21-22 (1938).
- Debenham, E. M. A modified technique for the microscopic examination of the xylem of whole plants or plant organs. Annals of Botany. 3 (2), 369-373 (1939).
- Morley, T. Accelerated clearing of plant leaves by NaOH in association with oxygen. Stain Technology. 43 (6), 315-319 (1968).

