Ensayo de cribado de alto contenido para la identificación de compuestos modificadores de citotoxicidad celular dependientes de anticuerpos
Summary
Este protocolo presenta una técnica automatizada de alto rendimiento basada en imágenes para identificar compuestos que modulan la destrucción de células de cáncer de mama mediada por células asesinas naturales en presencia de un anticuerpo terapéutico anti-HER-2.
Abstract
La inmunoterapia con anticuerpos antígenos específicos o inhibidores de puntos de control inmunitario ha revolucionado la terapia del cáncer de mama. Las células de cáncer de mama que expresan el receptor del factor de crecimiento epidérmico HER2 pueden ser atacadas por el anticuerpo anti-HER-2 trastuzumab. La citotoxicidad celular dependiente de anticuerpos (ADCC) es un mecanismo importante implicado en la acción antitumoral de HER-2. El trastuzumab unido a las células cancerosas puede ser reconocido por los receptores Fc de las células efectoras ADCC (por ejemplo, células asesinas naturales [NK], macrófagos y granulocitos), lo que desencadena la actividad citotóxica de estas células inmunitarias que conduce a la muerte de las células cancerosas. Nos propusimos desarrollar un ensayo basado en imágenes para la cuantificación de ADCC para identificar nuevos compuestos moduladores de ADCC mediante cribado de alto contenido. En el ensayo, las células de cáncer de mama JIMT-1 que sobreexpresan HER2 se cultivan conjuntamente con células NK-92 en presencia de trastuzumab, y la muerte de las células diana se cuantifica mediante microscopía automatizada y análisis cuantitativo de imágenes. Las células diana se distinguen de las células efectoras en función de su fluorescencia EGFP. Mostramos cómo se pueden probar las bibliotecas de compuestos en el ensayo para identificar fármacos moduladores de ADCC. Para este propósito, se instaló una placa de prueba de biblioteca compuesta utilizando productos químicos finos seleccionados al azar del estante del laboratorio. También se incluyeron en la biblioteca de pruebas tres compuestos desestabilizadores de microtúbulos (colchicina, vincristina, podofilotoxina) que se esperaba que interfirieran con la migración y desgranulación de las células NK. La pantalla de prueba identificó los tres compuestos de control positivo como éxitos que demuestran la idoneidad del método para identificar fármacos modificadores de ADCC en una biblioteca química. Con este ensayo, se pueden realizar exámenes de biblioteca de compuestos para identificar compuestos que mejoran el ADCC que podrían usarse como agentes terapéuticos adyuvantes para el tratamiento de pacientes que reciben inmunoterapias contra el cáncer. Además, el método también se puede utilizar para identificar cualquier efecto secundario inhibidor de ADCC indeseable de los fármacos terapéuticos tomados por pacientes con cáncer para diferentes indicaciones.
Introduction
La inmunoterapia con anticuerpos contra el cáncer, inhibidores de puntos de control inmunitario o células T que expresan receptores de antígenos quiméricos (CAR-T) representa un enfoque poderoso para el tratamiento del cáncer 1,2,3. Trastuzumab es un anticuerpo monoclonal humanizado anti-HER-2 (receptor 2 del factor de crecimiento epidérmico humano) utilizado para tratar el cáncer de mama en estadio temprano o metastásico HER-2 positivo, así como el cáncer gástrico metastásico HER-2 positivo 4,5,6. Actúa principalmente inhibiendo el efecto estimulante de la proliferación del factor de crecimiento epidérmico4. Sin embargo, se ha informado que trastuzumab desencadena eficientemente la muerte de las células cancerosas, incluso si las células cancerosas han perdido su capacidad de respuesta a la estimulación de HER-27. Este efecto paradójico del anticuerpo se debe a la citotoxicidad mediada por células dependientes de anticuerpos (ADCC)7. El ADCC puede ser mediado por células asesinas naturales (NK), granulocitos y macrófagos conocidos colectivamente como las células efectoras de ADCC 8,9. Si un anticuerpo, como trastuzumab, se une a las células tumorales, entonces estas células efectoras usan sus receptores Fc para unirse a la región constante (Fc) del anticuerpo. El anticuerpo une las células tumorales y las células efectoras portadoras del receptor Fc, desencadenando la liberación de sus mediadores citotóxicos10. Las células asesinas naturales liberan la carga citotóxica de sus gránulos que contienen perforina para generar poros en la membrana celular diana y granzima (desencadenando vías de señalización de muerte celular) en la sinapsis inmune que conduce a la apoptosis de las células cancerosas (ver Figura 1).
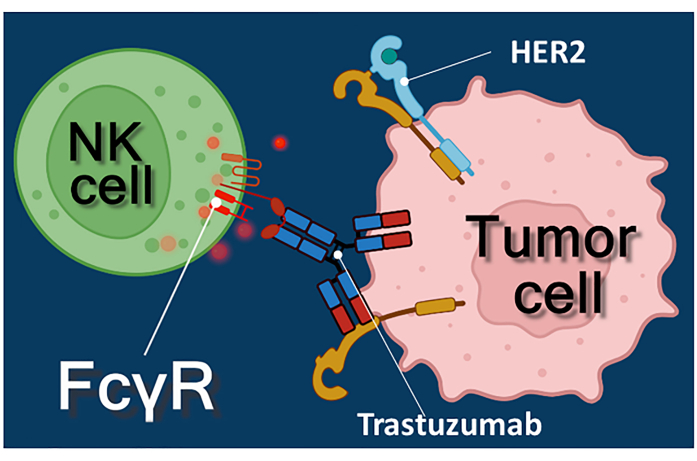
Figura 1: Interacciones entre células efectoras y diana en ADCC. El receptor Fcγ de la superficie celular de la célula NK efectora reconoce la región Fc del anticuerpo anti-HER2 trastuzumab específico para la molécula HER2 expresada en la superficie de la célula tumoral. Así, se establece la llamada sinapsis inmunológica entre las dos células, induciendo la exocitosis dirigida de gránulos citotóxicos de la célula efectora. Las moléculas de perforina y granzima liberadas eventualmente resultan en la apoptosis de la célula diana. Haga clic aquí para ver una versión más grande de esta figura.
Se han desarrollado previamente varios ensayos para cuantificar la citotoxicidad, incluido el ADCC. El estándar de oro es el método de liberación de cromo radiactivo, donde las células diana se marcan con isótopo radiactivo 51Cr, y el ADCC se cuantifica midiendo la radiactividad del sobrenadante de las células diana lisadas11. Debido a los problemas obvios debido al manejo, almacenamiento y eliminación estrictamente regulados de farmacones y desechos radiactivos, este método se ha vuelto cada vez más impopular entre los científicos de la vida. Además, tampoco es susceptible de aplicaciones de alto rendimiento. La medición de la actividad de las enzimas (por ejemplo, lactato-deshidrogenasa) liberadas de las células diana muertas puede proporcionar una alternativa no radiactiva al ensayo 51Cr12. Estos ensayos, sin embargo, no distinguen entre muertes de células diana y efectoras. La detección de impedancia de sustrato celular eléctrico (ECIS) demostró ser adecuada para la cuantificación de ADCC13, pero el equipo ECIS no está disponible en la mayoría de los laboratorios y la técnica no es compatible con aplicaciones / cribado de alto rendimiento. Las células marcadas con fluorescencia representan una alternativa popular en muchos ensayos de biología celular y se utilizan a menudo en citometría de flujo o aplicaciones basadas en lectores de placas14,15,16. Sin embargo, estos ensayos a menudo contienen pasos de lavado o son incompatibles con aplicaciones de alto rendimiento (por ejemplo, técnicas basadas en citometría de flujo). Algunos ensayos populares de citotoxicidad, que en teoría deberían ser adecuados para la cuantificación del ADCC, no logran determinar de manera confiable la eficiencia del ADCC13. Recientemente, con la difusión de la microscopía confocal fluorescente, los ensayos basados en imágenes y de alto contenido se están volviendo cada vez más populares en diversas áreas de las ciencias de la vida17. Por un lado, los equipos de imágenes celulares son ahora bastante ubicuos, mientras que, por otro lado, se pueden recopilar parámetros morfológicos prácticamente infinitos a partir de las imágenes adquiridas. Por lo tanto, nos propusimos desarrollar un ensayo ADCC compatible con el cribado de alto contenido y demostrar su idoneidad para el cribado de bibliotecas compuestas.
Aquí, presentamos un ensayo ADCC basado en imágenes y demostramos cómo se puede usar este ensayo para la detección de alto contenido (HCS) para identificar compuestos moduladores de ADCC. El modelo se basa en células diana de carcinoma de mama JIMT-1, células efectoras CD16.176V.NK-92 y el anticuerpo monoclonal humanizado anti-HER2 trastuzumab. Con este método, es posible identificar fármacos que pueden mejorar la acción destructora de tumores de las células NK o obtener información sobre el mecanismo del ADCC mediado por células NK mediante la identificación de moléculas pequeñas que interfieren con el ADCC. Sugerimos que los científicos de la vida que buscan cuantificar la citotoxicidad mediada por células con especial atención al ADCC pueden beneficiarse del uso de este ensayo, ya sea para la ciencia del descubrimiento o el desarrollo de fármacos. Este ensayo puede ser una alternativa si un laboratorio tiene acceso y cierta experiencia en imágenes fluorescentes y análisis cuantitativo de imágenes.
Protocol
Representative Results
Discussion
La reacción del ADCC se ha descrito hace relativamente mucho tiempo. También se han descrito eventos moleculares clave del proceso19. Los métodos para medir el ADCC van desde el ensayo de liberación de cromo radiactivo estándar de oro, los ensayos de liberación de enzimas citoplasmáticas hasta varios ensayos de citometría de flujo o microplacas basados en fluorescencia20. Sin embargo, una limitación común de estos ensayos es que no son susceptibles de aplicaciones…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
LV recibió fondos de la Oficina Nacional de Investigación, Desarrollo e Innovación subvenciones GINOP-2.3.2-15-2016-00010 TUMORDNS”, GINOP-2.3.2-15-2016-00048-STAYALIVE y OTKA K132193, K147482. Las células CD16.176V.NK-92 se obtuvieron del Dr. Kerry S. Campbell (Fox Chase Center, Philapedlphia, PA, en nombre de Brink Biologics, lnc. San Diego, CA), están protegidos por patentes en todo el mundo, y fueron licenciados por Nantkwest, lnc. Los autores agradecen a György Vereb y Árpád Szöőr por su ayuda con el uso de la línea celular NK-92 y por el asesoramiento técnico.
Materials
| 5-fluorouracil | Applichem | A7686 | in compound library |
| 96-well Cell Carrier Ultra plate | PerkinElmer | LLC 6055302 | |
| Betulin | Sigma | B9757 | in compound library |
| CD16.176V.NK92 cells | Nankwest Inc. | ||
| Cerulenin | ChemCruz | sc-396822 | in compound library |
| Cisplatin | Santa Cruz Biotechnology | sc-200896 | in compound library |
| Colchicine | Sigma | C9754 | in compound library |
| Concanavalin-A | Calbiochem | 234567 | in compound library |
| Dexamethasone | Sigma | D4902 | in compound library |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT-1 EGFP medium |
| DMSO | Sigma | D2650 | in compound library |
| Etoposide | Sigma | E1383 | E1383 |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1 EGFP and NK medium |
| Fisetin | Sigma | F4043 | in compound library |
| Freedom EVO liquid handling robot | TECAN | ||
| Gallotannin | Fluka Chemical Corp. | 16201 | in compound library |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| Harmony software | PerkinElmer | ||
| Humanized anti-HER2 monoclonal antibody (Herzuma) | EGIS Pharmaceuticals, Budapest Hungary | N/A | |
| Humulin R (insulin) | Eli Lilly | HI0219 | JIMT-1 EGFP medium |
| IL-2 | Novartis Hungária Kft. | PHC0026 | in NK medium |
| Isatin | Sigma | 114618 | in compound library |
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Naringenin | Sigma | N5893 | in compound library |
| NQDI-1 | Sigma | SML0185 | in compound library |
| Opera Phenix High-Content Analysis equipment | PerkinElmer | ||
| Penicillin–streptomycin | Biosera | LM-A4118 | JIMT-1 EGFP and NK medium |
| Pentoxyfilline | Sigma | P1784 | in compound library |
| Phosphate buffered saline (PBS) | Lonza | BE17-517Q | to wash the cells |
| Podophyllotoxin | Sigma | P4405 | in compound library |
| Quercetin | Sigma | Q4951 | in compound library |
| Tannic acid | Sigma | T8406 | in compound library |
| Temozolomide | Sigma | T2577 | in compound library |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Vincristine sulfate | Sigma | V0400000 | in compound library |
| α-MEM | Sigma | M8042 | in NK medium |
Riferimenti
- Gupta, S. L., Basu, S., Soni, V., Jaiswal, R. K. Immunotherapy: an alternative promising therapeutic approach against cancers. Molecular Biology Reports. 49 (10), 9903-9913 (2022).
- Moretti, A., et al. The past, present, and future of non-viral CAR T cells. Frontiers in Immunology. 13, 867013 (2022).
- June, C. H., O’Connor, R. S., Kawalekar, O. U., Ghassemi, S., Milone, M. C. CAR T cell immunotherapy for human cancer. Science. 359 (6382), 1361-1365 (2018).
- Ross, J. S., et al. The HER-2 receptor and breast cancer: ten years of targeted anti-HER-2 therapy and personalized medicine. Oncologist. 14 (4), 320-368 (2009).
- Shitara, K., et al. Discovery and development of trastuzumab deruxtecan and safety management for patients with HER2-positive gastric cancer. Gastric Cancer. 24 (4), 780-789 (2021).
- Gianni, L., et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncology. 13 (1), 25-32 (2012).
- Barok, M., et al. Trastuzumab causes antibody-dependent cellular cytotoxicity-mediated growth inhibition of submacroscopic JIMT-1 breast cancer xenografts despite intrinsic drug resistance. Molecular and Cancer Therapy. 6 (7), 2065-2072 (2007).
- Gauthier, M., Laroye, C., Bensoussan, D., Boura, C., Decot, V. Natural Killer cells and monoclonal antibodies: Two partners for successful antibody dependent cytotoxicity against tumor cells. Crit Rev Oncol Hematol. 160, 103261 (2021).
- Gruijs, M., Sewnath, C. A. N., van Egmond, M. Therapeutic exploitation of neutrophils to fight cancer. Semin Immunol. 57, 101581 (2021).
- Mando, P., Rivero, S. G., Rizzo, M. M., Pinkasz, M., Levy, E. M. Targeting ADCC: A different approach to HER2 breast cancer in the immunotherapy era. Breast. 60, 15-25 (2021).
- van der Haar Avila, I., Marmol, P., Kiessling, R., Pico de Coana, Y. Evaluating antibody-dependent cell-mediated cytotoxicity by chromium release assay. Methods in Molecular Biology. 1913, 167-179 (2019).
- Broussas, M., Broyer, L., Goetsch, L. Evaluation of antibody-dependent cell cytotoxicity using lactate dehydrogenase (LDH) measurement. Methods in Molecular Biology. 988, 305-317 (2013).
- Toth, G., Szollosi, J., Vereb, G. Quantitating ADCC against adherent cells: Impedance-based detection is superior to release, membrane permeability, or caspase activation assays in resolving antibody dose response. Cytometry A. 91 (10), 1021-1029 (2017).
- Chung, S., Nguyen, V., Lin, Y. L., Kamen, L., Song, A. Thaw-and-use target cells pre-labeled with calcein AM for antibody-dependent cell-mediated cytotoxicity assays. Journal of Immunological Methods. 447, 37-46 (2017).
- Lee-MacAry, A. E., et al. Development of a novel flow cytometric cell-mediated cytotoxicity assay using the fluorophores PKH-26 and TO-PRO-3 iodide. Journal of Immunological Methods. 252 (1-2), 83-92 (2001).
- Tanito, K., et al. Comparative evaluation of natural killer cell-mediated cell killing assay based on the leakage of an endogenous enzyme or a pre-loaded fluorophore. Analytical Science. 37 (11), 1571-1575 (2021).
- Lin, S., Schorpp, K., Rothenaigner, I., Hadian, K. Image-based high-content screening in drug discovery. Drug Discovery Today. 25 (8), 1348-1361 (2020).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to trastuzumab-mediated ADCC. Cancer Immunology, Immunotherapy. 71 (9), 2151-2168 (2022).
- Li, F., Liu, S. Focusing on NK cells and ADCC: A promising immunotherapy approach in targeted therapy for HER2-positive breast cancer. Frontiers in Immunology. 13, 1083462 (2022).
- Perussia, B., Loza, M. J. Assays for antibody-dependent cell-mediated cytotoxicity (ADCC) and reverse ADCC (redirected cytotoxicity) in human natural killer cells. Methods in Molecular Biology. 121, 179-192 (2000).
- Garcia-Alonso, S., Ocana, A., Pandiella, A. Trastuzumab emtansine: Mechanisms of action and resistance, clinical progress, and beyond. Trends in Cancer. 6 (2), 130-146 (2020).

